 2) Chlor, Cl (łac. Chlorum, od stgr. chloros - "zielonożółty") - jest to pierwiastek chemiczny z grupy fluorowców, niemetal o liczbie atomowej 17.
2) Chlor, Cl (łac. Chlorum, od stgr. chloros - "zielonożółty") - jest to pierwiastek chemiczny z grupy fluorowców, niemetal o liczbie atomowej 17.
Izotopy stabilne to 35Cl i 37Cl. Chlor jest żółtozielonym gazem około dwa i pół razy cięższym od powietrza, o nieprzyjemnym, duszącym zapachu, silnie trującym. Jest silnym utleniaczem, wybielaczem i środkiem dezynfekującym. Wchodzi w skład wielu powszechnie spotykanych solioraz innych związków.
Właściwości: Wolny chlor występuje w postaci dwuatomowych cząsteczek Cl2. W związkach występuje na stopniach utlenienia od −I do VII. Chlor jest bardzo aktywny chemicznie, chociaż mniej niż fluor. W obecności rozproszonego światła słonecznego łączy się z wodorem tworząc chlorowodór. W pełnym świetle słonecznym ta reakcja przebiega wybuchowo.
- Cl2 + H2 → 2HCl
Chlor łączy się bezpośrednio z większością pierwiastków na skutek czego powstają chlorki.
W 1 litrze wody o temperaturze 25 °C rozpuszcza się 2,3 l chloru tworząc tzw. wodę chlorową. Z wodą reaguje powoli, tworząc chlorowodór i kwas podchlorawy (HOCl): Cl2 + H2O → HCl + HOCl.
Chlorki należą do I grupy analitycznej anionów.
 |
| Źródło: zasoby1.open.agh.edu.pl - Elektrolityczne otrzymywanie wodorotlenku sodu NaOH i gazowego chloru metodą przeponową (z zastosowaniem membrany). |
Diafragma = przepona
W chemii organicznej używa się gazowego chloru jako utleniacza; czasami zamiast formy gazowej wykorzystuje się wodę chlorową. Chlor jest jednym z możliwych podstawników, zastępującego w związkach organicznych atom wodoru (np. chlorek winylu i produkowany z niego PCW, w produkcji gumy syntetycznej).
Inne zastosowania to produkcja chloranów, chloroformu, tetrachlorku węgla i ekstrakcja bromu.
Występowanie chloru:
W przyrodzie chlor występuje w ilości 0,19% (wagowo), tylko w postaci jonu chlorkowego Cl−, który jest głównym anionem występującym w oceanach. Jony chlorkowe stanowią ok. 1,9% masy wszystkich oceanów. Jeszcze większa koncentracja chlorków występuje w wodach słonych jezior (w Morzu Martwym ok. 21%) i podziemnych złożach solanki.
(...)
Większość chlorków jest rozpuszczalna w wodzie, dlatego w większych ilościach w stanie stałym można je znaleźć tylko w suchym klimacie lub podziemnych złożach soli. Główne minerały zawierające chlor to halit (sól kamienna, NaCl), sylwin (chlorek potasu) i karnalit (uwodniony podwójny chlorek potasu i magnezu).
Znaczenie biologiczne chloru: Jest powszechny w przyrodzie i występuje w większości organizmów żywych. Chlor ma duże znaczenie biologiczne, należy do makroelementów. Jony chloru należą do głównych anionów w płynach organizmu, a kwas solny jest używany do trawienia przez wiele zwierząt (wydzielany w żołądku). W organizmie człowieka o wadze 70 kg znajduje się około 95 g chloru.
Toksyczność chloru:
Gazowy chlor działa drażniąco na układ oddechowy i błony śluzowe, może prowadzić do obrzęku płuc, a w dużych stężeniach do śmierci. W powietrzu jest wyczuwalny przy stężeniu 3,5 ppm, stężenie śmiertelnie niebezpieczne to ponad 800 ppm. Z powodu tych właściwości był stosowany jako broń chemiczna w czasie I wojny światowej. Wartość średnia ważona dopuszczalna w długim przedziale czasu (8 godzin na dzień) nie powinna przekroczyć 0,7 mg/m3; NDSCh wynosi 1,5 mg/m3.
Trujące gazy (trichlorek azotu) mogą się wydzielać przy kontakcie wybielaczy zawierających chlor z moczem, a także z amoniakiem lub innymi produktami czyszczącymi.
--> Chlorki:
a) Chlorki kwasowe:
b) Chlorki organiczne:
---------------
--> Kwasy chloru:
--> Organiczne związki chloru:
--> Pochodne tlenowych kwasów chloru:
Pol: Scharakteryzuj i porównaj ze sobą sole tlenowych kwasów chloru. Porównanie przedstaw w formie tabeli zawierającej następujące rubryki: 1) wzór anionu; 2) nazwa systematyczna IUPAC/addytywna; 3) nazwa półsystematyczna; 4) nazwa Stocka; 5) opis.
 2) Brom (Br, gr. bromos - oznacza "mocno pachnący" lub "smród", łac. bromum) - jest to pierwiastek chemiczny, niemetal z grupy fluorowców w układzie okresowym. W warunkach normalnych jest brunatnoczerwoną cieczą o ostrym, nieprzyjemnym zapachu zbliżonym do zapachu chloru. Znanych jest jest 25 izotopów bromu o czasie półtrwania minimum 1 ms o liczbach masowych w zakresie 70÷94, z których izotopy o liczbie masowej 79 i 81 są trwałe i występują w naturze w prawie równej ilości (50,6:49,4).
2) Brom (Br, gr. bromos - oznacza "mocno pachnący" lub "smród", łac. bromum) - jest to pierwiastek chemiczny, niemetal z grupy fluorowców w układzie okresowym. W warunkach normalnych jest brunatnoczerwoną cieczą o ostrym, nieprzyjemnym zapachu zbliżonym do zapachu chloru. Znanych jest jest 25 izotopów bromu o czasie półtrwania minimum 1 ms o liczbach masowych w zakresie 70÷94, z których izotopy o liczbie masowej 79 i 81 są trwałe i występują w naturze w prawie równej ilości (50,6:49,4).
Występowanie: Występuje w skorupie ziemskiej w ilościach śladowych 0,37 ppm (wagowo, 1,6×10−4[), głównie jako zanieczyszczenie piasku morskiego i pokładów soli kamiennej. Większe jego ilości (65 ppm) występują w wodzie morskiej. W obu przypadkach występuje on w formie bromku sodu.
Zastosowanie: Stosuje się go w wielu reakcjach np. do syntezy bromków alkilowych, które są bardziej reaktywne od odpowiednich chlorków. Bromek srebra w XX w. był masowo wykorzystywany w technikach litograficznych i fotograficznych. Bromek potasu był szeroko stosowanym środkiem w Wojsku Polskim mającym na celu tłumienie napięcia seksualnego u żołnierzy.
Znaczenie biologiczne: Brom jest obecny we wszystkich organizmach w ilościach zbliżonych do jego stężenia w wodzie morskiej (ok. 50 ppm), nie odgrywa on jednak żadnej roli w procesach życiowych. W dużych ilościach czysty brom jest silnie toksyczny. Jony bromkowe Br− są nieszkodliwe, o ile ich stężenie nie przekracza tego obecnego w wodzie morskiej.
--> Tlenowe kwasy bromu:
















































































































































































































































































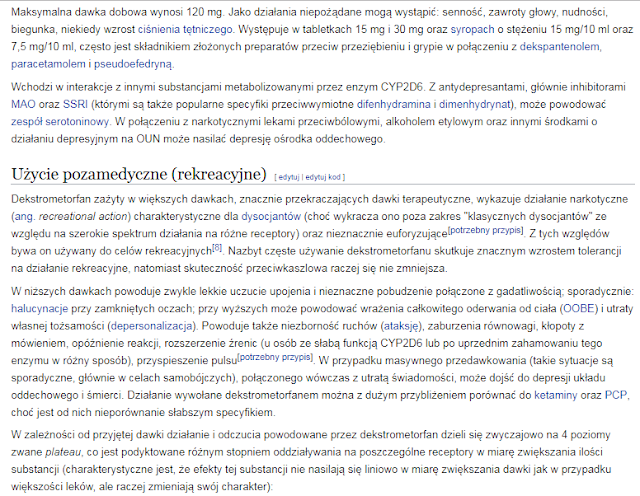
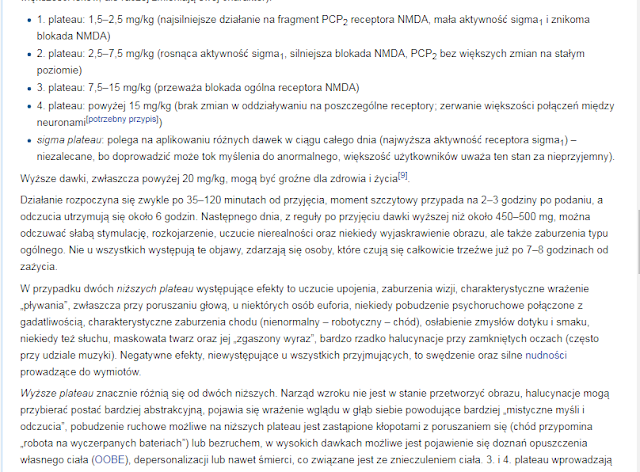































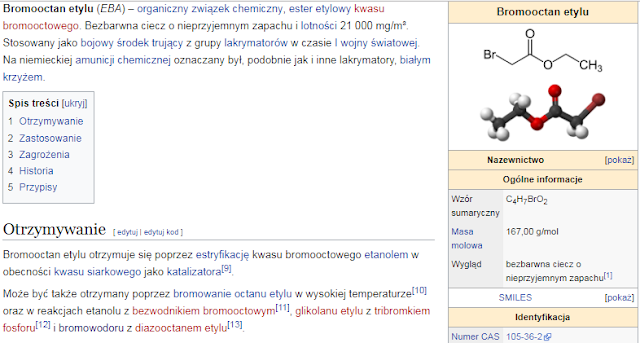










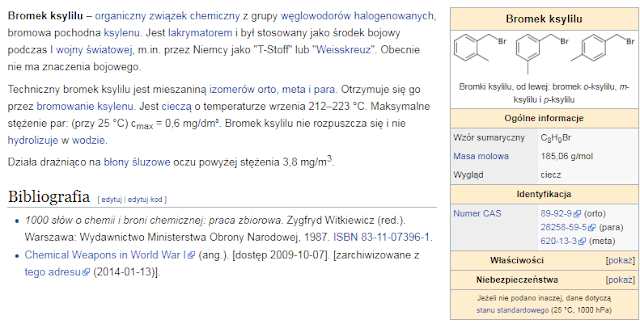

















































Brak komentarzy:
Prześlij komentarz