Neuropeptydy to peptydy o funkcji mediatorów, które syntezowane są zarówno w neuronach (w obszarze perikarionu - ciała komórki nerwowej), jak i w innych komórkach organizmu. Są to związki o znacznie większej cząsteczce niż klasyczne neurotransmitery. Wydzielane neuropeptydy pełnią szereg różnorodnych funkcji, m.in. uczestnicząc w transmisji i modulacji sygnałów nerwowych, nośników informacji neurohormonalnych do innych organów organizmu, regulatorów odpowiedzi układu odpornościowego, bezpośredniego działania na grzyby oraz bakterie. W ostatnich latach obserwować jesteśmy w stanie gwałtowny rozwój prac nad izolowaniem oraz badaniem biologicznej roli nowych neuropeptydów. Od innych związków biologicznie czynnych różnią neuropeptydy właściwości biologiczne, fizykochemiczne, ograniczony sposób przechodzenia przez błony biologiczne, strukturalna zmienność, a także specyficzny metabolizm. Do niedawna interesowano się tylko peptydami i ich potencjalnym zastosowaniem jako leki. Ostatnie postępy w chemii medycznej otwierają zaś nowe możliwości w celu poszukiwania leków na bazie neuropeptydów. Głównym kierunkiem badań jest rola neuropeptydów w regulowaniu sygnałów bólowych i możliwości zastosowania ich analogów jako nowych analgetyków (środków prowadzących do analgezji, czyli zniesienia poczucia bólu, czyli środków przeciwbólowych). Szczególną uwagą są obdarzone peptydy bifunkcyjne, które posiadają powinowactwo do dwóch rodzajów receptorów biorących udział w regulacji bólu (receptora opioidowego, tachykininowego i neurotensynowego).
Wiele informacji dotyczących charaktery współczesnych badań nad neuropeptydami, które zostały wymienione w powyższym opisie i definicji zaczerpnąłem ze strony Zakładu Neuropeptydów Instytutu Medycyny Doświadczalnej i Klinicznej im. M. Mossakowskiego w Warszawie.
Wiele informacji dotyczących charaktery współczesnych badań nad neuropeptydami, które zostały wymienione w powyższym opisie i definicji zaczerpnąłem ze strony Zakładu Neuropeptydów Instytutu Medycyny Doświadczalnej i Klinicznej im. M. Mossakowskiego w Warszawie.
Bombezyna (GRP, z ang. Gastrin Releasing Peptide) to białko uwalniające gastrynę. Jest ono peptydem zbudowanym z 14 aminokwasów. Pierwotnie została wyizolowana ze skóry płaza kumaka nizinnego (Bombina bombina) z rodziny kumakowatych. Bombezyna wywiera wpływ stymulujący na wydzielanie hormonów przysadkowych i pobudza sekrecję śluzowej i surowiczej wydzielony z nosa.
 |
| Źródło: www.borekwielki.szkola.pl - Zdjęcie przedstawia kumaka nizinnego (Bombina bombina) - pierwszy organizm ze skóry którego wyizolowana została bombezyna. |
Cholecystokinina (CCK; dawniej znana jako pankreozymina) - to cała rodzina hormonów peptydowych, które działają w obrębie układu pokarmowego oraz ośrodkowego układu nerwowego. Jest wydzielany m.in. przez śluzówkę dwunastnicy i jelita czczego. Zadaniem cholecystokininy jest stymulacja wydzielania żółci i soku trzustkowego (wraz z insuliną). Pozwala również na dostosowanie składu tego soku do proporcji składników odżywczych w diecie. Bodźcem do zwiększenia wydzielania cholecystokininy są głównie produkty częściowego trawienia tłuszczów i nadtrawienia białek. Hormon ten osłabia perystaltykę jelitową, umożliwiając dłuższy kontakt tłustego pokarmu z lipazami. Cholecystokinina ma również działanie hamujące uczucie głodu. Jest ona złożona z 33 aminokwasów i w swej budowie zbliżona do innego hormonu przewodu pokarmowego - gastryny. Hormon ten działa jako neurohormon w ośrodkowym układzie nerwowym. Inhibitory TPP II (Trójpeptydylpeptydazy II, enzymy proteolityczne komórek) mogą zapobiegać degradacji cholecystokininy i działać na zmniejszenie spożywanego pokarmu i skrócenie czasu posiłku.
Działanie cholecystokininy jest następujące:
 |
| Źródło: Slideplayer.pl, prezentacja pt. "Czynność wątroby - Fizjologia człowieka", slajd 20, autor: Ksawery Czaja. |
Działanie cholecystokininy jest następujące:
- pobudzanie wydzielania enzymów trzustkowych
- skurcz pęcherzyka żółciowego
- wzrost przepływu krwi i przyspieszenie metabolizmu w komórkach trzustki
- skurcz odźwiernika
- przyspieszenie motoryki jelit
- potęgowanie wydzielania wodorowęglanów przez trzustkę
- pobudzenie wydzielania glukagonu
- lecznicze działanie u osób z nadwagą
 |
| Źródło: portal.bioslone.pl : Schemat regulacji hormonalnej wydzielania soku trzustkowego i jelitowego. |
 |
| Źródło: Slideplayer.pl, prezentacja pt. "Zajęcia seminaryjne nr 4", autor: Franciszek Pietrak. |
Grelina - jest to 28-aminokwasowy hormon peptydowy, zidentyfikowany w żołądku szczura jako endogenny ligand dla receptora uwalniającego hormon wzrostu. Grelina wydzielana jest w czasie głodzenia się, z komórek enteroendokrynnych typu A żołądka. Zawiera n-oktaacylową modyfikację na serynie w pozycji trzeciej, która jest istotna dla wywołanej greliną stymulacji uwalniania hormonu wzrostu, natomiast deacylowana grelina w formie des-n-oktaacylowanej jest nieaktywna biologicznie.
Grelina ludzka i grelina szczurza różnią się tylko dwoma podstawnikami aminokwasowymi. Grelina, która jest produkowana i wydzielana w żołądku ma różne działania regulacyjne w mózgu i obwodowe. Przy podaniu obwodowo lub centralnie gryzoniom grelina powoduje szybko wzrost ilości przyjmowanego pokarmu i przyrost masy ciała, w dodatku zwiększa motorykę i wydzielanie kwasów żołądkowych. Najbliższym homologiem receptora dla greliny jest receptor dla motyliny, która wydzielana jest w podobnych miejscach i również oddziałuje na autonomiczny układ nerwowy. U gryzoni poziom greliny we krwi wzrasta podczas głodzenia, natomiast ulega obniżeniu po podaniu pokarmu lub jego wprowadzeniu do żołądka. Takiego działania nie wywołuje woda. Grelina krążąca we krwi ma znaczne stężenie w surowicy.
Pojedyncze podanie ośrodkowe greliny w dawkach 0,3, 1,5 i 3 nmol na szczura spowodowało znaczący dawkozależny wzrost w ilości przyjmowanego pokarmu 24 godziny po podaniu w porównaniu do kontroli. Najwyższa dawka spowodowała wzrost ilości przyjmowanego pokarmu już w godzinę po podaniu, co pozostaje w zgodzie z wcześniejszymi obserwacjami.
Proces uwalniania serotoniny jest hamowany przez grelinę. Grelina nie posiada natomiast wpływu na uwalnianie noradrenaliny. Ta ostatnia pobudza przyjmowanie pokarmu przez wpływ na receptory alfa2, natomiast leptyna i IL-1beta hamują jej uwalnianie z synaptozomów w podwzgórzu, co może tłumaczyć w pewien sposób anorektyczne działanie leptyny.
 |
| Źródło: wiem-co-jem.pl |
Grelina może także antagonizować anorektyczne działanie leptyny poprzez aktywację szlaku receptorowego białka Y/Y1 w podwzgórzu. Poszukiwania odwrotnych agonistów pokazały, iż odcinek [D-Arg1,D-Phe5,D-Trp7,9,Leu11] substancji P wykazuje takie działanie, jednakże jest ono niespecyficzne, ponieważ oddziałuje również na tachukininę nK1. Grelina pobudza swoją własną ekspresję na zasadzie sprzężenia zwrotnego dodatniego, a także uwrażliwia komórki na swoją obecność przez wzrost ekspresji receptora grelinowego, w komórkach docelowych.
 |
| Źródło: Wikipedia: Cząsteczka Oreksyny. |
 |
| Źródło: btchflcks.com: Na narkolepsję cierpiał jeden z głównych bohaterów filmu "Moje własne Idaho". |
Met-enkefalina - jest to endogenny opioidowy peptyd działający jako neuroprzekaźnik, który naturalnie występuje w wielu tkankach zwierzęcych, w tym w tkankach ludzkich. Jest często nazywana opioidowym czynnikiem wzrostu (OGF). Jednym z głównych miejsc występowania met-enkefaliny jest segment II rogu grzbietowego rdzenia kręgowego, a także w ośrodkowym układzie nerwowym. Powstaje ona z prekursora, którym jest proenkefalina A kodowana przez gen PPE. Gen ten koduje białko, które składa się z 267 aminokwasów, w tym sześciu sekwencji met-enkefaliny i jednej sekwencji leu-enkefaliny, heptapeptydu Met-enkefalina-Arg6-Phe7 i oktapeptydu met-kefalina-Arg6-Phe7-Leu8. Enkefaliny zostają uwolnione z proenkefaliny poprzez działanie proteazy, nie pochodzą natomiast z beta-endorfin, których pro hormonem jest proopiomelanokortyna. Analogiczna do grupy 3-hydroksylowej w morfinie uważana jest reszta tyrozyny (pozycja 1). Oprócz roli neuroprzekaźnika met-enkefalina posiada również aktywność cytokin, do których zazwyczaj nie jest zaliczany z powodu swoich niewielkich rozmiarów. Wpływa on na komórkę poprze oddziaływanie z receptorem nazwanym Zeta (ζ), ponieważ uważano, że jest kolejnym receptorem opioidowym. Jednakże po zsekwencjonowaniu zastał nazwany receptorem opioidowego czynnika wzrostu (OGFr). Receptory OGF zidentyfikowano w wielu prawidłowych i nowotworowych komórkach oraz tkankach, które nie wykazywały żadnej homologi do klasycznych receptorów opioidowych. OGF reguluje powielanie się komórek i organizację tkanek w okresie rozwoju, nowotworzenia, odnowy komórkowej, gojenia ran i angiogenezy. Wiele ludzkich rakowych linii komórkowych jest inhibowanych przez OGF in vitro. Hamujący wpływ OFG został potwierdzony wobec raka trzustki, hepatoblastomy (wątrobiaka zarodkowego - rzadkiego złośliwego guza wątroby wieku dziecięcego, który utworzony jest z komórek przypominających komórki płodowej lub niedojrzałej wątroby i wewnątrzwątrobowych dróg żółciowych); raka sutka (raka gruczołu sutkowego), który stanowi najczęstszy nowotwór złośliwy gruczołu sutkowego, który wywodzi się z tkanki nabłonkowej; raka jajnika - nowotworu złośliwego kobiet, który występuje głównie w okresie około- i pomenopauzalnym. Wywodzi się on z komórek nabłonka pokrywającego jajnik. Często daje objawy dopiero w późnych stadiach; raka płuca (inaczej raka oskrzela) - najczęstszego nowotworu złośliwego, na który umiera rocznie na całym świecie 1,3 mln osób. Jest on jednym z najgorzej rokujących nowotworów. Stanowi najczęstszą przyczynę zgonów z powodu raka u mężczyzn i jest na 2. miejscu pod tym względem u kobiet.
W pewnych przypadkach komórki rakowe wykazują niewystarczającą produkcję met-enkefaliny, aby kontrolować wzrost komórki rakowej. W tego typu przypadkach komórki mogą produkować dodatkowe receptory, aby wyłapywać jakikolwiek dostępny OGF. W takich wypadkach podawanie OGF prowadzi do aktywacji receptorów (OGFr) i spowolnienie wzrostu komórki nowotworowej. W innych przypadkach produkcja OGF jest wystarczająca, natomiast produkcja receptorów OGF jest zbyt mała, aby pozwolić komórce wyłapywać OGF i spowolnić swój wzrost. Jednakże nawet w przypadkach takich jak rak trzustki, kiedy zdolność komórek do produkcji OGF drastycznie spada, wykazano, że podawanie OGF pacjentom może znacząco spowolnić wzrost komórek rakowych i w rezultacie przedłużyć życie.
Neurokinina B - jest to neuroprzekaźnik peptydowy z grupy tachykinin. Występuje on w wysokim stężeniu u ciężarnych kobiet, u których dochodzi do rozwoju stanu przedrzucawkowego (nadciśnienie tętnicze w ciąży). Jest ona wykrywalna od 9 tygodnia ciąży, może zatem służyć do monitorowania kobiet z grupy ryzyka. Zawiera fosfocholinę, która stanowi jedną z substancji maskujących komórki łożyska przed układem odpornościowym matki. W grudniu 2008 roku odkryto, że neurokinina B oraz jej receptor neurokininowy typu 3 stanowią elementy krytyczne systemu, który uruchamia w mózgu uwalnianie gonadoliberyny, co wyzwala kaskadę biochemicznych i neurologicznych procesów prowadzących do osiągnięcia dojrzałości płciowej.
Opiorfina - jest to endogenny związek chemiczny, który wyizolowany został po raz pierwszy z ludzkiej śliny. Pierwsze doświadczenia na myszach wykazują, że związek ten ma działanie przeciwbólowe - 6 razy silniejsze aniżeli morfina. Działanie opiorfiny polega prawdopodobnie na zatrzymaniu rozkładu naturalnych związków przeciwbólowych, opiatów zwanych enkefalinami. Jest to ponadto stosunkowo prosta cząsteczka - polipeptyd, który zbudowany jest z pięciu aminokwasów - Gln-Arg-Phe-Ser-Arg. Pentapeptyd opiorfiny pochodzi z końca N proteiny PROL1 (bogatej w prolinę). Opiorfina inhibuje 2 proteazy: obojętną ekto-endopeptydazę (NEP) i ekto-aminopeptydazę N.
W pewnych przypadkach komórki rakowe wykazują niewystarczającą produkcję met-enkefaliny, aby kontrolować wzrost komórki rakowej. W tego typu przypadkach komórki mogą produkować dodatkowe receptory, aby wyłapywać jakikolwiek dostępny OGF. W takich wypadkach podawanie OGF prowadzi do aktywacji receptorów (OGFr) i spowolnienie wzrostu komórki nowotworowej. W innych przypadkach produkcja OGF jest wystarczająca, natomiast produkcja receptorów OGF jest zbyt mała, aby pozwolić komórce wyłapywać OGF i spowolnić swój wzrost. Jednakże nawet w przypadkach takich jak rak trzustki, kiedy zdolność komórek do produkcji OGF drastycznie spada, wykazano, że podawanie OGF pacjentom może znacząco spowolnić wzrost komórek rakowych i w rezultacie przedłużyć życie.
 |
| Źródło: slideplayer.pl: prezentacja pt. "Peptydy biologicznie czynne", autor: Aleksander Kołodziejczyk, publikacja: Hieronim Kluski. |
 |
| Źródło: slideplayer.pl: prezentacja pt. "Peptydy biologicznie czynne", autor: Aleksander Kołodziejczyk, publikacja: Hieronim Kluski. |
 |
| Źródło: slideplayer.pl: prezentacja pt. "Peptydy biologicznie czynne", autor: Aleksander Kołodziejczyk, publikacja: Hieronim Kluski. |
 |
| Źródło: Wikipedia. Cząsteczka Neurokininy B. |
 |
| Źródło: kosmetolog.com.pl. Neurokinina B występuje w wysokim stężeniu u ciężarnych kobiet u których dochodzi do nadciśnienia tętniczego w ciąży. |
 |
| Źródło: thumbnals-visually.netdna-ssl.com |
Opiorfina - jest to endogenny związek chemiczny, który wyizolowany został po raz pierwszy z ludzkiej śliny. Pierwsze doświadczenia na myszach wykazują, że związek ten ma działanie przeciwbólowe - 6 razy silniejsze aniżeli morfina. Działanie opiorfiny polega prawdopodobnie na zatrzymaniu rozkładu naturalnych związków przeciwbólowych, opiatów zwanych enkefalinami. Jest to ponadto stosunkowo prosta cząsteczka - polipeptyd, który zbudowany jest z pięciu aminokwasów - Gln-Arg-Phe-Ser-Arg. Pentapeptyd opiorfiny pochodzi z końca N proteiny PROL1 (bogatej w prolinę). Opiorfina inhibuje 2 proteazy: obojętną ekto-endopeptydazę (NEP) i ekto-aminopeptydazę N.
 |
| Źródło: zobaczzrozum.filer.wordpress.com. |
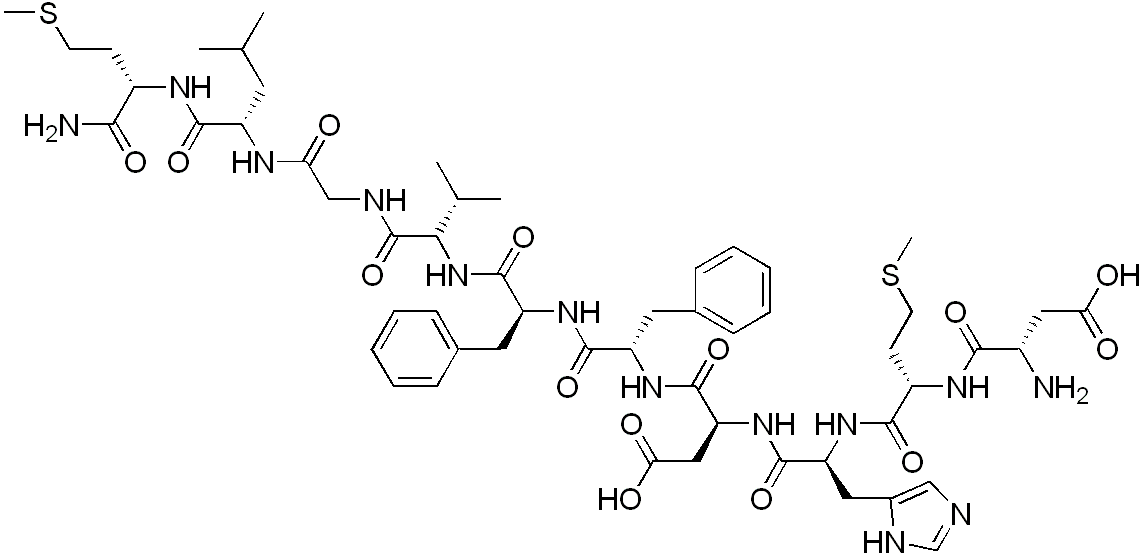
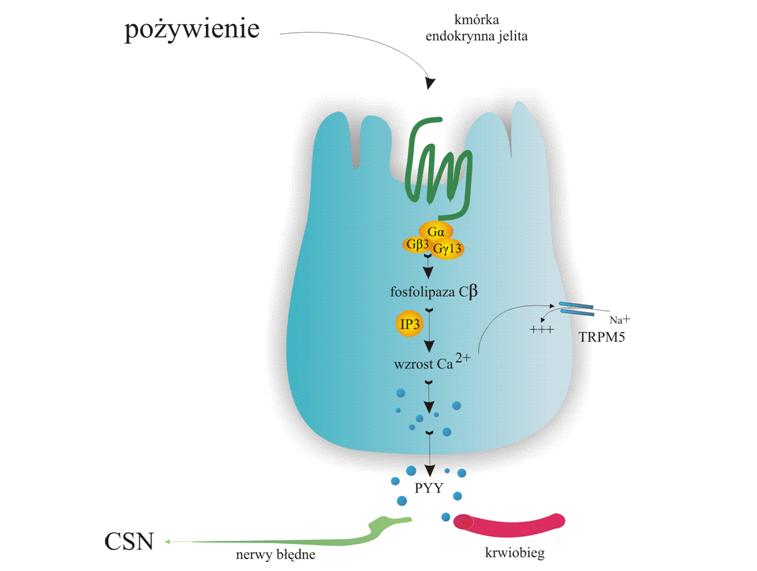
Peptyd YY - (PYY) - jest to neuropeptyd anoreksygeniczny, który pobudza neurony w obszarze jądra łukowatego do uwalniania w ośrodku sytości proopiomelanokortyny (POMC), hormonu alfa-melanotropowego (alfa-MSH) oraz układu CART (cocaine and amphetamine regulated transcript - układ regulowany kokainą i amfetaminą) powodując uczucie sytości oraz zanik apetytu.
 |
| Źródło: Wikipedia; Schemat przedstawia czwartorzędową strukturę peptydu YY. |
Peptyd YY został po raz pierwszy wyizolowany i opisany przez Tatemoto i Mutta w roku 1980, z górnego odcinka jelita cienkiego świń. Z uwagi na duże podobieństwo do peptydu trzustkowego (PP), peptyd YY, podobnie jak neuropeptyd Y (NPY), zostały włączone do jednej rodziny peptydów. W 1985 roku Andrews wraz ze współpracownikami wyizolowali podobny do PYY peptyd u żabnicy. Inne homologi PYY znaleziono w wyspach trzustkowych u ryb z rodziny głowaczowatych (Cottus scorpius) jak i w jelitach europejskich żab pospolitych. Kolejne lata przyniosły szybki rozwój badań nad ludzkim PYY.
PYY to peptyd jelitowy kodowany przez gen zbudowany z 4 egzonów i 3 intronów znajdujących się na chromosomie 17q21, oddalony o 10kb od genu kodującego PP. Peptyd YY podobnie jak nPY, należy do jednych z najbardziej konserwatywnie zachowanych peptydów, którego struktura pierwszorzędowa nie podlegała istotnym zmianom w toku ewolucji. Peptyd YY (ang. synonim peptide tyrosine tyrosine) zawdzięcza swą nazwę resztom tyrozynowym na obu, C i N końcach.
N-koniec(TYR) ----------------- C-koniec(TYR)
(TYR) = Y
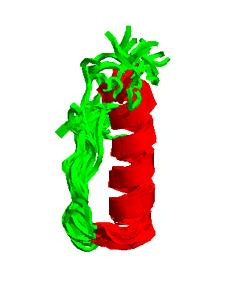
Podbnie jak NPY i PP posiada charakterystyczną U-kształtną strukturę czwartorzędową, którą tworzą: II typ helisy proliny zbudowanej z reszt aminokwasowych 1-8 oraz alfa-helisa utworzona z reszt 15-32. Cztery ostatnie C-końcowe aminokwasy znajdują się w elastycznej pętli.
N-koniec(TYR) ----------------- C-koniec(TYR)
(TYR) = Y
Podbnie jak NPY i PP posiada charakterystyczną U-kształtną strukturę czwartorzędową, którą tworzą: II typ helisy proliny zbudowanej z reszt aminokwasowych 1-8 oraz alfa-helisa utworzona z reszt 15-32. Cztery ostatnie C-końcowe aminokwasy znajdują się w elastycznej pętli.
 |
| Źródło: Wikipedia (EN): artykuł: Peptide YY. |
PYY jest syntetyzowany głównie w komórkach dokrewnych L dystalnej części jelita czczego, a także przez komórki jelita grubego, odbytnicy oraz jelita krętego. Ziarnistości, w których jest przechowywany i uwalniany, znajdują się u podstawy komórki, w mikroskopie elektronowym widoczne są jako stosunkowo duże, okrągłe o jednorodnej gęstości. W jelicie peptyd YY jest prawdopodobnie wspólnie magazynowany i wspólnie wydzielany z glukagonopodobnym peptydem-1 (GLP-1). Komórki syntetyzujące i wydzielające PYY zostały również znalezione w błonie śluzowej żołądka, u człowieka głównie we wpuście, jako nieliczne w części produkującej kwas solny i zidentyfikowane jako takie same, jak komórki zawierające gastrynę. W mniejszym stopniu immunoreaktywność o charakterze PYY wykazują również komórki endokrynne trzustki, jak i wybrane neurony ośrodkowego systemu nerwowego (głównie neurony podwzgórza).
PYY jest wytwarzany a także przechowywany w ziarnistościach w postaci polipeptydu 36 aminokwasowego. W krążeniu dochodzi do jego enzymatycznej modyfikacji. Dwie aminopeptydazy: dipeptydylo-peptydaza-IV (DPP IV) i aminopeptydaza P (APP) zdolne są do odszczepienia od macierzystej formy peptydu, odpowiednio pierwszych dwóch lub pierwszego N-końcowego aminokwasu. Oba enzymy DPP IV, jak i APP, są egzopeptydazami, selektywnymi dla drugiego N-końcowego aminokwasu. Różnią się natomiast produktem końcowym katalizowanej przez siebie reakcji. DPP IV odszczepia od PYY (1-36) dipeptyd Tyr-Pro, podczas gdy APP jedynie końcową resztę Tyr. Produktem preolitycznej modyfiakcji przez DPP IV jest PYY (3-36), natomiast APP- PYY (2-36). Produkty egzopeptydaz posiadają zróżnicowane powinowactwo do receptoró∑ Y. Ppetyd YY (1-36) wykazuje powinowactwo do receptorów Y1, Y4, Y5, forma (3-36) jest selektywnym agonistą receptora Y2. Działanie endopeptydaz: obojętnej endopeptydazy P (NEP) i urokinazowego aktywatora plazminogenu (uPA), znosi całkowicie zdolność powstałych produktów do wiązania z receptorami. Minimalną wielkość peptydu, wymaganą do aktywacji receptora Y2, stanowi 12 N-końcowych reszt aminokwasów. Deaminacja C-końca peptydu YY powoduje utratę powinowactwa do receptorów Y1 i Y2.
Peptyd YY podobnie jak pozostałe peptydy z rodziny nPY stanowi ligand dla receptorów Y1, Y2, Y4 i Y5, które należą do nadrodziny receptorów sprzężonych z białkami G. W przypadku ludzi, gen dla rceptora Y6 w wyniku mutacji związanej z przesunięciem ramki odczytu ulega inaktywacji, tworząc tzw. pseudogen (niedziałającą kopię genu). Receptor Y3 u ludzi nie został do tej pory zidentyfikowany. Receptor Y1, podobnie jak Y4, wiąże oba końce PYY, zarówno C jak i N, Y2 natomiast tylko C-koniec. Peptyd YY (3-36), powstały w wyniku delecji N-końcowych reszt Tyr-Pro, jest swoistym agonistą dla receptora Y2.
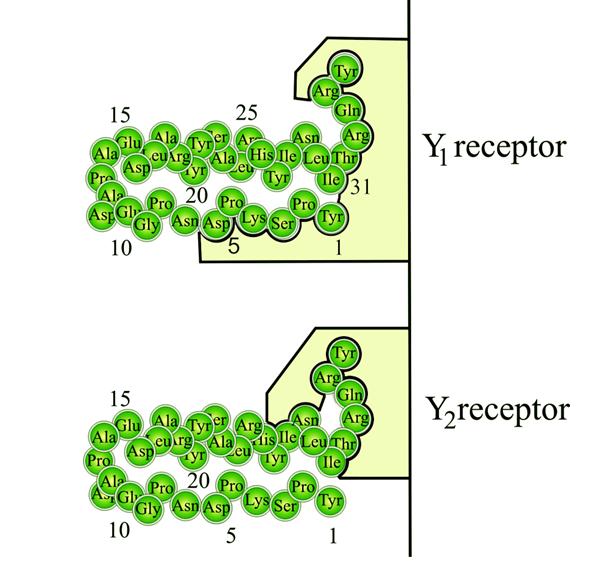 |
| Źródło: Wikipedia; Schemat przedstawia wiązanie peptydu YY (1-36) z podtypami receptora Y. |
Uwalnianie peptydu YY z komórek endokrynnych L regulowane jest poprzez receptory sprzężone z białkami G na drodze kilku mechanizmów. Wydzielanie PYY występuje już na początku posiłku, jeszcze zanim treść pokarmowa zdoła dotrzeć do jelit, co jest powiązane prawdopodobnie z mechanizmem nerwowym. W dalszym etapie hormonu uzależnione jest od rodzaju treści pokarmowej i jest proporcjonalne do jego kaloryczności. Znacznie większy po posiłkowy wzrost stężenia peptydu uzyskujemy w przypadku pokarmów tłuszczowych, w porównaniu z pokarmami o takiej samej kaloryczności, ale białkowymi lub węglowodanowymi. Stężenie PYY wzrasta, osiągając plateau po upływie 1-2 godzin po przyjęciu pokarmu i pozostaje podwyższone do 6 godzin. Wydzielanie peptydu YY podlega również mechanizmowi autoregulacji. Razem z PYY z komórek endokrynnych uwalniany jest GLP-1. U części osób, infuzja GLP-1 powoduje zahamowanie sekrecji obu peptydów (down-regulation), co sugeruje obecność ujemnego sprzężenia zwrotnego pomiędzy GLP-1 a komórkami L.
Zarówno PYY(1-36) jak i PYY(3-36) biorą udział w regulacji czynności przewodu pokarmowego nerek oraz układu naczyniowego. Występujący w krążeniu w formie (3-36) peptyd YY, zmniejsza łaknienie poprzez hamowanie motoryki jelit i opróżniania żołądka, hamuje stymulowane przez pentagastrynę wydzielanie soku żołądkowego. Hamuje ponadto głowową fazę sekrecji egzokrynnej trzustki. Bodźce przekazywane są aferentnymi włóknami nerwu błędnego oraz poprzez interakcję z receptorami humoralnymi podwzgórza. Alternatywną drogą regulacji wydzielania trzustkowego jest mechanizm hamowania czynności egzokrynnej na drodze inhibicji wydzielania cholecystokininy. Wpływ na sekrecję insuliny jest nie do końca poznany. Wiadomo, że infuzja PYY znosi zależne od glukozy wydzielanie tego hormonu. W organizmie PYY pełni także rolę czynnika wazokonstrykcyjnego. Infuzja peptydu powoduje znaczący wzrost zarówno skurczowego, jak i rozkurczowego ciśnienia krwi: odpowiednio o 8,6 mmHg i 10,9 mmHg. Poposiłkowy wzrost PYY powoduje 10% spadek wartości współczynnika filtracji kłębuszkowej, 30# spadek osoczowego poziomu reniny i 30% wzrost wydzielania sodu. Z uwagi na to, iż PYY jest inhibitorem kompleksu faktora transkrypcyjnego NF-kB (Nuclear Factor - k), będącego centralnym mediatorem stanu zapalnego, wpływa hamująco na proces zapalny, podobnie jak i na aktywację komórek układu immunologicznego. Liczne badania prowadzone nad ostrym stanem zapalnym trzustki wskazują na korzystne działanie PYY w przebiegu zapalenia trzustki. Główną rolę w zapaleniu trzustki odgrywa aktywacja przez TNF - alfa, NF-kB, białek SMAD i receptorów jądrowych PPAR (Receptorów aktywowanych przez proliferatory peroksysomów) . Uważa się, że peptyd YY, osłabiając ekspresję tych białek, hamuje proces zapalny.
Obie formy peptydu (1-36) i (3-36) posiadają zdolność przechodzenia przez barierę krew-mózg. Obok działania obwodowego wykazują również działanie ośrodkowe, odgrywając bardzo ważną rolę w kontroli przyjmowania pokarmu (oś jelitowo - mózgowa). Miejscem docelowym działania dla tych peptydów jest jądro łukowate (ARC) w obrębie podwzgórza. Stanowi ono skupisko różnych populacji neuronów, z których dwa typy odgrywają istotną rolę w mechanizmach działania PYY. Pierwszy z nich to neurony zawierające NPY i AgRP (Agouti-Related Protein). Drugi rodzaj to neurony zawierające CART - peptyd podlegający transkrypcji pod wpływem kokainy lub amfetaminy (cocaine- and amphetamine - regulated transcript - CART) i proopiomelanokortynę (POMC), które produktem po proteolitycznej obróbce jest hormon melanotropowy - MSH. Peptyd NPY, podobnie jak AgRP, pobudza uczucie głodu. Pierwszy w wyniku zmniejszenia ekspresji genu dla POMC, drugi poprzez hamowanie wiązania alfa-MSH z receptorem MC4R. Peptyd YY(3-36) po przekroczeniu BBB łączy się jako selektywny agonista z presynaptycznymi receptorami Y2 neuronów ARC, w wyniku czego dochodzi do zahamowania ekspresji NPY i AgRP. Aktywacji ulega natomiast tor związany z POMC (alfa-MSH) i CART. Alfa-MSH (produkt POMC) w przeciwieństwie do AgRP jest agonistą receptorów dla melanokortyny MC3R, MC4R w obrębie jądra przykomorowego podwzgórza (paraventricular nucleus-PVN), prowadząc do uczucia sytości, zahamowując tym samym potrzebę przyjęcia pokarmu. W przeciwieństwie do PYY(3-36), forma (1-36) powoduje wzrost ekspresji NPY/AgRP w podwzgórzu oraz stymuluje układ współczulny, czego efektem jest wzrost ilości przyjmowanego pokarmu.
Proopiomelanokortyna (POMC) - jest to polipeptyd prekursorowy, który ulega obróbce posttranslacyjnej specyficznie dla określonej tkanki, w rezultacie dając aktywne biologicznie hormony peptydowe. Produkty POMC odgrywają rolę w zjawiskach takich jak otyłość, depresja, pigmentacja skóry, rozwój nadnerczy i w regulacji osi podwzgórze-przysadka-nadnercza.
Zidentyfikowano go u większości grup kręgowców. mRNA genu POMC znaleziono w przednim jak i środkowym płacie przysadki, w różnych częściach mózgu takich jak podwzgórze (głównie ciało łukowate (ATC- arcuate nucleus)), ciało migdałowate, kora oraz w jądrach i najądrzach, jajnikach, łożysku, a także wielu komórkach nowotworowych.
Neurony POMC są zaangażowane w redukcję masy ciała i pobierania pokarmu, głównie poprzez wydzielanie produktu - alfa- melanokortyny, który wiąże się z receptorem melanokortyny 3 (MC3-R) i receptorem melanokortyny 4 (MC4-R). Oba te receptory znajdują się m.in. w podwzgórzu. Myszy z nokautem receptora MC4 są otyłe. Mutacje tego receptora z reguły wywołują otyłość także u ludzi. Neurony POMC w jądrze łukowatym równolegle wydzielają peptyd CART (cocaine and amphetamine related transcript), będący dość silnym inhibitorem pobierania pokarmu. Podwzgórzowe neurony POMC i AGRP odpowiadają na sygnały o utracie i wzroście statusu energetycznego organizmu. Pozbawienie lub ograniczenie pokarmu, które daje w efekcie negatywny wpływ na równowagę energetyczną, stymuluje apetyt w celu odzyskania strat poprzez zmniejszenie poziomu ekspresji POMC i zwiększenie mRNA AGRP w jądrze łukowatym. Odpowiedź na przejadanie się u zdrowych organizmów polega na zwiększeniu ekspresji POMC w podwzgórzu.
Skład:
U ssaków do peptydów POMC należy:
- adrenokortykotropina (ACTH),
- melanotropiny (α, β, γ),
- CLIP (corticotropin-like intermediate lobe peptide),
- lipotropina (β i γ-LPH),
- beta-endorfina (βEND),
- sekwencje N-końcowe o działaniu mitogennym.
Organizacja genu POMC:
Gen POMC zlokalizowano w chromosomie 2 człowieka, na ramieniu krótkim tego chromosomu, w regionie 2, jako prążek 3 i subprążek 3 (2p23.3). Organizację genu i regionu regulatorowego 5' zidentyfikowano w 1982 roku, a pełną sekwencję w 1983 roku (w tym samym roku po raz pierwszy sklonowano ten gen). Gen zawiera 3 egzony rozdzielone dwoma dużymi intronami i liczy 7665 pz.
Indukcja ekspresji POMC:
WSTĘP:Kortykoliberyna to hormon uwalniający kortykotropinę, z ang. corticotropin-releasing hormone, CRH) to wielopeptydowy neuroprzekaźnik i hormon, który jest związany z odpowiedzią organizmu na stres. Kortykoliberyna pobudza przysadkę do wydzielania hormonu adrenokortykotropowego. Znajduje się w podwzgórzu, a także w korze czołowej, zakręcie obręczy, jądrze centralnym ciała migdałowatego, miejscu sinawym i jądrach szwu. Jest ona odpowiedzialna za uaktywnianie zachowań lękowych, redukowanie zachowań wzmacniacnych nagrodą, a także hamowanie apetytu i aktywności seksualnej. W mózgu występują dwa typy receptorów wrażliwych na działanie kortykoliberyny, których charakter jest prawdopodobnie przeciwstawny: CRH1 i CRH2.
INDUKCJA: Kortykoliberyna (CRH, corticotropin releasing hormone) stanowi pierwszy aktywator transkrypcji pOMC. Jest ona produkowana głównie przez jądro przykomorowe PVN (paraventricularic nucleus) podwzgórza i wydzielana z zakończeń neuronów tego jądra do przedniego płata przysadki, gdzie stymuluje neurony kortykotropowe. CRH w stężeniach powyżej 1 nM skutecznie zwiększa aktywność promotora 5'POMC. Znaczne zwiększenie poziomu mRNA genu zaobserwowano około 1 godziny po podaniu CRH, zaś efekt maksymalny po 3-5 godzinach. W płacie przednim przysadki ekspresja genu POMC jest stymulowana także przez wazopresynę, zaś hamowana głównie przez glikokortykoidy.
POWSTAWANIE PRODUKTÓW POMC: Ponieważ peptydy, które produkowane są w komórkach kortykotropowych są wycinane z tego samego prekursora, wydzielane są w ekwimolarnych ilościach podczas egzocytozy. Poziom ich we krwi nie jest jednakże jednakowy. Powodem tego są różne okresy półtrwania owych peptydów.
N-terminal, ACTH, βLPH i częściowo γ-MSH (częściowo, ponieważ pierwotnie jest ona fragmentem peptydu N-końcowego POMC) są pierwszymi funkcjonalnymi hormonami proopiomelanokortyny powstałymi po bezpośrednim jej cięciu. Dalej ulegają następującym przemianom:
PREKURSOR: PRODUKT:
1) N-terminal ------> g-MSH
2) ACTH ------> αMSH (13 aminokwasowy odcinek ACTH licząc od końcaminowego)
CLIP (corticotropin-like intermediate lobe peptide)/ACTH 18-39
3)Beta-lipotropina ------>β-endorfina (31-aminokwasowy C-końcowy odcinek tego podprekursora i βMSH)
4) βEND ---cięcie--> krótkie fragmenty o mniejszej aktywności opioidowej ----przekształcenie----> formy α-N-acetylowane pozbawione właściwości opioidowych
Fragmenty β-endorfiny: γ-endorfinę (βEND 1-17) oraz α-endorfinę (βEND 1-16) zidentyfikowano początkowo jako peptydy opioidowe, w ekstrakcie pochodzenia przysadkowo-podwzgórzowego.
Enzymy endoproteolityczne:
Prekursor POMC w różnych miejscach przysadki jest wykorzystywany inaczej. Głównymi produktami przedniej części przysadki są ACTH a także β-LPH, natomiast w części środkowej przysadki produkowane są w większości melanotropiny oraz β-endorfina. POMC, nim stanie się aktywnym białkiem, musi przejść szereg cięć proteolitycznych i modyfikacji. W procesach tych uczestniczą endoproteazy:
- PC1 (znana również jako PC3),
- PC2 (subtilizynopodobne proteazy należące do rodziny proteaz serynowych – konwertaz prohormonów PC (prohormone convertase)),
- proteaza cysteinowa PTP (prohormone thiol protease) (w niewielkim stopniu),
- proteaza asparaginianowa (znana także jako enzym konwertujący proopiomelanokortynę – PCE (oroopiomelanocortin converting enzyme) odkryty w pęcherzykach wydzielniczych),
- konwertaza PACE4 (paired basic amino-acid-cleaving enzyme-4).
POMC po dotarciu do szorstkiego ER przechodzi szlakiem wydzielniczym przez aparat Golgiego i ostatecznie dociera do pęcherzyków wydzielncizych, gdzie gromadzą się produkty końcowe obróbki posttranslacyjnej przed ich wydzieleniem na drodze egzocytozy. Zarówno podczas tej drogi, jak i w pęcherzykach, POMC podlega endoprotelolitycznym cięciom i modyfikacjom chemicznym.
Aktywność enzymów proteolitycznych w różnych tkankach: POMC zawiera osiem par i jeden zestaw czterech zasadowych aminokwasów, które są potencjalnymi miejscami cięcia enzymów.
- W komórkach kortykotropowych przedneigo płata przysadki obecny jest tylko enzym PC1, tylko cztery z tych miejsc są używane, a pośród nich wszystkie typu Lys-Arg. W tym przypadku powstaje 6 peptydów: NT, JP (Joining peptide), ACTH (główny produkt), βLPH i niewielka ilość g-LPH i βEND, podczas gdy ostatnie miejsce cięcia jest tylko częściowo używane.
- W komórkach melanotropowych płata pośredniego przysadki gryzoni oraz w łożysku ludzkim używane są wszystkie miejsca cięć, obecne są także obie konwertazy PC1 i PC2, powstają zatem także mniejsze peptydy:, np. z peptydu N-końcowego powstaje gamma melanotropina, z ACTH - alfa-melanotropina i CLIP (lub ACTH 18-39), z beta-lipotropiny - beta-melanotropina, z beta-endorfiny 1-31-beta endorfina 1-27. W warunkach in vitro z kolei konwertaza PACE4, które występuje w podwzgórzu, tnie POMC. Wówczas prekursor o masie 32 kDa cięty jest przez PC1 do proACTH (22kDa) i βLPH. ProACTH następnie cięte jest również przez PC1 na N-POC, peptyd łączący (joining peptide-JP) i ACTH (4-5kDa).
Aktywność samej PC1 oraz w połączeniu z ubikwistyczną konwertazą prohormonów - furyną, odpowiada za powstawanie ACTH, βEND i βMSH w skórze.
Wśród enzymów, które biorą udział w posttranslacyjnej obróbce znajdują się również: karboksypeptydaza E (CPE), peptydylowa monooksygenaza alfa-amidująca (PAM) i N-acetylotransferaza.
Katalizują one utworzenie dojrzałeś alfaMSH z ACTH 1-17. W tym przekształceniu aminokwasy zasadowe na końću węglowym ulegają odcięciu z ACTH 1-17 przy pomocy CPE. Następnie peptyd jest amidowany przez PAM dając deacetylowaną alfaMSH (DA_alfa MSH), która później przekształćana jest do alfaMSH przez N-acetylotransferazę.
CPE prawdopodobnie odgrywa rolę w kierowaniu prohormonów do pęcherzyków wydzielniczych. PAM natomiast jest dwufunkcyjną cząsteczką transbonową wchodzącą w interakcję z elementami cytoszkieletu aktynowego, a ponadto wpływa na proces kierowania pęcherzyków wydzielniczych na powierzchnię komórki.
Odbiór sygnału produktów POMC:
MSH, ACTH - istnieje pięć rodzajów receptorów melanokortyn: MC1, MC2, MC3, MC4, MC5. Są one powiązane z białkiem G(s) i cyklazą adenylanową. Transdukcja sygnału melanokortyn wiąże się między innymi z wpływem wapnia z zewnątrz komórki, aktywowanym trifosforanem inozytolu oraz aktywacją MAP-kinazy, kinazy Janus i szlaków PKC.
- Receptor melanokortyny 1 (MC1-R) jest klasycznym receptorem dla alfa-melanokortyny. Jego ekspresja zachodzi w skórnych melanocytach, gdzie determinuje kolor skóry i włosów. Również w innych typach komórek skóry, takich jak keratynocyty, fibroblasty, komórki endotelium, komórki prezentujące antygeny, zachodzi ekspresja tego receptora.
- Receptor ten występuje też w leukocytach, gdzie pośredniczy w działaniu przeciwzapalnym melanokortyn.
- Receptor melanokortyny 2 (MC2-R) jest receptorem głównie dla ACTH. Ulega ekspresji w warstwie siateczkowatej i pasmowatej kory nadnerczy, gdzie jego aktywacja przez ACTH powoduje wydzielanie sterydów. Receptor ten nie ma żadnego powinowactwa do innych melanokortyn tj. alfa, beta lub gamma-MSH. MC2-R występuje również w tkance tłuszczowej, gdzie u szczura pod wpływem ACTH wywołuje efekt lipolityczny, u człowieka jednak takiego efektu nie wykazano.
- Receptor melanokortyny 3 (MC3-R) ulega ekspresji w wielu obszarach CUN oraz kilku tkankach obwodowych, na przykład osi żołądkowo-jelitowej oraz w łożysku. Wszystkie melanokortyny działają na ten receptor jednakowo, jednak największe powinowactwo ma gamma-melanokortyna. MC3-R bierze udział w kontroli homeostazy energetycznej.
- Receptor melanokortyny 4 (MC4-R) jest jednym z najbardziej rozpowszechnionych w CUN receptorów melanokortynowych. Razem z MC3-R kontrolują homeostazę energetyczną. Poza tym MC4-R związany jest z funkcjami płciowymi.
- Receptor melanokortyny 5 (MC5R) ulega ekspresji w wielu tkankach peryferycznych, m.in. w nadnerczach, adipocytach i leukocytach.
Somatostatyna (SRIF) - Somatostatyna to hormon peptydowy będący antagonistą somatoliberyny. Somatostatyna blokuje wydzielanie hormonu przez przysadkę mózgową i hamuje wydzielanie insuliny. Somatostatyna nie jest wydzielana przez określony jeden gruczoł, lecz jej centra wytwarzania są rozrzucone po całym organizmie. Występuje ona w komórkach D błony śluzowej przewodu pokarmowego i komórkach delta trzustki. Stwierdzono także, iż oprócz podwzgórza somtostatyna jest wydzielana przez ośrodkowy układ nerwowy, tarczycę i łożysko. Jest ona stale wydzielana w niewielkich ilościach przez błonę śluzową żołądka, jelito cienkie i trzustkę. Hamuje wydzielanie soku żołądkowego, trzustkowego i żółci oraz ruchy robaczkowe (perystaltyczne). Zmniejsza także poziom innych hormonów tkankowych i działa przeciwstawnie w stosunku do sekretyny. W trzustce jest ona produkowana przez komórki typu D wysepek trzustkowych Langerhansa. Somatostatyna jest hormonem wydzielanym głównie przez podwzgórze w mózgu, także komórki D trzustki. Hamuje uwalnianie z przysadki mózgowej somatotropiny, zaś w przewodzie pokarmowym - glukagonu, insuliny i gastryny.
Somatostatyna to cykliczny oligopeptyd (neuropeptyd) ssaków występujący w dwóch odmianach molekularnych zbudowanych z 14 (somatostatyna 14, SS14) lub 28 aminokwasów (somatostatyna 28, SS28). SS14 ma masę molową równą ok. 1500 Daltonów i jest usztywniony jednym mostkiem disiarczkowym (-S-S-).
Struktura SS28 przedstawia się następująco:
Ser-Ala-Asn-Ser-Asn-Pro-Ala-Met-Ala-Pro-Arg-Glu-Arg-Lys-Ala-Gly-Cys-Lys-Asn-Phe-Phe-Trp-Lys-Thr-Phe-Thr-Ser-Cys-OH.
Ser-Ala-Asn-Ser-Asn-Pro-Ala-Met-Ala-Pro-Arg-Glu-Arg-Lys-Ala-Gly-Cys-Lys-Asn-Phe-Phe-Trp-Lys-Thr-Phe-Thr-Ser-Cys-OH.
Substancja P - jest to neuropeptyd syntezowany i uwalniany z włókien mięśniowych peptydergicznych. Występuje on zarówno w ośrodkowym układzie nerwowym jak i częściach obwodowych układu nerwowego. Odpowiada za rozszerzenie naczyń krwionośnych (działanie bezpośrednie lub pośrednie poprzez histaminę uwolnioną z komórek tucznych - mastocytów), a także wzrost przepuszczalności śródbłonka naczyń (i wynaczynianie). Uczestniczy w angiogenezie (z gr. angeion = naczynie + genesis = pochodzenie) - procesie powstawania naczyń włosowatych. Ponadto substancja P stanowi mitogen (czynnik indukujący mitozę komórek) dla wielu spośród komórek układu odpornościowego. Aktywuje makrofagi do produkcji takich cytokin jak np. interleukina 1 oraz TNF-alfa. Neuropeptyd ten odkryty został w 1931 roku.
PEPTYDY BIOLOGICZNIE CZYNNE - PREZENTACJA: - kliknij i obejrzyj
PEPTYDY BIOLOGICZNIE CZYNNE - PREZENTACJA: - kliknij i obejrzyj






Brak komentarzy:
Prześlij komentarz