Chemicznymi wskaźnikami pH nazywamy takie związki chemiczne, których barwa zmienia się zależnie od pH środowiska, w którym owe związki przebywają. Mechanizm zmiany barwy bywa różny dla różnych wskaźników. Część z nich zmienia barwę na skutek przyłączania jonów hydroniowych (H30+) lub hydroksylowych (OH-) i przechodzenia w formę jonową przy ściśle określonym ich stężeniu, inne zmieniają kolor na skutek zmian konformacyjnych wywołanych przez zmianę pH, wreszcie istnieją takie, które zmieniają barwę na skutek całego ciągu reakcji chemicznych "uruchamianych" przy określonym pH.
Wiele substancji dostępnych w warunkach domowych również zmienia barwę w zależności od pH. Np. napar herbaty czarnej przy pH > 7,5 ma barwę ciemnobrązową, przy pH = 6 barwę jasnobrązową, zaś pryz pH < 5,5 barwę jasnożółtą. Inne tego typu substancje naturalne to np. sok z czarnej porzeczki, czarnej jagody lub czerwonej kapusty.
Pojedyncze związki chemiczne zmieniające barwę przy zmianie pH są stosowane głównie do miareczkowania, natomiast wiele papierków wskaźnikowych jest nasączana całym zestawem związków chemicznych, dzięki czemu zmieniają one barwę w szerokim zakresie pH, umożliwiając jej wzrokowe oszacowanie.
LISTA WSKAŹNIKÓW pH:
 1) Zieleń S, zieleń brylantowa BS - jest to organiczny związek chemiczny, trifenylometanowy barwnik smołowy (barwniki tego typu otrzymywano dawniej ze smoły węglowej, czyli smoły otrzymywanej w wyniku odgazowania węgla kamiennego w temperaturze około 1000 stopni Celsjusza - stanowi ona jeden z produktów ubocznych - około 3-5% masy surowego węgla z produkcji koksu z węgla kamiennego). Zieleń S jako barwnik jest zakazana w niektórych krajach. Dopuszczalne dzienne spożycie wynosi 5 mg/kg masy ciała. Stosowany jest w przemyśle spożywczym jako dodatek m.in. do groszku konserwowego, sosu miętowego, serników w proszku, galaretek oraz w przemyśle tekstylnym.
1) Zieleń S, zieleń brylantowa BS - jest to organiczny związek chemiczny, trifenylometanowy barwnik smołowy (barwniki tego typu otrzymywano dawniej ze smoły węglowej, czyli smoły otrzymywanej w wyniku odgazowania węgla kamiennego w temperaturze około 1000 stopni Celsjusza - stanowi ona jeden z produktów ubocznych - około 3-5% masy surowego węgla z produkcji koksu z węgla kamiennego). Zieleń S jako barwnik jest zakazana w niektórych krajach. Dopuszczalne dzienne spożycie wynosi 5 mg/kg masy ciała. Stosowany jest w przemyśle spożywczym jako dodatek m.in. do groszku konserwowego, sosu miętowego, serników w proszku, galaretek oraz w przemyśle tekstylnym.
2) Fiolet metylowy - jest to mieszanina 3 organicznych związków chemicznych: tetra-, penta- i heksametylowych pochodnych chlorowodorku pararozaniliny. Głównym składnikiem jest związek pentametylowy, natomiast pochodna w pełni metylowana (chlorowodorek heksametylopararozaniliny) znana jest jako fiolet krystaliczny (lub fiolet zasadowy 3, fiolet gencjanowy i inne). Jako "fiolet gencjanowy" określa się także mieszaninę fioletu metylowego z fioletem krystalicznym, służącą do sporządzania gencjany.
*Gencjana - fiolet goryczki (łac. Violetum Gentianae) to 0,5-2% wodny lub spirytusowy roztwór fioletu gencjanowego, czyli farmakopealnego surowca farmaceutycznego (FP III) mieszaniny fioletu krystalicznego i fioletu metylowego. Roztwór wodny 0,5% przeznaczony jest do dezynfekcji skóry w powierzchownych uszkodzeniach naskórka, błon śluzowych i skóry. Stosowany jest również w ropnych zakażeniach skóry oraz błon śluzowych, niektórych grzybicach i drożdżycach. Roztwór spirytusowy 1% ma podobne zastosowanie, przy czym nie stosuje się go na błony śluzowe. Działa na bakterie Gram-dodatnie i niektóre grzyby (w tym na Candida albicans). In vitro hamuje wzrost Pseudomonas który jest bakterię Gram-ujemną. Wykazuje działanie in vivo na gronkowce złociste oporne na metycylinę (MRSA).
Otrzymywany jest przez przedmuchiwanie powietrza przez roztwór dimetyloaniliny w obecności fenolu, chlorku sodu i soli miedzi (II), co prowadzi do częściowej dealkilacji dimetyloaniliny z wydzieleniem formaldehydu, który ulega kondensacji z aminoanilinami obecnymi w mieszaninie. W stanie stałym jest zielonym krystalicznym proszkiem, natomiast roztwory mają kolor żółty (pH < 0,15) lub fioletowy (pH > 3,2). Stosowany jest m.in. jako wskaźnik pH (zakres zmiany barwy pH 0,1-2,0) i wskaźnik do wykrywania utleniaczy (ze względu na odbarwianie się w środowisku utleniającym), jako substancja barwiąca denaturat i składnik rysików ołówków kopiowych.
3) Czerwień krezolowa - jest to organiczny związek chemiczny, barwnik stosowany jako chemiczny wskaźnik pH. Zakresy pH zmiany barwy 0,0 (czerwony) - 1,0 (żółty). 7,0 (żółty) - 8,8 (czerwony).
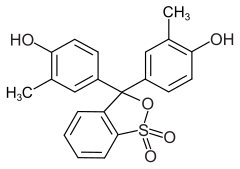
4) Zieleń malachitowa - jest to organiczny związek chemiczny, syntetyczny barwnik zasadowy, pochodna trytylu. Jest on stosowany do barwienia bawełny, wełny, jedwabiu, papieru, a także preparatów bakteryjnych. W akwarystyce wykorzystywana jest do leczenia chorób ryb, zwłaszcza ichtioftiriozy, czyli tzw. ospy rybiej. Jest wskaźnikiem pH, przy pH 0,2-1,8 zmienia barwę z żółtej na zielononiebieską. Ponadto roztwór zieleni malachitowej i molibdenianu amonu jest odczynnikiem do wykrywania fosforanów. W akwarystyce stosowana jest od 1933 roku do zwalczania grzybów (Saprolegnia sp.) i pierwotniaków (głównie Ichthyopthririus multifillis) atakujących ryby i ikrę. Stosuje się ją w kąpielach w postaci czystej lub mieszanki z innymi związkami, np. z formaldehydem, zielenią brylantową, fioletem krystalicznym, błękitem metylenowym. Tzw. preparat FMC jest mieszanką zieleni malachitowej z formaliną (nasycone roztwór formaldehydu) i błękitem metylenowym (3,5 g zieleni, 3,5 g błękitu na 1000 ml formaliny). Procedura kąpieli trwa zazwyczaj 3 dni, lecz każdego dnia procedura musi być zaczynana od nowa. Stosuje się ją w celach kontroli pasożytów z rodzaju Cryptobia, Ichthyobodo, Chilodonella, Trichodina, Trichodinella oraz grzybicy skóry.
LINKI Z INFORMACJAMI NA TEMAT POWYŻSZYCH RODZAJÓW PIERWOTNIAKÓW I CHORÓB RYB WYWOŁYWANYCH PRZEZ NIE:
Cryptobia iubilans
Ichthybodo (Costia)
Chilodonella
Trichodina
Choroby akwariowych ryb - Aquarium tropical fish and fish diseases - COSTIALINKI Z INFORMACJAMI NA TEMAT POWYŻSZYCH RODZAJÓW PIERWOTNIAKÓW I CHORÓB RYB WYWOŁYWANYCH PRZEZ NIE:
Cryptobia iubilans
Ichthybodo (Costia)
Chilodonella
Trichodina
Zieleń malachitowa i jej metabolit, zieleń leukomalachitowa, mogą się utrzymywać w organizmie ryb jadalnych przez dłuższy czas. W 2000 roku Unia Europejska zakazała stosowania zieleni malachitowej w hodowli ryb jadalnych ze względu na możliwość akumulowania się tego związku w organizmach ryb i potencjalnej toksyczności dla organizmu ludzkiego. W badaniach na zwierzętach oba te związki wykazały właściwości karcynogenne oraz teratogenne.
 5) Błękit tymolowy - jest to związek chemiczny z grupy pochodnych trifenylometanu, chemiczny wskaźnik pH, który przybiera barwę od czerwonej do żółtej w zakresie pH 1,2-2,8 i od żółtej do niebieskiej w zakresie pH 8,0-9,6. Dwa zakresy zmiany barwy tego wskaźnika związane są z dwoma etapami jego dysocjacji. W praktyce laboratoryjnej jako indykator kwasowo-zasadowy stosowany jest w postaci roztworu o skłądzie: 0,1 g błękitu tymolowego + 21,5 cm3 0,01 mol dm3 NaOH + 228,5 cm3 wody.
5) Błękit tymolowy - jest to związek chemiczny z grupy pochodnych trifenylometanu, chemiczny wskaźnik pH, który przybiera barwę od czerwonej do żółtej w zakresie pH 1,2-2,8 i od żółtej do niebieskiej w zakresie pH 8,0-9,6. Dwa zakresy zmiany barwy tego wskaźnika związane są z dwoma etapami jego dysocjacji. W praktyce laboratoryjnej jako indykator kwasowo-zasadowy stosowany jest w postaci roztworu o skłądzie: 0,1 g błękitu tymolowego + 21,5 cm3 0,01 mol dm3 NaOH + 228,5 cm3 wody.Poniżej przedstawione zostały struktury trzech form błękitu tymolowego: forma niezdysocjowana i dwie formy anionowe. Dysocjacja błękitu tymolowego jest dwuetapowa.


| Błękit tymolowy | ||||
| poniżej pH 1,2 | ⇌ | pH 2,8–8,0 | ⇌ | powyżej pH 9,6 |
 6) 2,4 - Dinitrofenol (DNP) - jest to organiczny związek chemiczny z grupy fenoli zawierający dwa podstawniki nitrowe w pierścieniu. Ma on dość silne właściwości kwasowe, o mocy nieco większej niż kwas octowy. Jest jasnożółtą krystaliczną substancją, słabo rozpuszczalną w wodzie. Dobrze rozpuszczalne są sole sodowe i amonowe. W stanie suchym sole mogą eksplodować przy uderzeniu. Może być on stosowany jako herbicyd, totalny defoliant (ang. defoliant z łac. de-"od-" i follum - "liść"-karta - są to substancje chemiczne, które powodują zrzucanie liści przez rośliny, np. Agent Orange używany podczas wojny w Wietnamie). Do defoliacji roślin wymagane są dawki 7,5-10 kg/ha. Jest silnie trujący dla ludzi oraz zwierząt. Dawki rzędu 3,5 mg/kg powodują silne zatrucia z objawami obrzęku płuc i gorączką. Należy do fitotoksycznych bojowych środków trujących i był stosowany przez Amerykanów podczas wojny w Wietnamie do niszczenia pastwisk, lasów i kultur roślinnych. Oznaczenia wojskowe w USA - DNP. Podobne działanie mają też inne nitrowe pochodne fenolu (np. DNC).
6) 2,4 - Dinitrofenol (DNP) - jest to organiczny związek chemiczny z grupy fenoli zawierający dwa podstawniki nitrowe w pierścieniu. Ma on dość silne właściwości kwasowe, o mocy nieco większej niż kwas octowy. Jest jasnożółtą krystaliczną substancją, słabo rozpuszczalną w wodzie. Dobrze rozpuszczalne są sole sodowe i amonowe. W stanie suchym sole mogą eksplodować przy uderzeniu. Może być on stosowany jako herbicyd, totalny defoliant (ang. defoliant z łac. de-"od-" i follum - "liść"-karta - są to substancje chemiczne, które powodują zrzucanie liści przez rośliny, np. Agent Orange używany podczas wojny w Wietnamie). Do defoliacji roślin wymagane są dawki 7,5-10 kg/ha. Jest silnie trujący dla ludzi oraz zwierząt. Dawki rzędu 3,5 mg/kg powodują silne zatrucia z objawami obrzęku płuc i gorączką. Należy do fitotoksycznych bojowych środków trujących i był stosowany przez Amerykanów podczas wojny w Wietnamie do niszczenia pastwisk, lasów i kultur roślinnych. Oznaczenia wojskowe w USA - DNP. Podobne działanie mają też inne nitrowe pochodne fenolu (np. DNC). | 2,4-Dinitrofenol | ||
|---|---|---|
| pH < 2,4 | ⇄ | pH > 4,0 |
 7) Żółcień metylowa - jest to organiczny związek chemiczny z grupy barwników azowych, pochodna azobenzenu i dimetyloaniliny służący jako wskaźnik pH. Zakres pH zmiany barwy wynosi 2,9-4,0; zmienia się ona od czerwonej (pH < 2,9) do żółtej (pH > 4,0). Żółcień metylowa jest rozpuszczalna m.in. w etanolu, benzenie, chloroformie, eterze dietylowym i naftowym, kwasach mineralnych, olejach, dobrze w pirydynie. Była używana jako barwnik spożywczy, np. do margaryny, została jednak wycofana w latach 30. XX wieku. Według danych Rapid Alert System for Food and Feed w latach 2005-2010 odnotowano cztery przypadki nielegalnego barwienia żywności (mieszanki przypraw z curry) żółcienią metylenową (raz w 2006, 3 razy w 2009). Poza żywnością stosowano ją np. do barwienia mydeł i tworzyw sztucznych oraz w woskach i innych barwnych preparatach dekoracyjnych do mebli. Według opracowania 8th Report on Carcinogens (National Institute of Environmental Health Sciences, 1998) w USA nie jest produkowana ani wykorzystywana komercyjnie. Żółcień metylowa jest silnie trująca po spożyciu. U pracowników narażonych na kontakt z substancją obserwowano stany zapalne skóry. Brak jest informacji o szkodliwości przy narażeniu chronicznym oraz o rakotwórczości dla ludzi, jednak u zwierząt stwierdzono indukcję chorób nowotworowych po podawaniu doustnym. Podejrzewa się, że jest rakotwórcza również dla ludzi.
7) Żółcień metylowa - jest to organiczny związek chemiczny z grupy barwników azowych, pochodna azobenzenu i dimetyloaniliny służący jako wskaźnik pH. Zakres pH zmiany barwy wynosi 2,9-4,0; zmienia się ona od czerwonej (pH < 2,9) do żółtej (pH > 4,0). Żółcień metylowa jest rozpuszczalna m.in. w etanolu, benzenie, chloroformie, eterze dietylowym i naftowym, kwasach mineralnych, olejach, dobrze w pirydynie. Była używana jako barwnik spożywczy, np. do margaryny, została jednak wycofana w latach 30. XX wieku. Według danych Rapid Alert System for Food and Feed w latach 2005-2010 odnotowano cztery przypadki nielegalnego barwienia żywności (mieszanki przypraw z curry) żółcienią metylenową (raz w 2006, 3 razy w 2009). Poza żywnością stosowano ją np. do barwienia mydeł i tworzyw sztucznych oraz w woskach i innych barwnych preparatach dekoracyjnych do mebli. Według opracowania 8th Report on Carcinogens (National Institute of Environmental Health Sciences, 1998) w USA nie jest produkowana ani wykorzystywana komercyjnie. Żółcień metylowa jest silnie trująca po spożyciu. U pracowników narażonych na kontakt z substancją obserwowano stany zapalne skóry. Brak jest informacji o szkodliwości przy narażeniu chronicznym oraz o rakotwórczości dla ludzi, jednak u zwierząt stwierdzono indukcję chorób nowotworowych po podawaniu doustnym. Podejrzewa się, że jest rakotwórcza również dla ludzi. | Żółcień metylowa | ||
|---|---|---|
| pH < 2,9 | ⇄ | pH > 4,0 |
 8) Oranż metylowy (metylooranż, heliantyna) - jest to organiczny związek chemiczny z grupy barwników azowych. Jest pochodną azobenzenu zawierającą grupę dimetyloaminową oraz grupę sulfonową. Jest stosowany jako indykator pH. W temperaturze pokojowej jest to krystaliczne ciało stałe o pomarańczowej barwie. Jako wskaźnik pH stosuje się go w formie wodnego roztworu. Jest stosowany w miareczkowaniu alkacymetrycznym i jako składnik mieszanin do nasączania papierków wskaźnikowych. Oranż metylowy zmienia swoje zabarwienie w zależności od pH środowiska w jakim się znajduje. W środowisku silnie kwasowym o pH poniżej 3,2 przyjmuje barwę czerwoną, zaś w roztworach o pH powyżej 4,4 przyjmuje zabarwienie żółte.
8) Oranż metylowy (metylooranż, heliantyna) - jest to organiczny związek chemiczny z grupy barwników azowych. Jest pochodną azobenzenu zawierającą grupę dimetyloaminową oraz grupę sulfonową. Jest stosowany jako indykator pH. W temperaturze pokojowej jest to krystaliczne ciało stałe o pomarańczowej barwie. Jako wskaźnik pH stosuje się go w formie wodnego roztworu. Jest stosowany w miareczkowaniu alkacymetrycznym i jako składnik mieszanin do nasączania papierków wskaźnikowych. Oranż metylowy zmienia swoje zabarwienie w zależności od pH środowiska w jakim się znajduje. W środowisku silnie kwasowym o pH poniżej 3,2 przyjmuje barwę czerwoną, zaś w roztworach o pH powyżej 4,4 przyjmuje zabarwienie żółte. | Oranż metylowy | ||
|---|---|---|
| pH < 3,2 | ⇄ | pH > 4,4 |
 |
| Źródło: Wikipedia. Próbka oranżu metylowego. |
*Barwniki azowe to organiczne związki chemiczne z grupy azozwiązków (związków posiadających grupę azową -N=N- ). Na skalę produkcyjną są uzyskiwane ze związków diazowych i fenolu. Znajdują zastosowanie w przemyśle jako barwniki. Są one stosowane w farbiarstwie włokienniczym i w produkcji lakierów oraz farb. Niektóre są wskaźnikami w analizie chemicznej.
 9) Zieleń bromokrezolowa - jest to organiczny związek chemiczny, barwnik stosowany jako wskaźnik pH, głównie w analityce organicznej. Otrzymywana w wyniku bromowania purpury m-krezolowej (m-krezolosulfotraleiny) w środowisku alkoholu. Zieleń bromokrezolowa jest ciałem stałym koloru od białego do kremowego.
9) Zieleń bromokrezolowa - jest to organiczny związek chemiczny, barwnik stosowany jako wskaźnik pH, głównie w analityce organicznej. Otrzymywana w wyniku bromowania purpury m-krezolowej (m-krezolosulfotraleiny) w środowisku alkoholu. Zieleń bromokrezolowa jest ciałem stałym koloru od białego do kremowego. | Zieleń bromokrezolowa | ||
|---|---|---|
| pH < 3,8 | ⇄ | pH > 5,4 |
10) Czerwień metylowa - jest to organiczny związek chemiczny, barwnik azowy stosowany najczęściej jako chemiczny wskaźnik pH. W temperaturze pokojowej jest to ciemnoczerwone, krystaliczne ciało stałe. Zmienia barwę od ciemnoczerwonej do jasnożółtej w zakresie pH od 4,2 do 6,3. Czerwień metylowa, podobnie jak oranż metylowy jest stosowana w alkacymetrii. Oprócz tego stosuje się ją w mikrobiologii do detekcji zmiany pH zachodzącej w czasie fermentacji glukozy.
| Czerwień metylowa | ||
|---|---|---|
| pH < 4,2 | ⇄ | pH > 6,3 |
11) Lakmus - jest to wskaźnik pH, który jest produktem naturalnym występującym w wielu gatunkach porostów, m.in. Rocella fuciformis, występujących u wybrzeży Morza Śródziemnego i Oceanu Atlantyckiego. Mieszanina rozpuszczalnych w wodzie barwników (w tym azolitminy), w roztworach o odczynie kwasowym przyjmuje barwę czerwoną, zaś w roztworach o odczynie obojętnym i zasadowym - niebieską. Zakres zmiany barwy pH 5-8. Składniki odpowiedzialne za zmiany barwy lakmusu zawierają chromofor 7-hydroksyfenoksazonowy. Najczęściej stosowany w formie nasyconych nim pasków bibuły, zwanych papierkami lakmusowymi, które zwilża się badanym roztworem. Wilgotne papierki lakmusowe pozwalają także stwierdzać obecność kwasów w gazach. Pod wpływem utleniaczy (np. chloru), lakmus trwale się odbarwia.





















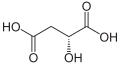
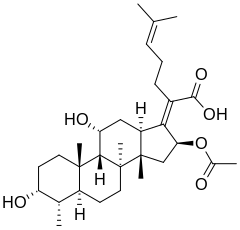

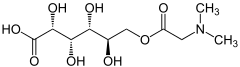

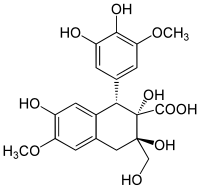



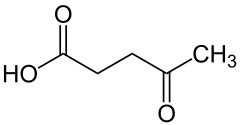
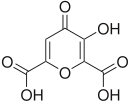








 - TYPOWY KWAS FULWOWY.
- TYPOWY KWAS FULWOWY.