Kwasy organiczne to związki chemiczne, które wykazują kwasowe właściwości, a jednocześnie należą do grupy związków organicznych (chemia węgla). Najpowszechniejszymi kwasami organicznymi są kwasy karboksylowe. Wśród nich wyróżniamy także kwasy sulfonowe. Kwasowość, chociaż zazwyczaj słabą, wykazują również związki posiadające grupę hydroksylową lub grupę tiolową, a także enole oraz fenole.
WŚRÓD KWASÓW ORGANICZNYCH WYRÓŻNIAMY:
WŚRÓD KWASÓW ORGANICZNYCH WYRÓŻNIAMY:
- Kwasy aromatyczne
- Kwasy fosfonowe
- Kwasy hydroksamowe
- Kwasy karboksylowe
- Kwasy nukleinowe
- Siarkoorganiczne kwasy sulfonowe
- Kwasy żółciowe
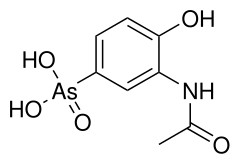
1) Acetarsol - jest to arsenoorganiczny związek chemiczny z grupy kwasów arsonowych, który jest stosowany jako lek o działaniu m.in. krętkobójczym, a także czerwiobójczym. Jest on obecnie stosowany w lecznictwie, zaś bardzo rzadko w ginekologii oraz w leczeniu rzęstistkowicy. Jego swoistą odtrutką jest BAL - dimerkaprol - chelatujący związek chemiczny stworzony przez brytyjskich biochemików na Uniwersytecie Oxfordzkim podczas II wojny światowej. Został on wynaleziony w sekrecie jako antidotum na bojowy środek trujący o nazwie luizyt. BAL jest obecnie stosowany jako antidotum w leczeniu zatruć arsenem, rtęcią i innymi ciężkimi metalami. Znalazł on dodatkowo zastosowanie przy leczeniu choroby Wilsona - genetycznego zaburzenia, które polega na spichrzaniu miedzi w tkankach. BAL wiąże grupy sulhydrylowe (-SH) z metalami ciężkimi w organizmie człowieka i tworzy trwałe, nietoksyczne, rozpuszczalne w wodzie związki, które są następnie wydalane wraz z moczem. Sam w sobie BAL jest jednak związkiem toksycznym - ma tendencję do koncentracji arszeniku w niektórych organach. Inną wadą owego związku jest potrzeba podawania go w postaci bolesnych zastrzyków domięśniowych.
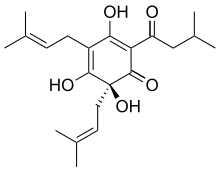 2) Alfa-kwasy - jest to grupa organicznych związków chemicznych o gorzkim smaku występujących w szyszkach chmielu. Głównym związkiem z tej grupy jest humulon, zaś pozostałe alfa-kwasy różnią się podstawnikami. Zaliczane są one do żywic chmielowych. Zawartość alfa-kwasów jest jedną z najważniejszych cech jakościowych chmielu. Zarówno masa, jak i skład wytworzonych w szyszkach chmielowych alfa-kwasów zależą od odmiany chmielu (aromatyczny, goryczkowy), warunków pogodowych, a także położenia geograficznego. W zależności od sezonu ten sam gatunek chemilu może zawierać odmienną ilość alfa-kwasów. Zawartość alfa-kwasów w chmielu ma największe znaczenie w piwowarstwie, gdyż stopień nachmielenia piwa określa się przez ilość alfa-kwasów, jakie powinny się w nim znaleźć. Alfa-kwasy nie są rozpuszczalne w zimnej wodzie. Dopiero w trakcie gotowania brzeczki piwnej następuje proces izomeryzacji (przekształcenia) w rozpuszczalne izo-alfa-kwasy (izohumulony), nadające piwu charakterystyczną goryczkę.
2) Alfa-kwasy - jest to grupa organicznych związków chemicznych o gorzkim smaku występujących w szyszkach chmielu. Głównym związkiem z tej grupy jest humulon, zaś pozostałe alfa-kwasy różnią się podstawnikami. Zaliczane są one do żywic chmielowych. Zawartość alfa-kwasów jest jedną z najważniejszych cech jakościowych chmielu. Zarówno masa, jak i skład wytworzonych w szyszkach chmielowych alfa-kwasów zależą od odmiany chmielu (aromatyczny, goryczkowy), warunków pogodowych, a także położenia geograficznego. W zależności od sezonu ten sam gatunek chemilu może zawierać odmienną ilość alfa-kwasów. Zawartość alfa-kwasów w chmielu ma największe znaczenie w piwowarstwie, gdyż stopień nachmielenia piwa określa się przez ilość alfa-kwasów, jakie powinny się w nim znaleźć. Alfa-kwasy nie są rozpuszczalne w zimnej wodzie. Dopiero w trakcie gotowania brzeczki piwnej następuje proces izomeryzacji (przekształcenia) w rozpuszczalne izo-alfa-kwasy (izohumulony), nadające piwu charakterystyczną goryczkę. 3) Kwas kakodylowy - jest to metaloorganiczny związek chemiczny, który stanowi organiczną pochodną kwasu arsynowego. Jest on fitotoksycznym (toksyczny względem roślin) bojowym środkiem trującym. Był on stosowany w postaci soli sodowej w Wietnamie jako Agent Blue. Kwas kakodylowy niszczy rośliny trawiaste i szerokolistne. Może być stosowany w medycynie do leczenia niedokrwistości i chorób skóry.
3) Kwas kakodylowy - jest to metaloorganiczny związek chemiczny, który stanowi organiczną pochodną kwasu arsynowego. Jest on fitotoksycznym (toksyczny względem roślin) bojowym środkiem trującym. Był on stosowany w postaci soli sodowej w Wietnamie jako Agent Blue. Kwas kakodylowy niszczy rośliny trawiaste i szerokolistne. Może być stosowany w medycynie do leczenia niedokrwistości i chorób skóry.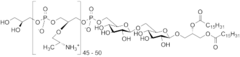
4) Kwas lipotejchojowy (LTA - lipoteichoic acid) - jest to naturalnie występujący związek organiczny, który jest amifilowy i połączony z glikolipidami błony komórkowej bakterii Gram-dodatnich (G+). Kwasy te stanowią polimery fosforanu rybitolu (np. u Staphylococcus auregus) lub fosforanu glicerolu (np. u Bacillus subtilis) i łączą się ze strukturą peptydoglikanu. Uwalniany jest on podczas bakteriolizy indukowanej lizozymem lub na skutek działalność antybiotyków beta-laktamowych. Warunkuje rozwój reakcji zapalnej, włącznie z powodowaniem sepsy. Kwasy lipotejchojowe różnią się między sobą długością łańcucha glicerofosforanowego oraz podstawnikami. Pierwszy raz kwasy tejchojowe zostały opisane na przełomie lat 50. oraz 60. XX wieku i jeszcze do niedawna były uważane za strukturalny element, którego biologiczna funkcja jest nieznana.
 |
| Źródło: images.nature.com - Kwasy lipotejchojowe. |
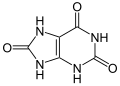 3) Kwas moczowy ( 2, 6, 8 - trioksypuryna) - jest to organiczny związek chemiczny i pochodna puryny. Tworzy białe kryształy, które są trudno rozpuszczalne w wodzie. W temperaturze 400 stopni Celsjusza rozkłada się, wydzielając cyjanowodór. Ulega ponadto tautomerii laktamowo-laktimowej, co zwiększa jego charakter kwasowy, wynikający zasadniczo z tego, że jest on imidem. U zwierząt jest on produktem metabolizmu azotowego. U zwierząt urikotelicznych z kolei (ptaki, większość gadów, niektóre owady i ślimaki lądowe) do 90% zbędnego azotu wydala się jako kwas moczowy. U ssaków kwas moczowy występuje w małych ilościach we krwi, wątrobie, śledzionie oraz w moczu. U człowieka, a także małp człekokształtnych jest końcowym produktem metabolizmu zasad purynowych, które pochodzą z pokarmu, z syntezy de novo oraz z rozpadu endogennych kwasów nukleinowych. Około 75% kwasu moczowego jest wydalane z moczem, 25% przechodzi do przewodu pokarmowego i jest rozkładane przez bakterie jelitowe. Stężenie kwasu moczowego we krwi osób zdrowych wynosi 180-420 mikromol/l (30-70 mg/l). Z moczem wydala się średnio 500 mg kwasu moczowego w ciągu doby w postaci obojętnej lub anionowej (zależnie od pH moczu). Ze względu na słabą rozpuszczalność w wodzie w środowisku obojętnym i kwaśnym może odkładać się w stawach, powodując dnę moczanową, a także w nerkach, tworząc kamienie moczanowe. W środowisku zasadowym tworzy on łatwo rozpuszczalne moczany.
3) Kwas moczowy ( 2, 6, 8 - trioksypuryna) - jest to organiczny związek chemiczny i pochodna puryny. Tworzy białe kryształy, które są trudno rozpuszczalne w wodzie. W temperaturze 400 stopni Celsjusza rozkłada się, wydzielając cyjanowodór. Ulega ponadto tautomerii laktamowo-laktimowej, co zwiększa jego charakter kwasowy, wynikający zasadniczo z tego, że jest on imidem. U zwierząt jest on produktem metabolizmu azotowego. U zwierząt urikotelicznych z kolei (ptaki, większość gadów, niektóre owady i ślimaki lądowe) do 90% zbędnego azotu wydala się jako kwas moczowy. U ssaków kwas moczowy występuje w małych ilościach we krwi, wątrobie, śledzionie oraz w moczu. U człowieka, a także małp człekokształtnych jest końcowym produktem metabolizmu zasad purynowych, które pochodzą z pokarmu, z syntezy de novo oraz z rozpadu endogennych kwasów nukleinowych. Około 75% kwasu moczowego jest wydalane z moczem, 25% przechodzi do przewodu pokarmowego i jest rozkładane przez bakterie jelitowe. Stężenie kwasu moczowego we krwi osób zdrowych wynosi 180-420 mikromol/l (30-70 mg/l). Z moczem wydala się średnio 500 mg kwasu moczowego w ciągu doby w postaci obojętnej lub anionowej (zależnie od pH moczu). Ze względu na słabą rozpuszczalność w wodzie w środowisku obojętnym i kwaśnym może odkładać się w stawach, powodując dnę moczanową, a także w nerkach, tworząc kamienie moczanowe. W środowisku zasadowym tworzy on łatwo rozpuszczalne moczany.  3) Kwas nadoctowy - jest to nadtlenowa pochodna kwasu octowego. Jest to kwas żrący, który posiada silne właściwości utleniające. Ma wygląd bezbarwnej cieczy o ostrym zapachu octu. Jest stosowany jako środek dezynfekcyjny, wybielacz i utleniacz w preparatyce chemicznej. Jest on także stosowany jako środek bielący do włókien naturalnych poprzez utlenianie. Ze względu na powodowanie nieodwracalnych zmian w komórkach drobnoustrojów jest stosowany w dezynfekcji. Jest aktywny w stosunku do form wegetatywnych, jak i przetrwalników. W roztworach wodnych rozkłada się do tlenu i kwasu octowego.
3) Kwas nadoctowy - jest to nadtlenowa pochodna kwasu octowego. Jest to kwas żrący, który posiada silne właściwości utleniające. Ma wygląd bezbarwnej cieczy o ostrym zapachu octu. Jest stosowany jako środek dezynfekcyjny, wybielacz i utleniacz w preparatyce chemicznej. Jest on także stosowany jako środek bielący do włókien naturalnych poprzez utlenianie. Ze względu na powodowanie nieodwracalnych zmian w komórkach drobnoustrojów jest stosowany w dezynfekcji. Jest aktywny w stosunku do form wegetatywnych, jak i przetrwalników. W roztworach wodnych rozkłada się do tlenu i kwasu octowego. 4) Kwasy fenoksyoctowe - są to najszerzej stosowane substancje czynne środków chwastobójczych. Są one pobierane przez nadziemne części roślin, zwłaszcza młode, lecz w pełni rozwinięte liście. Herbicydy fenoksyoctowe przenikają łatwo do wiązek sitowych, którymi wędrują wraz z asymilatami w stronę korzenia. Wskutek tego herbicydy te działają toksycznie nie tylko na części nadziemne, ale również na części podziemne, stąd też nadają się do niszczenia chwastów o silnie rozbudowanym systemie korzeniowym (np. ostów). Typowym przedstawicielem herbicydów jest kwas 2,4-dichlorofenoksyoctowy, w skrócie 2,4-D, który produkowany jest pod nazwą Pielik. 2,4-D daje reakcje wzrostowe podobne do naturalnej auksyny indolowej (IAA), lecz równocześnie różni się od niej zasadniczo, ponieważ jest na ogół bardziej aktywny i nie ulega tak łatwo rozkładowi. Roztwór 2,4-D wysyca tkanki sztuczną i odporną auksyną, co zmienia naturalne proporcje pomiędzy auksynami, giberelinami i cytokininami. Występują wtedy u roślin dość charakterystyczne zniekształcenia: liście i łodygi są silnie skręcone, a młode części przestają się wydłużać, grubieją i często wytwarzają związki korzeniowe, liście nie rozwijają się prawidłowo, zaś korzenie przestają pełnić swoje funkcje. 2,4-D zwiększa syntezę kwasów nukleinowych (zwłaszcza RNA), co wywołuje zmiany w syntezie oraz zwiększa syntezę białek strukturalnych. Wywołuje to "ekstra-wzrost" cytoplazmy komórek, który zabija rośliny, podobnie jak nowotwór zabija organizmy zwierzęce. Obserwowane skutki działanie 2,4-D na rośliny, takie jak zmiany w oddychaniu i fotosyntezie, w metabolizmie azotowym i fosforowym, są prawdopodobnie wtórnymi efektami, wywołanymi pierwotnymi zaburzeniami w syntezie kwasów nukleinowych.
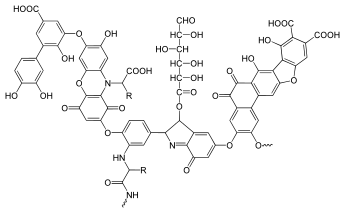 5) Kwasy humusowe (kwasy próchnicowe) - jest to mieszanina wielkocząsteczkowych związków organicznych o zmiennym składzie (w zależności od składu materii organicznej, z której powstają) i charakterze kwasowym, wchodzących w skład próchnicy glebowej i roztworów wód naturalnych. Tworzą się one w biochemicznych procesach rozkładu związków organicznych budujących żywe organizmy. Budowa tych wyjątkowo skomplikowanych związków nie jest jeszcze do końca poznana, dlatego najczęściej rozpatruje się je na zasadzie różnic pomiędzy różnymi rodzajami tych substancji. Wyróżnia się dwie podstawowe grupy tych związków: kwasy huminowe - grupę związków o różnych właściwościach, której podgrupy stanowią kwasy hymatomelanowe - trudno rozpuszczalne w wodzie, a łatwo w alkoholu, o barwie brunatnej, najczęściej w postaci koloidów; kwasy huminowe brunatne; kwasy huminowe szare. Inną grupą podstawową są kwasy fulworowe (tzw. fulwokwasy) - łatwo rozpuszczalne w wodzie związki, o barwie od żółtej do jasnobrązowej, mniejszej masie cząsteczkowej aniżeli kwasy huminowe i większym stopniu dysocjacji.
5) Kwasy humusowe (kwasy próchnicowe) - jest to mieszanina wielkocząsteczkowych związków organicznych o zmiennym składzie (w zależności od składu materii organicznej, z której powstają) i charakterze kwasowym, wchodzących w skład próchnicy glebowej i roztworów wód naturalnych. Tworzą się one w biochemicznych procesach rozkładu związków organicznych budujących żywe organizmy. Budowa tych wyjątkowo skomplikowanych związków nie jest jeszcze do końca poznana, dlatego najczęściej rozpatruje się je na zasadzie różnic pomiędzy różnymi rodzajami tych substancji. Wyróżnia się dwie podstawowe grupy tych związków: kwasy huminowe - grupę związków o różnych właściwościach, której podgrupy stanowią kwasy hymatomelanowe - trudno rozpuszczalne w wodzie, a łatwo w alkoholu, o barwie brunatnej, najczęściej w postaci koloidów; kwasy huminowe brunatne; kwasy huminowe szare. Inną grupą podstawową są kwasy fulworowe (tzw. fulwokwasy) - łatwo rozpuszczalne w wodzie związki, o barwie od żółtej do jasnobrązowej, mniejszej masie cząsteczkowej aniżeli kwasy huminowe i większym stopniu dysocjacji. 6) Kwasy porostowe - są to kwasy wytwarzane przez porosty - związki organiczne będące metabolitami wtórnymi. Są one pochodnymi kwasów tłuszczowych i fenoli. Znajdują się na zewnątrznej stronie strzępek porostów w postaci kryształków o różnej barwie. Kwasy porostowe pełnią dla porostów rolę obronną, m.in. hamują rozwój mikroorganizmów oraz pasożytniczych grzybów, a niektóre mają własności bakteriobójcze (np. kwas usninowy); niektóre są z kolei trujące (np. kwas wulpinowy). Są one specyficzne tylko dla porostów, a niektóre ich rodzaje tylko dla niektórych gatunków porostów, dzięki temu wykorzystuje się je przy identyfikacji tych gatunków. Są to tzw. reakcje barwne porostów. Kwasy porostowe nadają własności lecznice niektórym gatunkom porostów. Gatunki te wykorzystywane są w ziołolecznictwie, a także medycynie ludowej oraz w farmakologii do produkcji niektórych lekarstw, np. mieszanek przeciwkaszlowych (pectosol) i galaretek wzmacniających przemianę materii. Opisano ponad 350 różnych kwasów porostowych, .in. są to: kwas usninowy, kwas wulpinowy, kwas gyroforowy, kwas lekanorowy, kwas tamnoliowy, kwas fumaroprotocetrariowy.
Metabolity wtórne Kwasy porostowe; 0,5 – 10% suchej masy;
- Wytwarzane przez grzyba z wykorzystaniem cukrów produkowanych przez glony;
- Miąższ, soralia, rzadko warstwa korowa;
- Nierozpuszczalne w wodzie;
- Forma ciekła, kryształki, granulki;
- Zazwyczaj bezbarwne
e |
| Źródło: czytelniamedyczna.pl - Przykłady kwasów porostowych. |
 7) Kwas tiooctowy - jest to organiczny związek chemiczny, siarkowy analog kwasu octowego. W stosunku do kwasu octowego ma nieco niższą temperaturę wrzenia (88-91,5 stopnia Celsjusza) i ma nieco wyższą moc (moc kwasu to termin, który określa zdolność kwasu do dysocjacji na jon wodorowy H+ i anion). W syntezie organicznej jest stosowany jako nukleofilowy odczynnik wprowadzający grupę tiolową (-SH) do cząsteczki.
7) Kwas tiooctowy - jest to organiczny związek chemiczny, siarkowy analog kwasu octowego. W stosunku do kwasu octowego ma nieco niższą temperaturę wrzenia (88-91,5 stopnia Celsjusza) i ma nieco wyższą moc (moc kwasu to termin, który określa zdolność kwasu do dysocjacji na jon wodorowy H+ i anion). W syntezie organicznej jest stosowany jako nukleofilowy odczynnik wprowadzający grupę tiolową (-SH) do cząsteczki.  8) Kwas usninowy - jest to organiczny związek chemiczny, wielofunkcyjna pochodna dibenzofuranu. Należy on do metabolitów wtórnych porostów, które zwane są kwasami porostowymi. Występuje on w postaci dwóch enacjomerów, które różnią się konfiguracją grupy metylowej w pozycji 9b. Jest on spotykany jedynie wśród niektórych rodzajów porostów, np. żyłecznika (Aclectoria), chrobotka (Cladonia), brodaczki (Usnea), misecznicy (Lecanora), odriożycy (Ramalina) mąkli (Evernia). Kwas usninowy wykazuje wysoką aktywność przeciwbakteryjną, przeciwwirusową, przeciwgrzybiczą, a także ma właściwości przeciwzapalne, przeciwbólowe, przeciwgorączkowe. Ma on działanie gojące, powlekające, osłaniające, odtruwające, oczyszczające, nawilżające, antyseptyczne, przeciwtłuszczowe, przeciwtrądzikowe. Ogranicza ponadto nadmierne wydzielanie sebum oraz regeneruje zniszczone włosy. Dlatego wiele porostów, a także ekstrakty zawierające kwas usninowy znalazły zastosowanie w przemyśle leczniczym, perfumeryjnym, kosmetycznym, jak również do zastosowań ekologicznych. Porosty należące do rodzajów zawierających kwas usninowy stosowano w produkcji leków naturalnych na całym świecie. Wiele gatunków chrobotków było stosowanych w leczeniu gruźlicy. Brodaczki natomiast wykorzystywane były w Azji, Afryce i Europie do łagodzenia bólu i gorączki. Hipokrates miał używać brodaczki właściwej (Usnea barbata) w leczeniu układu moczowego. W Chinach Usnea longissima miała pomagać w gojeniu ran i jako środek wykrztuśny. Toksyczność kwasu usninowego dla ludzi jest niewielka. Do działań niepożądanych należą: podrażnienie i alergiczne zapalenie skóry, a czasami towarzyszy mu zapalenie spojówek. Bardzo rzadko spotykane są przypadku alergii. Powszechnie stosowany jest jako składnik preparatów wspomagających odchudzanie, aczkolwiek od lat 90. XX wieku wskazywano, że wywołuje ostre zapalenie wątroby i kwasicę mleczanową.
8) Kwas usninowy - jest to organiczny związek chemiczny, wielofunkcyjna pochodna dibenzofuranu. Należy on do metabolitów wtórnych porostów, które zwane są kwasami porostowymi. Występuje on w postaci dwóch enacjomerów, które różnią się konfiguracją grupy metylowej w pozycji 9b. Jest on spotykany jedynie wśród niektórych rodzajów porostów, np. żyłecznika (Aclectoria), chrobotka (Cladonia), brodaczki (Usnea), misecznicy (Lecanora), odriożycy (Ramalina) mąkli (Evernia). Kwas usninowy wykazuje wysoką aktywność przeciwbakteryjną, przeciwwirusową, przeciwgrzybiczą, a także ma właściwości przeciwzapalne, przeciwbólowe, przeciwgorączkowe. Ma on działanie gojące, powlekające, osłaniające, odtruwające, oczyszczające, nawilżające, antyseptyczne, przeciwtłuszczowe, przeciwtrądzikowe. Ogranicza ponadto nadmierne wydzielanie sebum oraz regeneruje zniszczone włosy. Dlatego wiele porostów, a także ekstrakty zawierające kwas usninowy znalazły zastosowanie w przemyśle leczniczym, perfumeryjnym, kosmetycznym, jak również do zastosowań ekologicznych. Porosty należące do rodzajów zawierających kwas usninowy stosowano w produkcji leków naturalnych na całym świecie. Wiele gatunków chrobotków było stosowanych w leczeniu gruźlicy. Brodaczki natomiast wykorzystywane były w Azji, Afryce i Europie do łagodzenia bólu i gorączki. Hipokrates miał używać brodaczki właściwej (Usnea barbata) w leczeniu układu moczowego. W Chinach Usnea longissima miała pomagać w gojeniu ran i jako środek wykrztuśny. Toksyczność kwasu usninowego dla ludzi jest niewielka. Do działań niepożądanych należą: podrażnienie i alergiczne zapalenie skóry, a czasami towarzyszy mu zapalenie spojówek. Bardzo rzadko spotykane są przypadku alergii. Powszechnie stosowany jest jako składnik preparatów wspomagających odchudzanie, aczkolwiek od lat 90. XX wieku wskazywano, że wywołuje ostre zapalenie wątroby i kwasicę mleczanową.
KWASY AROMATYCZNE:
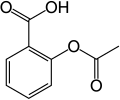
1) Kwas acetylosalicylowy (łac. acidum acetylsalicylicum), potonicznie aspiryna - jest to organiczny związek chemiczny, acetylowa pochodna kwasu salicylowego, popularny środek o przeciwbólowym, przeciwgorączkowym, a także przeciwzapalnym działaniu. Przy długotrwałym stosowaniu posiada również działanie przeciwzakrzepowe. Jest składnikiem wielu złożonych leków. Kwas acetylosalicylowy otrzymuje się w reakcji kwasu salicylowego z bezwodnikiem octowym w obecności kwasu siarkowego lub fosforowego jako katalizatora:
DZIAŁANIE KWASU ACETYLOSALICYLOWEGO:
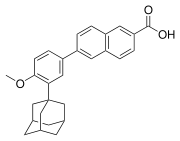
2) Adapalen - organiczny związek chemiczny, wielopierścieniowy aromatyczny kwas karboksylowy, który stosowany jest jako lek przeciwtrądzikowy. Jest on retinoidem (kwasową pochodną witaminy A, która pobudza wzrost i wpływa na różnicowanie się komórek nabłonkowych oraz zwiększa syntezę glikoprotein błonowych) trzeciej generacji (poliaromatycznym, który charakteryzuje się selektywnym działaniem receptorowym). Działa silniej przeciwzapalnie aniżeli poprzednie generacje retinoidów, zaś pośrednio również antybakteryjnie i przeciwłojotokowo. Wykazuje większą skuteczność i jest lepiej tolerowany. Stosowany jest w leczeniu trądziku w monoterapii i w skojarzeniu z innymi lekami zewnętrznymi. Adapalen nie ulega zniszczeniu pod wpływem światła, hamuje aktywności cyklooksygenazy; przywraca prawidłowe różnicowania komórek naskórka, zapobiega rogowaceniu ujścia mieszka włosowego, dzieki czemu chroni przed powstawaniem mikrozaskórników, zaskórników i zmian zapalnych. Stosowany jest zewnętrznie w postaci maści lub żelu, zazwyczaj raz dziennie, na skórę zmienioną chorobowo w przebiegu trądziku - zwłaszcza trądziku pospolitego. Leczenie powinno trwać przynajmniej kilka tygodni. Lek ten charakteryzuje się ponadto niską biodostępnością.
Przykładem leku zawierającego adapalen jest lek przeciwtrądzikowy wydawany na receptę o nazwie handlowej "Epiduo":
 |
| Źródło: lawendowepiora.blogpost.com |
 |
| Źródło: Dokteronline.com |
Możliwymi skutkami ubocznymi stosowania adapalenu może być zaczerwienienie, wysuszenie skóry twarzy, przemijające podrażnienie i pieczenie skóry. Nie należy również stosować preparatu na uszkodzoną skórę. Adapalen nie wywołuje reakcji fototoksycznych ani fotoalergicznych, lecz na skutek ścienienia warstwy rogowej naskórka dochodzi do uwrażliwienia skóry na działanie promieni UV, więc podczas kuracji należy unikać nadmiernej ekspozycji na słońce.
 3) Kwas alkilobenzenosulfonowy - jest to siarkoorganiczny związek chemiczny, pochodna kwasu benzenosulfonowego zawierająca grupĻę alkilową przyłączoną do pierścienia benzenowego. W przemyśle nazwą kwas ABS określa się mieszaninę różnych kwasów alkilobenzenosulfonowych, wykorzystywaną do otrzymywania alkilobenzenosulfonianu sodu, detergentu stosowanego w szamponach i innych środkach czystości. Jest to półpłynna pasta ulegająca roztwarstwieniu, barwy białej do kremowej. Kwas ABS otrzymuje się w wyniku sulfonowania alkilobenzenów. Produkt przemysłowy ma postać żółtobrązowej, gęstej cieczy.
3) Kwas alkilobenzenosulfonowy - jest to siarkoorganiczny związek chemiczny, pochodna kwasu benzenosulfonowego zawierająca grupĻę alkilową przyłączoną do pierścienia benzenowego. W przemyśle nazwą kwas ABS określa się mieszaninę różnych kwasów alkilobenzenosulfonowych, wykorzystywaną do otrzymywania alkilobenzenosulfonianu sodu, detergentu stosowanego w szamponach i innych środkach czystości. Jest to półpłynna pasta ulegająca roztwarstwieniu, barwy białej do kremowej. Kwas ABS otrzymuje się w wyniku sulfonowania alkilobenzenów. Produkt przemysłowy ma postać żółtobrązowej, gęstej cieczy. 4) Kwas anyżowy - jest to organiczny związek chemiczny z grupy aromatycznych kwasów karboksylowych, para-metoksylowa pochodna kwasu benzoesowego. Występuje w olejkach eterycznych pozyskiwanych z biedrzeńca anyżu. Jest stosowany w przemyśle kosmetycznym jako środek konserwujący i zapachowy.
4) Kwas anyżowy - jest to organiczny związek chemiczny z grupy aromatycznych kwasów karboksylowych, para-metoksylowa pochodna kwasu benzoesowego. Występuje w olejkach eterycznych pozyskiwanych z biedrzeńca anyżu. Jest stosowany w przemyśle kosmetycznym jako środek konserwujący i zapachowy.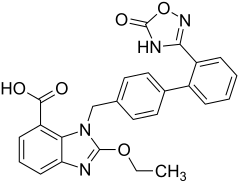 5) Azylsartan (łac. azilsartanum) - jest to wielofunkcyjny organiczny związek chemiczny, lek stosowany w leczeniu nadciśnienia tętniczego, hamujący działanie angiotensyny II (angiotensyna to hormon peptydowy wchodzący w skład układu hormonalnego RAA, którego zadaniem jest kontrola stężenia jonów sodowych i potasowych w organizmie. Angiotensyny stymulują wydzielanie mineralokortykosteroidu aldosteronu) poprzez blokadę receptora angiotensynowego typu 1 (AT1).
5) Azylsartan (łac. azilsartanum) - jest to wielofunkcyjny organiczny związek chemiczny, lek stosowany w leczeniu nadciśnienia tętniczego, hamujący działanie angiotensyny II (angiotensyna to hormon peptydowy wchodzący w skład układu hormonalnego RAA, którego zadaniem jest kontrola stężenia jonów sodowych i potasowych w organizmie. Angiotensyny stymulują wydzielanie mineralokortykosteroidu aldosteronu) poprzez blokadę receptora angiotensynowego typu 1 (AT1). 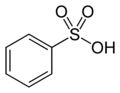 6) Kwas benzenosulfonowy - jest to organiczny związek chemiczny z grupy aromatycznych kwasów sulfonowych. Tworzy on białe kryształy dobrze rozpuszczalne w wodzie i etanolu. Jest otrzymywany w wyniku sulfonowania benzenu stężonym kwasem siarkowym w temperaturze 170-180 stopni Celsjusza.
6) Kwas benzenosulfonowy - jest to organiczny związek chemiczny z grupy aromatycznych kwasów sulfonowych. Tworzy on białe kryształy dobrze rozpuszczalne w wodzie i etanolu. Jest otrzymywany w wyniku sulfonowania benzenu stężonym kwasem siarkowym w temperaturze 170-180 stopni Celsjusza. 
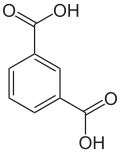
 7) Kwas 1,3,5-benzenotrikarboksylowy - jest to organiczny związek chemiczny, kwas aromatyczny zawierający trzy grupy karboksylowe w pozycjach 1, 3, 5.
7) Kwas 1,3,5-benzenotrikarboksylowy - jest to organiczny związek chemiczny, kwas aromatyczny zawierający trzy grupy karboksylowe w pozycjach 1, 3, 5. 8) Kwas benzoesowy (łac. acidum benzolcum) - jest to organiczny związek chemiczny, najprostszy aromatyczny kwas karboksylowy. Jest on zbudowany z pierścienia benzenowego zawierającego jedną grupę karboksylową. W czasie ogrzewania łatwo sublimuje. Stosowany jest jako środek konserwujący do żywności. Jego sole oraz estry to benzoesany. W naturze kwas ten występuje w korze czereśni i strączyńca, a także w malinach i anyżu. W postaci aniony benzoesanowego występuje w znacznych ilościach w żurawinie, grzybach, cynamonie oraz niektórych produktach mlecznych (efekt fermentacji bakteryjnej). Do celów przemysłowych można go otrzymać na drodze syntetycznej. Jedną z jej metod jest utlenienie toluenu, np. za pomocą nadmanganianu potasu. Kwas ten może być również otrzymywany przez hydrolizę benzonitrylu.
8) Kwas benzoesowy (łac. acidum benzolcum) - jest to organiczny związek chemiczny, najprostszy aromatyczny kwas karboksylowy. Jest on zbudowany z pierścienia benzenowego zawierającego jedną grupę karboksylową. W czasie ogrzewania łatwo sublimuje. Stosowany jest jako środek konserwujący do żywności. Jego sole oraz estry to benzoesany. W naturze kwas ten występuje w korze czereśni i strączyńca, a także w malinach i anyżu. W postaci aniony benzoesanowego występuje w znacznych ilościach w żurawinie, grzybach, cynamonie oraz niektórych produktach mlecznych (efekt fermentacji bakteryjnej). Do celów przemysłowych można go otrzymać na drodze syntetycznej. Jedną z jej metod jest utlenienie toluenu, np. za pomocą nadmanganianu potasu. Kwas ten może być również otrzymywany przez hydrolizę benzonitrylu.6H
5CN → C
6H
5CONH
2 → C
6H
5COOH
W nadmiernych ilościach kwas benzoesowy może powodować astmę, pokrzywkę i problemy behawioralne. W niektórych przypadkach wpływa również niekorzystnie na płuca, a także podrażnia oczy i skórę. Jest toksyczny dla układu nerwowego. Ponieważ jego pochodną jest aspiryna, powinny go unikać osoby, które są uczulone na owy lek.
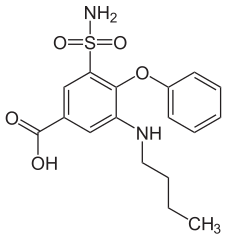 9) Bumetanid (łac. bumetanidum) - jest to wielofunkcyjny organiczny związek chemiczny z grupy benzenosulfonamidów, lek moczopędny z grupy diuretyków pętlowych (leków moczopędnych których mechanizm działania polega na hamowaniu resorpcji zwrotnej jonu chlorkowego we wstępującym odcinku pętli Henlego i w następstwie jonu sodowego. Pociąga to za sobą zwiększone wydalanie potasu), stosowany w leczeniu nadciśnienia tętniczego, obrzęku płuc oraz obrzęków w przebiegu innych schorzeń, blokujący symporter sodowo-potasowo-chjlorowy w grubym ramieniu wstępującym pętli Henlego. Bumetamid jest diuretykiem pętlowym, który hamuje działanie symportera sodowo-potasowo-chjlorowego w grubym ramieniu wstępującym pętli Henlego oraz zwiększa przepływ nerkowy w nieznanym mechanizmie, który może być zależny od prostaglandyn. Działanie bermetanidu po podaniu doustnym rozpoczyna się w ciągu 30 minut, utrzymuje się przez 4-6 godzin, a maksymalny efekt następuje po 1-2 godzinach, natomiast po podaniu dożylnym rozpoczyna się w ciągu 2-3 minut, utrzymuje się przez 2 godziny, a maksymalny efekt następuje po 30-45 minutach. Bumetanid stosowany jest do leczenia nadciśnienia tętniczego, obrzeku płuc, obrzęków w przebiegu niewydolności nerek, obrzeków w przebiegu niewydolności serca, w zespole nerczycowy i w marskości wątroby.
9) Bumetanid (łac. bumetanidum) - jest to wielofunkcyjny organiczny związek chemiczny z grupy benzenosulfonamidów, lek moczopędny z grupy diuretyków pętlowych (leków moczopędnych których mechanizm działania polega na hamowaniu resorpcji zwrotnej jonu chlorkowego we wstępującym odcinku pętli Henlego i w następstwie jonu sodowego. Pociąga to za sobą zwiększone wydalanie potasu), stosowany w leczeniu nadciśnienia tętniczego, obrzęku płuc oraz obrzęków w przebiegu innych schorzeń, blokujący symporter sodowo-potasowo-chjlorowy w grubym ramieniu wstępującym pętli Henlego. Bumetamid jest diuretykiem pętlowym, który hamuje działanie symportera sodowo-potasowo-chjlorowego w grubym ramieniu wstępującym pętli Henlego oraz zwiększa przepływ nerkowy w nieznanym mechanizmie, który może być zależny od prostaglandyn. Działanie bermetanidu po podaniu doustnym rozpoczyna się w ciągu 30 minut, utrzymuje się przez 4-6 godzin, a maksymalny efekt następuje po 1-2 godzinach, natomiast po podaniu dożylnym rozpoczyna się w ciągu 2-3 minut, utrzymuje się przez 2 godziny, a maksymalny efekt następuje po 30-45 minutach. Bumetanid stosowany jest do leczenia nadciśnienia tętniczego, obrzeku płuc, obrzęków w przebiegu niewydolności nerek, obrzeków w przebiegu niewydolności serca, w zespole nerczycowy i w marskości wątroby.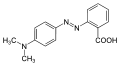 10) Czerwień metylowa - jest to organiczny związek chemiczny, barwnik azowy stosowany najczęściej jako chemiczny wskaźnik pH. W temperaturze pokojowej ejst to ciemnoczerwone, krystaliczne ciało stałe. Zmienia barwę od ciemnoczerwonej do jasnożółtej w zakresie pH od 4,2 do 6,3. Czerwień metylowa, podobnie jak oranż metylowy jest stosowana w alkacymetrii. Stosuje się ją również w mikrobiologii do detekcji zmiany pH zachodzącej w czasie fermentacji glukozy.
10) Czerwień metylowa - jest to organiczny związek chemiczny, barwnik azowy stosowany najczęściej jako chemiczny wskaźnik pH. W temperaturze pokojowej ejst to ciemnoczerwone, krystaliczne ciało stałe. Zmienia barwę od ciemnoczerwonej do jasnożółtej w zakresie pH od 4,2 do 6,3. Czerwień metylowa, podobnie jak oranż metylowy jest stosowana w alkacymetrii. Stosuje się ją również w mikrobiologii do detekcji zmiany pH zachodzącej w czasie fermentacji glukozy.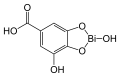 11) Dermatol (łac. Bismuthi subgallas) - jest to nazwa zwyczajowa zasadowego galusanu bizmutawego. Substancja ma postać ciężkiego, żółtego proszku. Dermatol jest wykorzystywany w lecznictwie jako zasypka na skórę, służy jako środek odkażający, osuszający, ściągający oraz przeciwzapalny. Może być ponadto stosowany doustnie jako środek przeciwbiegunkowy i osłaniający błonę śluzową żołądka oraz dwunastnicy (dawniej posiadał duże znaczenie jako lek przeciwwrzodowy). Dermatol działa ściągająco na skórę oraz błony śluzowe oraz rany. Denaturuje białka na powierzchni skóry oraz błon śluzowych i dzięki temu tworzy nieprzepuszczalną warstwę ochronną, a ponadto wpływa ściągająco na naczynia krwionośne, co powoduje zanikanie obrzęków. Dermatol hamuje ponadto drobne krwawienia, działa wysuszająco i słabo odkażająco.
11) Dermatol (łac. Bismuthi subgallas) - jest to nazwa zwyczajowa zasadowego galusanu bizmutawego. Substancja ma postać ciężkiego, żółtego proszku. Dermatol jest wykorzystywany w lecznictwie jako zasypka na skórę, służy jako środek odkażający, osuszający, ściągający oraz przeciwzapalny. Może być ponadto stosowany doustnie jako środek przeciwbiegunkowy i osłaniający błonę śluzową żołądka oraz dwunastnicy (dawniej posiadał duże znaczenie jako lek przeciwwrzodowy). Dermatol działa ściągająco na skórę oraz błony śluzowe oraz rany. Denaturuje białka na powierzchni skóry oraz błon śluzowych i dzięki temu tworzy nieprzepuszczalną warstwę ochronną, a ponadto wpływa ściągająco na naczynia krwionośne, co powoduje zanikanie obrzęków. Dermatol hamuje ponadto drobne krwawienia, działa wysuszająco i słabo odkażająco. 12) Kwas dipikolinowy - organiczny związek chemiczny, dikarboksylowa pochodna pirydyny. Kwas dipikolinowy jest związkiem swoistym tylko dla przetrwalników (endospor), gdzie umiejscowiony jest tylko w protoplastach i nie występuje w komórkach wegetatywnych. Chelatuje jony wapnia (Ca2+), tworząc dipikolinian wapnia, mogący stanowić 10-15% suchej masy spory. Duże stężenie dipikolinianu wapnia wraz z warstwami gęsto upakowanej mureiny i białek tworzących płaszcz, stabilizuje skład chemiczny spory. DPA obniża, w zależności od szczepu, od 5-50 razy, wrażliwość endospor na promieniowanie UV oraz znacznie zwiększa ich oporność na ogrzewanie w warunkach podwyższonej wilgotności środowiska w porównaniu z komórkami wegetatywnymi, z których pochodzą.
12) Kwas dipikolinowy - organiczny związek chemiczny, dikarboksylowa pochodna pirydyny. Kwas dipikolinowy jest związkiem swoistym tylko dla przetrwalników (endospor), gdzie umiejscowiony jest tylko w protoplastach i nie występuje w komórkach wegetatywnych. Chelatuje jony wapnia (Ca2+), tworząc dipikolinian wapnia, mogący stanowić 10-15% suchej masy spory. Duże stężenie dipikolinianu wapnia wraz z warstwami gęsto upakowanej mureiny i białek tworzących płaszcz, stabilizuje skład chemiczny spory. DPA obniża, w zależności od szczepu, od 5-50 razy, wrażliwość endospor na promieniowanie UV oraz znacznie zwiększa ich oporność na ogrzewanie w warunkach podwyższonej wilgotności środowiska w porównaniu z komórkami wegetatywnymi, z których pochodzą.  13) Eprosartan (łac. eprosartanum) - jest to wielofunkcyjny organiczny związek chemiczny, pochodna kwasu benzoesowego, lek stosowany w leczeniu nadciśnienia tętniczeog, hamujący działanie angiotensyny II poprzez blokadę receptora angiotensynowego typu 1 (AT1). Eprosartan jest antagonistą receptora angiotensyny II, hamującym działanie angiotensyny II poprzez blokadę receptora angiotensynowego typu 1 (AT1). Eprosartan nie podlega efektowi pierwszego przejścia i w minimalnym stopniu jest metabolizowany (mniej niż 2% przyjętej doustnie dawki jest wydalana w moczu w postaci glukuronidów - pochodnych kwasu glukuronowego, gdzie cząsteczki kwasu glukuronowego połączone są z inną substancją wiązaniem glikozydowym).
13) Eprosartan (łac. eprosartanum) - jest to wielofunkcyjny organiczny związek chemiczny, pochodna kwasu benzoesowego, lek stosowany w leczeniu nadciśnienia tętniczeog, hamujący działanie angiotensyny II poprzez blokadę receptora angiotensynowego typu 1 (AT1). Eprosartan jest antagonistą receptora angiotensyny II, hamującym działanie angiotensyny II poprzez blokadę receptora angiotensynowego typu 1 (AT1). Eprosartan nie podlega efektowi pierwszego przejścia i w minimalnym stopniu jest metabolizowany (mniej niż 2% przyjętej doustnie dawki jest wydalana w moczu w postaci glukuronidów - pochodnych kwasu glukuronowego, gdzie cząsteczki kwasu glukuronowego połączone są z inną substancją wiązaniem glikozydowym).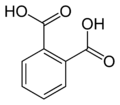
14) Kwas ftalowy - jest to organiczny związek z grupy dikarboksylowych kwasów aromatycznych, stosowany w syntezie organicznej. W laboratorium kwas ftalowy można otrzymać w wyniku hydratacji bezwodnika ftalowego, ale na skalę przemysłową produkuje się go przez utlenianie o-ksylenu.
15) Kwas izoftalowy - jest to organiczny związek chemiczny, kwas aromatyczny zawierający dwie grupy karboksylowe w pozycji meta. Jego izomer orto to kwas ftalowy, zaś izomer para to kwas tereftalowy.
 16) Kwas tereftalowy (kwas 1,4-benzenodikarboksylowy) - jest to organiczny związek chemiczny z grupy kwasów aromatycznych, zawierający dwie grupy karboksylowe w pozycji para. Jego izomer orto to kwas ftalowy, a izomer meta to kwas izoftalowy. Na skalę przemysłową jest otrzymywany przez utlenianie paraksylenu tlenem z powietrza. Reakcja prowadzona jest w kwasie octowym jako rozpuszczalniku i w obecności katalizatora (sole kobaltu i manganu oraz bromki jako promotor). Stosuje się go do produkcji włókien poliestrowych (m.in. elany) oraz barwników.
16) Kwas tereftalowy (kwas 1,4-benzenodikarboksylowy) - jest to organiczny związek chemiczny z grupy kwasów aromatycznych, zawierający dwie grupy karboksylowe w pozycji para. Jego izomer orto to kwas ftalowy, a izomer meta to kwas izoftalowy. Na skalę przemysłową jest otrzymywany przez utlenianie paraksylenu tlenem z powietrza. Reakcja prowadzona jest w kwasie octowym jako rozpuszczalniku i w obecności katalizatora (sole kobaltu i manganu oraz bromki jako promotor). Stosuje się go do produkcji włókien poliestrowych (m.in. elany) oraz barwników. 
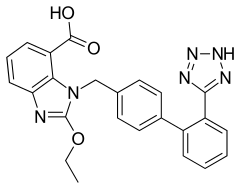 17) Kandesartan - jest to organiczny związek chemiczny, bloker receptora angiotensyny. Jest on pierwszym lekiem, u którego potwierdzono skuteczność kliniczną, niezależną od dawki stosowanego inhibitora enzymu konwertującego angiotensynę. Nie jest on usuwany przez hemodializę. Wchodzi on w skład grupy leków będących antagonistami receptora dla angiotensyny II o działaniu wybiórczym na receptory AT1. Kandesartan blokuje działanie angiotensyny II, wywołuje rozkurcz naczyń, zmniejsza ciśnienie tętnicze, powoduje rozluźnienie mięśni gładkich naczyń krwionośnych (rozszerza naczynia i powoduje spadek ciśnienia tętniczego). Do działań ubocznych pojawiających się podczas stosowania kandesartanu można zaliczyć m.in. zawroty i bóle głowy, zakażenia układu oddechowego, nadmierne obniżenie ciśnienia tętniczego, zaburzenie czynności nerek, zwiększenie stężenia kreatyniny, mocznika i potasu w surowicu. Sporadycznie mogą również się pojawić: obrzęk naczynioruchowy, bóle stawów, mięśni i pleców, wysypka, pokrzywka, świąd, zwiększenie aktywności enzymów wątrobowych, zaburzenia czynności wątroby i nerek, zapalenie wątroby, zmniejszenie liczby leukocytów i granulocytów obojętnochłonnych.
17) Kandesartan - jest to organiczny związek chemiczny, bloker receptora angiotensyny. Jest on pierwszym lekiem, u którego potwierdzono skuteczność kliniczną, niezależną od dawki stosowanego inhibitora enzymu konwertującego angiotensynę. Nie jest on usuwany przez hemodializę. Wchodzi on w skład grupy leków będących antagonistami receptora dla angiotensyny II o działaniu wybiórczym na receptory AT1. Kandesartan blokuje działanie angiotensyny II, wywołuje rozkurcz naczyń, zmniejsza ciśnienie tętnicze, powoduje rozluźnienie mięśni gładkich naczyń krwionośnych (rozszerza naczynia i powoduje spadek ciśnienia tętniczego). Do działań ubocznych pojawiających się podczas stosowania kandesartanu można zaliczyć m.in. zawroty i bóle głowy, zakażenia układu oddechowego, nadmierne obniżenie ciśnienia tętniczego, zaburzenie czynności nerek, zwiększenie stężenia kreatyniny, mocznika i potasu w surowicu. Sporadycznie mogą również się pojawić: obrzęk naczynioruchowy, bóle stawów, mięśni i pleców, wysypka, pokrzywka, świąd, zwiększenie aktywności enzymów wątrobowych, zaburzenia czynności wątroby i nerek, zapalenie wątroby, zmniejszenie liczby leukocytów i granulocytów obojętnochłonnych. 17) Lumakaftor (łac. lumacaftorum) - jest to wielofunkcyjny organiczny związek chemiczny, lek stosowany w leczeniu mukowiscydozy, zwiększający obecność zmutowanego białka CFTR na powierzchni komórki. CFTR (ang. cystis fibrosis transmembrane conductance regulator - błonowy regulator przewodnictwa) to białko tworzące kanał chlorkowy w błonie komórkowej, kodowane przez gen CFTR znajdujący się na długim ramieniu chromosomu 7 w locus 7q31.2 Jego nieprawidłowa forma wywołuje chorobę genetyczną zwaną mukowiscydozą.

 18) Kwas anyżowy (kwas p-metoksybenzoesowy) - organiczny związek chemiczny z grupy aromatycznych kwasów karboksylowych, para-metoksylowa pochodna kwasu benzoesowego. Występuje on w olejkach eterycznych pozyskiwanych z biedrzeńca anyżu. Stosowany jest w przemyśle kosmetycznym jako środek konserwujący i zapachowy.
18) Kwas anyżowy (kwas p-metoksybenzoesowy) - organiczny związek chemiczny z grupy aromatycznych kwasów karboksylowych, para-metoksylowa pochodna kwasu benzoesowego. Występuje on w olejkach eterycznych pozyskiwanych z biedrzeńca anyżu. Stosowany jest w przemyśle kosmetycznym jako środek konserwujący i zapachowy.19) Kwas 3-nitrobenzoesowy - pochodna kwasu benzoesowego.
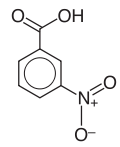
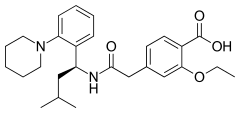 20) Repaglinid - jest to organiczny związek chemiczny, lek przeciwcukrzycowy i hipoglikemizujący. Jest on krótkodziałającym lekiem hipoglimekizującym zaliczanym do pochodnych kwasu karbamoilobenzoesowego, o mechanizmie działania zbliżonym do pochodnych sulfonylomocznika. Udowodnionym mechanizmem jego działania jest stymulowanie wydzielania insyliny poprzez hamowanie kanałów potasowych ATP-zależnych. W cukrzycy typu 2 lek ten szybko koryguje zaburzenie wydzielania insuliny stymulowane posiłkiem, bez zwiększania wydzielania hormonu pomiędzy posiłkami i w nocy. Pozwala to choremu leczonemu repaglinidem na przyjmowanie posiłków w rytmie dostosowanym do indywidualnych potrzeb przy równoczesnym zmniejszeniu ryzyka hipoglikemii. Repaglinid jest pochodną kwasu karbamoilometylobenzoesowego. Aktywność antyhiperglikemiczna leku jest stereoselektywna, enacjomer (S) wykazuje 100 razy większą siłę działania niż enacjomer (R). Wskazaniem do leczenia repaglinidem jest cukrzyca typu 2. Lek podaje się chorym, u których zawiodło postępowanie niefarmakologiczne (dieta, zmniejszanie masy ciała i ćwiczenia fizyczne). Repaglinid spełnia szczególną rolę u chorych z wysokim poposiłkowym stężeniem cukru we krwi. Preparat można stosować w terapii skojarzonej u pacjentów leczonych nieskutecznie metforminą lub insuliną. Połączenie repaglinidu z metforminą lub insuliną ułatwia utrszymanie glikemii na prawidłowym poziomie.
20) Repaglinid - jest to organiczny związek chemiczny, lek przeciwcukrzycowy i hipoglikemizujący. Jest on krótkodziałającym lekiem hipoglimekizującym zaliczanym do pochodnych kwasu karbamoilobenzoesowego, o mechanizmie działania zbliżonym do pochodnych sulfonylomocznika. Udowodnionym mechanizmem jego działania jest stymulowanie wydzielania insyliny poprzez hamowanie kanałów potasowych ATP-zależnych. W cukrzycy typu 2 lek ten szybko koryguje zaburzenie wydzielania insuliny stymulowane posiłkiem, bez zwiększania wydzielania hormonu pomiędzy posiłkami i w nocy. Pozwala to choremu leczonemu repaglinidem na przyjmowanie posiłków w rytmie dostosowanym do indywidualnych potrzeb przy równoczesnym zmniejszeniu ryzyka hipoglikemii. Repaglinid jest pochodną kwasu karbamoilometylobenzoesowego. Aktywność antyhiperglikemiczna leku jest stereoselektywna, enacjomer (S) wykazuje 100 razy większą siłę działania niż enacjomer (R). Wskazaniem do leczenia repaglinidem jest cukrzyca typu 2. Lek podaje się chorym, u których zawiodło postępowanie niefarmakologiczne (dieta, zmniejszanie masy ciała i ćwiczenia fizyczne). Repaglinid spełnia szczególną rolę u chorych z wysokim poposiłkowym stężeniem cukru we krwi. Preparat można stosować w terapii skojarzonej u pacjentów leczonych nieskutecznie metforminą lub insuliną. Połączenie repaglinidu z metforminą lub insuliną ułatwia utrszymanie glikemii na prawidłowym poziomie.
21) Kwas sulfanilowy (kwas p-aminobenzenosulfonowy) - jest to aromatyczny związek organiczny zawierający podstawnik aminowy i sulfonowy w konfiguracji para (p-aminowa pochodna kwasu benzenosulfonowego). Jest stosowany do otrzymywania barwników diazowych. Pochodne amidowe kwasu sulfanilowego to sulfoamidy, stosowane jako środki baktriostatyczne.

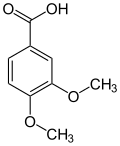 22) Kwas weratrowy - jest to organiczny związek chemiczny, 3,4-dimetoksypochodna kwasu benzoesowego. Występuje w róznych gatunkach ciemiężycy (Veratrum), m.in. w Veratrum sabadilia i w nasionach badyli lekarskiej (Schoenocaulon officinale). Stosowany jest do otrzymywania innych związków. Kwas weratrowy można otrzymać poprzez utlenianie aldehydu weratrowego nadmanganianem potasu. Można także zostać otrzymany poprzez ciąg reakcji składający się z trzech etapów: sulfonowania kwasu 4-hydroksybenzoesowego, działania wodorotlenkiem potasu na tak powstały kwas 4-hydroksy-3-sulfobenzoesowy i metylowania otrzymanego kwasu protokatechowego jodkiem metylu w obecności wodorotlenku sodu.
22) Kwas weratrowy - jest to organiczny związek chemiczny, 3,4-dimetoksypochodna kwasu benzoesowego. Występuje w róznych gatunkach ciemiężycy (Veratrum), m.in. w Veratrum sabadilia i w nasionach badyli lekarskiej (Schoenocaulon officinale). Stosowany jest do otrzymywania innych związków. Kwas weratrowy można otrzymać poprzez utlenianie aldehydu weratrowego nadmanganianem potasu. Można także zostać otrzymany poprzez ciąg reakcji składający się z trzech etapów: sulfonowania kwasu 4-hydroksybenzoesowego, działania wodorotlenkiem potasu na tak powstały kwas 4-hydroksy-3-sulfobenzoesowy i metylowania otrzymanego kwasu protokatechowego jodkiem metylu w obecności wodorotlenku sodu. KWASY FOSFONOWE:

1) Kwas alendronowy (łac. acidum alendronicum) - jest to organiczny związek chemiczny wykorzystywany w leczeniu osteoporozy. Hamuje on resorpcję tkanki kostnej wywołaną przez osteoklasty. Stosowany jest w profilaktyce i leczeniu osteoporozy u kobiet, a także u mężczyzn, a także w zapobieganiu i leczeniu osteoporozy wywołanej kortykosteroidami łącznie z suplementacją preparatami wapnia i witaminy D. Może być stosowany również w leczeniu Choroby Pageta kości (łac. osteitis deformans) - przewlekłej choroby układu kostnego, która charakteryzuje się występowaniem co najmniej jednego ogniska nieprawidłowego tworzenia kości przez osteoblasty, poprzedzone nasiloną reabsorpcją kości przez osteoklasty.
 2) Etefon (kwas 2-chloroetylofosfonowy) - fosfoorganiczny związek chemiczny z grupy kwasów fosfonowych, regulator wzrostu i rozwoju roślin. Jest on stosowany w rolnictwie do regulacji rozwoju roślin w rozmaitych fazach oraz do przyspieszania dojrzewania owoców i warzyw. W sadownictwie, przy obfitym zawiązywaniu się owoców, do przerzedzania zawiązków w gatunkach ziarnkowych etefon stosowany jest w formie oprysku. Po zastosowaniu rozkłada się z wydzieleniem kwasu fosforowego, kwasu solnego i etylenu, który jest właściwym czynnikiem aktywnym wpływającym na metabolizm roślin.
2) Etefon (kwas 2-chloroetylofosfonowy) - fosfoorganiczny związek chemiczny z grupy kwasów fosfonowych, regulator wzrostu i rozwoju roślin. Jest on stosowany w rolnictwie do regulacji rozwoju roślin w rozmaitych fazach oraz do przyspieszania dojrzewania owoców i warzyw. W sadownictwie, przy obfitym zawiązywaniu się owoców, do przerzedzania zawiązków w gatunkach ziarnkowych etefon stosowany jest w formie oprysku. Po zastosowaniu rozkłada się z wydzieleniem kwasu fosforowego, kwasu solnego i etylenu, który jest właściwym czynnikiem aktywnym wpływającym na metabolizm roślin.
3) Cydofowir - jest to organiczny związek chemiczny z grupy fosfonianów o strukturze zawierającej elementy naturalnego nukleotydu, 5'-fosforanu cytydyny. Stosowany jest jako lek o właściwości antywirusowych przeciwko cytomegalowirusowi i ospie. Działanie opiera się na inhibicji polimerazy DNA.

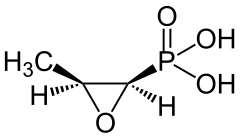 4) Fosfomycyna (łac. Fosfomycinum) - jest to fosfoorganiczny związek chemiczny z grupy fosfonianów. Jest antybiotykiem. Występuje naturalnie i został wyizolowany z różnych szczepów Streptomyces, będący pochodną kwasu fosfonowego. Fosfomycyna jest antybiotykiem o działaniu bakteriobójczym. Mechanizm działania opiera się na hamowaniu pierwszego etapu syntezy peptydoglikanu ściany komórkowej bakterii, poprzez unieczynnienie enzymu transferazy fosfoenolopirogronianowej. Fosfomycyna obejmuje swym działaniem zarówno bakterie Gram-dodatnie jak i Gram-ujemne, m.in. Escherichia coli, Citrobacter, Klebsiella, Proteus, Serratia, Pseudomonas, Enterobacter. Na fosfomycynę oporne są drobnoustroje z rodzaju Bacteroides oraz pewne szczepy Pseudomonas i Proteus. Oporność może być typu chromosomalnego lub plazmidowego. Fosfomycynę stosouje się w niepowikłanych postaciach zapalenia pęcherza moczowego, w przypadku bezobjawowego bakteriomoczu, o ile są wskazania do jego leczenia, oraz w profilaktyce zakażeń układu moczowego.
4) Fosfomycyna (łac. Fosfomycinum) - jest to fosfoorganiczny związek chemiczny z grupy fosfonianów. Jest antybiotykiem. Występuje naturalnie i został wyizolowany z różnych szczepów Streptomyces, będący pochodną kwasu fosfonowego. Fosfomycyna jest antybiotykiem o działaniu bakteriobójczym. Mechanizm działania opiera się na hamowaniu pierwszego etapu syntezy peptydoglikanu ściany komórkowej bakterii, poprzez unieczynnienie enzymu transferazy fosfoenolopirogronianowej. Fosfomycyna obejmuje swym działaniem zarówno bakterie Gram-dodatnie jak i Gram-ujemne, m.in. Escherichia coli, Citrobacter, Klebsiella, Proteus, Serratia, Pseudomonas, Enterobacter. Na fosfomycynę oporne są drobnoustroje z rodzaju Bacteroides oraz pewne szczepy Pseudomonas i Proteus. Oporność może być typu chromosomalnego lub plazmidowego. Fosfomycynę stosouje się w niepowikłanych postaciach zapalenia pęcherza moczowego, w przypadku bezobjawowego bakteriomoczu, o ile są wskazania do jego leczenia, oraz w profilaktyce zakażeń układu moczowego.  5) Foskarnet - jest to organiczny związek chemiczny, pochodna kwasu fosfonowego i lek przeciwwirusowy. Hamuje on polimerazę DNA poprzez blokowanie miejsc wiązania pirofosforanu. Jest również inhibitorem enzymu odwrotnej transkryptazy wielu retrowirusów.
5) Foskarnet - jest to organiczny związek chemiczny, pochodna kwasu fosfonowego i lek przeciwwirusowy. Hamuje on polimerazę DNA poprzez blokowanie miejsc wiązania pirofosforanu. Jest również inhibitorem enzymu odwrotnej transkryptazy wielu retrowirusów. 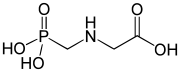 6) Glifosat - jest to organiczny związek chemiczny z grupy fosfonianów. Jest aktywnym składnikiem niektórych nieselektywnych herbicydów. Hamuje działanie bardzo ważnego dla roślin enzymu, a mianowicie syntazy EPSPS (syntaza 5-enolopriogroniano-szikimowo-3-fosforanowa), który jest kluczowym enzymem na szlaku metabolicznym kwasu szikimowego, związanego z biosyntezą aromatycznych aminokwasów (fenyloalaniny, tyrozyny i tryptofanu). Glifosat wprowadziła na rynek firma Monsanto w 1974 roku, jako składnik herbicydu totalnego (nieselektywnego) Roundup; stosowany w postaci soli amonowej lub izopropyloamoniowej. W środkach ochrony roślin glifosat występuje zazwyczaj w postaci zmodyfikowanej (soli amonowej, sodowej i innych), środki ochrony roślin zawierają także substancje ułatwiające jego przenikanie przez błony komórkowe. Preparaty oparte na glifosacie powodują zamieranie większości roślin, przez co wprowadziły możliwość łatwego i taniego niszczenia chwastów, w tym wieloletnich, wcześniej bardzo trudnych do likwidacji. Zwalcza niemal wszystkie chwasty z wyjątkiem skrzypu. Stosowane są do zwalczania roślinności na torach kolejowych, likwidacji ugorów, odchwaszczania upraw sadowniczych, desykacji zbóż i rzepaku. Glifosat uzyskał szczególne znaczenie po opracowaniu roślin uprawnych modyfikowanych genetycznie, które zawierają gen kodujący syntazę EPSPS odporną na działanie glifosatu (pochodzi ona od bakterii). Umożliwia to opryski upraw tym środkiem w celu selektywnego niszczenia chwastów. Znane są jednakże rośliny, które wykształciły odporność na glifosat (dzięki powieleniu genów kodujących EPSPS lub zabezpieczeniu merystemu wierzchołkowego pędu).
6) Glifosat - jest to organiczny związek chemiczny z grupy fosfonianów. Jest aktywnym składnikiem niektórych nieselektywnych herbicydów. Hamuje działanie bardzo ważnego dla roślin enzymu, a mianowicie syntazy EPSPS (syntaza 5-enolopriogroniano-szikimowo-3-fosforanowa), który jest kluczowym enzymem na szlaku metabolicznym kwasu szikimowego, związanego z biosyntezą aromatycznych aminokwasów (fenyloalaniny, tyrozyny i tryptofanu). Glifosat wprowadziła na rynek firma Monsanto w 1974 roku, jako składnik herbicydu totalnego (nieselektywnego) Roundup; stosowany w postaci soli amonowej lub izopropyloamoniowej. W środkach ochrony roślin glifosat występuje zazwyczaj w postaci zmodyfikowanej (soli amonowej, sodowej i innych), środki ochrony roślin zawierają także substancje ułatwiające jego przenikanie przez błony komórkowe. Preparaty oparte na glifosacie powodują zamieranie większości roślin, przez co wprowadziły możliwość łatwego i taniego niszczenia chwastów, w tym wieloletnich, wcześniej bardzo trudnych do likwidacji. Zwalcza niemal wszystkie chwasty z wyjątkiem skrzypu. Stosowane są do zwalczania roślinności na torach kolejowych, likwidacji ugorów, odchwaszczania upraw sadowniczych, desykacji zbóż i rzepaku. Glifosat uzyskał szczególne znaczenie po opracowaniu roślin uprawnych modyfikowanych genetycznie, które zawierają gen kodujący syntazę EPSPS odporną na działanie glifosatu (pochodzi ona od bakterii). Umożliwia to opryski upraw tym środkiem w celu selektywnego niszczenia chwastów. Znane są jednakże rośliny, które wykształciły odporność na glifosat (dzięki powieleniu genów kodujących EPSPS lub zabezpieczeniu merystemu wierzchołkowego pędu). 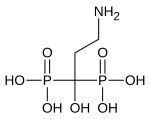 7) Kwas pamidronowy (łac. acidum pamidronicum) - organiczny związek chemiczny z grupy bisfosfonianów. W postaci soli disodowej, pamidronianu disodu (łac. dinatrii pamidronas), stosowany jest jako lek zmniejszający resorpcję kości przez hamowanie czynności oseoklasów (komórek kościogubnych). Efektem jego działania jest zmniejszenie poziomu wapnia we krwi (szczególnie istotne w leczeniu hiperkalcemii), zmniejszenie wydalania z moczem produktów resorpcji kości - hydroksyproliny, wapnia i fosforu. Lek podawany jest dożylnie, co zapewnia 100% biodostępność. W ok. 50% wiąże się z białkami, głównie albuminami. Ok. 20-55% dawki wydalane jest z moczem w postaci niezmienionej w ciągu 72 h, reszta łączy się z tkanką kostną. Podobnie jak inne bisfofoniany podawane dożylnie nie podlega przemianom metabolicznym.
7) Kwas pamidronowy (łac. acidum pamidronicum) - organiczny związek chemiczny z grupy bisfosfonianów. W postaci soli disodowej, pamidronianu disodu (łac. dinatrii pamidronas), stosowany jest jako lek zmniejszający resorpcję kości przez hamowanie czynności oseoklasów (komórek kościogubnych). Efektem jego działania jest zmniejszenie poziomu wapnia we krwi (szczególnie istotne w leczeniu hiperkalcemii), zmniejszenie wydalania z moczem produktów resorpcji kości - hydroksyproliny, wapnia i fosforu. Lek podawany jest dożylnie, co zapewnia 100% biodostępność. W ok. 50% wiąże się z białkami, głównie albuminami. Ok. 20-55% dawki wydalane jest z moczem w postaci niezmienionej w ciągu 72 h, reszta łączy się z tkanką kostną. Podobnie jak inne bisfofoniany podawane dożylnie nie podlega przemianom metabolicznym. 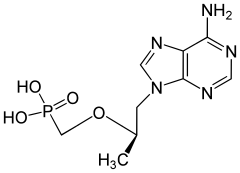
8) Tenofowir - jest to organiczny związek chemiczny z grupy fosfonianowych analogów nukleotydów sprzedawany przez Gilead Sciences pod nazwą handlową Viread. Należy on do klasy leków antyretrowirusowych i jest nukleotydowym inhibitorem odwrotnej transkryptazy, kluczowego enzymu wirusów HIV-1 i HBV. Ze względu na słabe wchłanianie stosowany jest w postaci proleku (dizoproksyl tenofowiru), w którym grupa fosforanowa jest dodatkowo zestryfikowana dwiema resztami izopropyloksykarbonyloksymetylowymi (iPrOC(=O)OCH2-). Po wniknięciu do komórki triester ten rozkłada się do aktywnego biologicznie tenofowiru. Postać farmaceutyczna proleku jest solą kwasu fumarowego. Dawkowany jest doustnie.
9) Kwas zoledronowy - fosfoorganiczny związek chemiczny z grupy bisfosfonianów. Jest on stosowany jako lek w terapii osteoporozy u kobiet po menopazuzie oraz u mężczyzn, u których występuje zwiększone ryzyko złamań kości. Jest także stosowany w celu zapobiegania powikłaniom kostnym u dorosłych pacjentów z zaawansowanym procesem nowotworowym z zajęciem kości.

KWASY HYDROKSAMOWE:
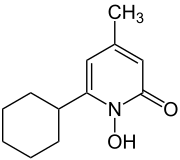 1) Cyklopiroks (łac. Ciclopiroxum) - jest to wielofunkcyjny organiczny związek chemiczny stosowany jako lek o działaniu przeciwzapalnym, przeciwgrzybicznym i przeciwbakteryjnym. Stosuje się go w postaci zawiesiny lub żelu, głównie na grzybice paznokci. Mechanizm jego działania jest słabo poznany. Hamuje on transport leucyny do wnętrza komórki, uszkadza błonę komórkową i doprowadza do utraty jonów potasu; hamuje kaskadę kwasu arachidonowego.
1) Cyklopiroks (łac. Ciclopiroxum) - jest to wielofunkcyjny organiczny związek chemiczny stosowany jako lek o działaniu przeciwzapalnym, przeciwgrzybicznym i przeciwbakteryjnym. Stosuje się go w postaci zawiesiny lub żelu, głównie na grzybice paznokci. Mechanizm jego działania jest słabo poznany. Hamuje on transport leucyny do wnętrza komórki, uszkadza błonę komórkową i doprowadza do utraty jonów potasu; hamuje kaskadę kwasu arachidonowego.  3) Kwas acetohydroksamowy - jest to organiczny związek chemiczny z grupy kwasów hydroksamowych. Jest on silnym i nieodwracalnym inhibitorem ureazy. Stosowany jest on jako lek przy zakażeniu dróg moczowych. Jego działanie polega na hamowaniu ureazy bakteryjnej, co zmniejsza stężenie amoniaku w moczu i zwiększa jego kwasowość. Jest on stosowany w profilaktyce powstawania kamieni nerkowych o etiologii ureazy bakteryjnej. Jest także stosowana jako środek wspomagający w leczeniu przewlekłego zakażenia dróg moczowych.
3) Kwas acetohydroksamowy - jest to organiczny związek chemiczny z grupy kwasów hydroksamowych. Jest on silnym i nieodwracalnym inhibitorem ureazy. Stosowany jest on jako lek przy zakażeniu dróg moczowych. Jego działanie polega na hamowaniu ureazy bakteryjnej, co zmniejsza stężenie amoniaku w moczu i zwiększa jego kwasowość. Jest on stosowany w profilaktyce powstawania kamieni nerkowych o etiologii ureazy bakteryjnej. Jest także stosowana jako środek wspomagający w leczeniu przewlekłego zakażenia dróg moczowych. 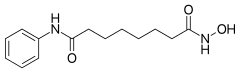 4) Kwas suberanilohydroksamowy (SAHA) - jest to organiczny związek chemiczny będący diamidem anilinowo-hydroksamowym kwasu suberynowego. Jest członkiem większej grupy inhibitorów deacetylazy histonowej. Inhibitory deacetylazy histonowej mają szerokie spektrum aktywności epigenetycznej. Vorinostat jest sprzedawany pod nazwą Zolinza w leczeniu chłoniaka skórnego T-komórkowego (CTCL, z ang. cutaneous T-cell lymphoma), gdy choroba nie ustępuje, nasila się, bądź następuje wznowa podczas lub po leczeniu innymi lekami. Związek został wyprodukowany po raz pierwszy przez Ronalda Breslowa, chemika z Columbia University. Vorinistat wiąże się z miejscem aktywnym deacetylazy histonowej i działa jako chelator dla obecnych tam jonów cynku. Działanie Vorinostatu poprzez blokowanie deacetylazy histonowej powoduje akumulację acetylowanych histonów i białek, włączając w to czynniki transkrypcyjne kluczowe w ekspresji genów niezbędnych do wywołania różnicowania komórki. Vorinostat był również stosowany do leczenia zespołu Sezary'ego - innego typu chłoniaka blisko związanego z chłoniakiem skórnym T-komórkowym.
4) Kwas suberanilohydroksamowy (SAHA) - jest to organiczny związek chemiczny będący diamidem anilinowo-hydroksamowym kwasu suberynowego. Jest członkiem większej grupy inhibitorów deacetylazy histonowej. Inhibitory deacetylazy histonowej mają szerokie spektrum aktywności epigenetycznej. Vorinostat jest sprzedawany pod nazwą Zolinza w leczeniu chłoniaka skórnego T-komórkowego (CTCL, z ang. cutaneous T-cell lymphoma), gdy choroba nie ustępuje, nasila się, bądź następuje wznowa podczas lub po leczeniu innymi lekami. Związek został wyprodukowany po raz pierwszy przez Ronalda Breslowa, chemika z Columbia University. Vorinistat wiąże się z miejscem aktywnym deacetylazy histonowej i działa jako chelator dla obecnych tam jonów cynku. Działanie Vorinostatu poprzez blokowanie deacetylazy histonowej powoduje akumulację acetylowanych histonów i białek, włączając w to czynniki transkrypcyjne kluczowe w ekspresji genów niezbędnych do wywołania różnicowania komórki. Vorinostat był również stosowany do leczenia zespołu Sezary'ego - innego typu chłoniaka blisko związanego z chłoniakiem skórnym T-komórkowym. 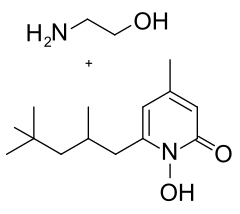 5) Pirokton olaminy - jest to mieszanina dwóch organicznych związków chemicznych, aminoetanolu i 1-hydroksy-4-metylo-6-(2,4,4-trimetylopentylo)pirydyn-2-onu. Wykazuje działanie przeciwzapalne i eliminujące patologiczną mikroflorę obecną w obrębie zmian łupieżowych; hamuje rozwój grzyba odpowiedzialnego za objawy łupieżu - Pityrosporum ovale (Malassezia furfur). Substancja czynna zwalczająca łupież, normalizuje i przywraca równowagę mikroflory naskórka, zapobiegając częstym nawrotom uciążliwych dolegliwości. Ze względu na szerokie i udkokumentowane spektrum działania stosowany jest w szamponach przeciwłupieżowych, a także w innych preparatach leczniczo-pielęgnacyjnych.
5) Pirokton olaminy - jest to mieszanina dwóch organicznych związków chemicznych, aminoetanolu i 1-hydroksy-4-metylo-6-(2,4,4-trimetylopentylo)pirydyn-2-onu. Wykazuje działanie przeciwzapalne i eliminujące patologiczną mikroflorę obecną w obrębie zmian łupieżowych; hamuje rozwój grzyba odpowiedzialnego za objawy łupieżu - Pityrosporum ovale (Malassezia furfur). Substancja czynna zwalczająca łupież, normalizuje i przywraca równowagę mikroflory naskórka, zapobiegając częstym nawrotom uciążliwych dolegliwości. Ze względu na szerokie i udkokumentowane spektrum działania stosowany jest w szamponach przeciwłupieżowych, a także w innych preparatach leczniczo-pielęgnacyjnych.  6) Trichostatyna A (TSA) - jest to związek organiczny z grupy kwasów hydroksamowych. W komórkach żywych trichostatyna A hamuje działanie deacetylazy histonowej (HDAC). Hamuje cykl komórkowy komórek eukariotycznych w początkowej fazie. Jest to antybiotyk antygrzybowy o działaniu cytostatycznym i proróżnicującym w stosunku do komórek ssaczych.
6) Trichostatyna A (TSA) - jest to związek organiczny z grupy kwasów hydroksamowych. W komórkach żywych trichostatyna A hamuje działanie deacetylazy histonowej (HDAC). Hamuje cykl komórkowy komórek eukariotycznych w początkowej fazie. Jest to antybiotyk antygrzybowy o działaniu cytostatycznym i proróżnicującym w stosunku do komórek ssaczych. KWASY ŻÓŁCIOWE:
Kwasy żółciowe to organiczne kwasy, syntetyzowane w wątrobie, będące końcowymi produktami degradacji (rozkładu) endogennego (wewnątrzustrojowego) cholesterolu. W żółci występują głównie następująca pochodne kwasu cholanowego: kwas cholowy, kwas deoksycholowy, kwas chenodeoksycholowy, kwas litocholowy. Wśród związków steroidowych są one najlepiej rozpuszczalne w wodzie ze względu na obecność kilku hydrofilowych grup -OH oraz polarnej grupy karboksylowej. Ułatwiają rozpuszczanie się zawartego w żółci cholesterolu. Kwasy żółciowe są substancjami powierzchniowo czynnymi, mają zdolność zmniejszania napięcia powierzchniowego roztworów, a dzięki temu emulgowania tłuszczów i tworzenia szerokiej powierzchni dla rozwinięcia działalności lipazy trzustkowej - enzymu odpowiedzialnego za trawienie tłuszczów wjelicie (ponadto aktywują one ten enzym). Żółciany (czyli sole kwasów żółciowych) wywierają działanie hydrotropowe - pod ich wpływem ciała nierozpuszczalne w wodzie (np. kwasy tłuszczowe) łatwo rozpuszczają się w zawartości jelita. Kwasy żółciowe wytwarzają z kwasami tłuszczowymi połączenia kompleksowe zwane kwasami choleinowymi, które są rozpuszczalne i łatwo wchłaniają się w jelicie.
 1) Kwas chenodeoksycholowy (łac. Acidum chenodeoxycholicum) - jest to organiczny związek chemiczny, pierwotny kwas żółciowy syntetyzowany z cholesterolu przez komórki wątrobowe, stosowany również jako lek. W połączeniu z glicyną lub tauryną tworzy sole żółciowe i w tej postaci zostaje wydzielany do dróg żółciowych, a następnie do pęcherzyka żółciowego (gdzie wchodzi w skład żółci) i stąd do jelita cienkiego, gdzie bierze udział w trawieniu tłuszczów.
1) Kwas chenodeoksycholowy (łac. Acidum chenodeoxycholicum) - jest to organiczny związek chemiczny, pierwotny kwas żółciowy syntetyzowany z cholesterolu przez komórki wątrobowe, stosowany również jako lek. W połączeniu z glicyną lub tauryną tworzy sole żółciowe i w tej postaci zostaje wydzielany do dróg żółciowych, a następnie do pęcherzyka żółciowego (gdzie wchodzi w skład żółci) i stąd do jelita cienkiego, gdzie bierze udział w trawieniu tłuszczów.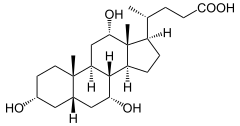
2) Kwas cholowy - jest to organiczny związek chemiczny z grupy steroidów. Pełni ważną rolę jako jeden z kwasów żółciowych. Cząsteczka kwasu cholowego zawiera trzy grupy hydroksylowe i jedną grupę karboksylową. Sole kwasu cholowego nazywają się cholanami. Krystalizuje się go w postaci płytek o gorzkim smaku. Jest stosowany do produkcji leków.
 3) Kwas ursodeoksycholowy - jest to organiczny związek chemiczny, naturalny kwas żółciowy, występujący w niewielkich ilościach w ludzkiej żółci. Znajduje on zastosowanie głównie w terapii kamicy żółciowej. Powoduje on zwiększenie wydzielania żółci oraz zmniejszenie wchłaniania i wytwarzania cholesterolu (zmniejsza jego procentową zawartość w żółci). W ten sposób zapobiega tworzeniu się nowych kamieni żółciowych (a także powoduje rozpuszczanie już istniejących).
3) Kwas ursodeoksycholowy - jest to organiczny związek chemiczny, naturalny kwas żółciowy, występujący w niewielkich ilościach w ludzkiej żółci. Znajduje on zastosowanie głównie w terapii kamicy żółciowej. Powoduje on zwiększenie wydzielania żółci oraz zmniejszenie wchłaniania i wytwarzania cholesterolu (zmniejsza jego procentową zawartość w żółci). W ten sposób zapobiega tworzeniu się nowych kamieni żółciowych (a także powoduje rozpuszczanie już istniejących).KWASY SIARKOORGANICZNE - SULFONOWE:
1) Kwas alkilobenzenosulfonowy (kwas ABS) - jest to siarkoorganiczny związek chemiczny, pochodna kwasu benzenosulfonowego zawierająca grupę alkilową przyłączoną do pierścienia benzenowego. W przemyśle nazwą kwas ABS określa się mieszaninę różnych kwasów alkilobenzenosulfonowych wykorzystywaną do otrzymywania alkilobenzenosulfonanu sodu, detergentu stosowanego w szamponach i innych środkach czystości. Kwas ABS otrzymuje się w procesie sulfonowania alkilobenzenów. Produkt przemysłowy ma postać żółtobrązowej, gęstej cieczy.
2) Kwas Tobiasa - jest to organiczny związek chemiczny z grupy kwasów nartyloaminosulfonowych. Stosowany jest jako substrat w reakcjach diazowania, m.in. do otrzymywania barwników azowych (np. czerwieni lakowej).
3) Kwas benzenosulfonowy - jest to kwas organiczny, który tworzy białe kryształy dobrze rozpuszczalne w wodzie i etanolu. Otrzymywany jest w wyniku sulfonowania benzenu stężonym kwasem siarkowym w temperaturze 170-180 stopni Celsjusza.


4) Kwas sulfanilowy (kwas p-aminobenzenosulfonowy) - jest to aromatyczny, organiczny związek chemiczny zawierający podstawnik aminowy i sulfonowy w konfiguracji para (p-aminowa pochodna kwasu benzenosulfonowego). Jest to stała substancja, tworząca kryształy jako dihydrat, ogrzana powyżej temperatury 288 stopni Celsjusza ulegająca stopeniu połączonemu z rozkładem. Jest słabo rozpuszczalna w wodzie, dobrze w zasadach. Z kwasami nie tworzy soli amoniowych z powodu występowania w formie jonu obojnaczego. Otrzymuje się ją poprzez sulfonowanie aniliny kwasem siarkowym w temperaturze 200 stopni Celsjusza. Stosowany jest do otrzymywania barwników diazowych. Pochodne amidowe kwasu sulfanilowego to sulfonamidy, stosowane jako środki bakteriostatyczne.
 |
| Źródło: e-biotechnologia.pl. Reakcja sulfonowania aniliny. |
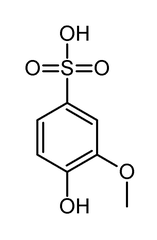 5) Sulfogwajakol (łac. sulfoguaiacolum) - jest to organiczny związek chemiczny z grupy kwasów sulfonowych, lek wykrztuśny działający bezpośrednio na gruczoły oskrzelowe, tzn. po podaniu doustnym wydziela się przez gruczoły oskrzelowe, drażni ich błonę śluzową i pobudza je do zwiększenia wydzielania płynnego śluzu. Odpowiednie ułożenie chorego, oklepywanie klatki piersowej, aplikacja leku, ułatwiają wykrztuszanie w znacznym stopniu.
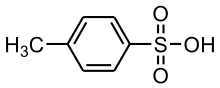
5) Sulfogwajakol (łac. sulfoguaiacolum) - jest to organiczny związek chemiczny z grupy kwasów sulfonowych, lek wykrztuśny działający bezpośrednio na gruczoły oskrzelowe, tzn. po podaniu doustnym wydziela się przez gruczoły oskrzelowe, drażni ich błonę śluzową i pobudza je do zwiększenia wydzielania płynnego śluzu. Odpowiednie ułożenie chorego, oklepywanie klatki piersowej, aplikacja leku, ułatwiają wykrztuszanie w znacznym stopniu. 6) Kwas p-toluenosulfonowy (kwas tosylowy) - jest to mocny kwas o mocy porównywalnej z kwasem siarkowym. Jest on otrzymywany w wyniku sulfonowania toluenu stężonym kwasem siarkowym lub kwasem chlorosulfonowym (w tym przypadku powstaje głównie chlorek tosylu). Jest to kwas bardzo dobrze rozpuszczalny w wodzie. Krystalizuje się go jako monohydrat. Z zasadami tworzy on sole, np. p-toluenosulfonian sodu. Jest stosowany jako katalizator kwasowy rozpuszczalny w rozpuszczalnikach organicznych, np. w reakcjach estryfikacji lub do eliminacji grupy hydroksylowej.
6) Kwas p-toluenosulfonowy (kwas tosylowy) - jest to mocny kwas o mocy porównywalnej z kwasem siarkowym. Jest on otrzymywany w wyniku sulfonowania toluenu stężonym kwasem siarkowym lub kwasem chlorosulfonowym (w tym przypadku powstaje głównie chlorek tosylu). Jest to kwas bardzo dobrze rozpuszczalny w wodzie. Krystalizuje się go jako monohydrat. Z zasadami tworzy on sole, np. p-toluenosulfonian sodu. Jest stosowany jako katalizator kwasowy rozpuszczalny w rozpuszczalnikach organicznych, np. w reakcjach estryfikacji lub do eliminacji grupy hydroksylowej. 7) Kwas trifluorometanosulfonowy (kwas triflowy) - jest to kwas o bardzo dużej mocy, zaliczany do superkwasów. Jego moc jest ok. 100 razy większa od mocy 100% kwasu siarkowego. Po raz pierwszy został uzyskany w 1954 roku przez Haszeldine'a i Kidda w wyniku utleniania perhhydrolem bis(trifluorometylotio)rtęci, (CF3S)2Hg. Otrzymany surowy produkt wytrącono w postaci soli barowej, z której odzyskano wolny kwas triflowy działaniem stężonego kwasu siarkowego i stosując destylację pod zmniejszonym ciśnieniem. Wyjściowy związek rtęcioorganiczny uzyskano naświetlając ultrafioletem mieszaninę disarczku bis(trifluorometylu) i rtęci.
7) Kwas trifluorometanosulfonowy (kwas triflowy) - jest to kwas o bardzo dużej mocy, zaliczany do superkwasów. Jego moc jest ok. 100 razy większa od mocy 100% kwasu siarkowego. Po raz pierwszy został uzyskany w 1954 roku przez Haszeldine'a i Kidda w wyniku utleniania perhhydrolem bis(trifluorometylotio)rtęci, (CF3S)2Hg. Otrzymany surowy produkt wytrącono w postaci soli barowej, z której odzyskano wolny kwas triflowy działaniem stężonego kwasu siarkowego i stosując destylację pod zmniejszonym ciśnieniem. Wyjściowy związek rtęcioorganiczny uzyskano naświetlając ultrafioletem mieszaninę disarczku bis(trifluorometylu) i rtęci.


Brak komentarzy:
Prześlij komentarz