KWASY KARBOKSYLOWE - są to organiczne związki chemiczne, które zawierają grupę karboksylową. Atom wodoru w grupie karboksylowej może się łatwo odszczepiać w formie jonu wodorowego, co zgodnie z teorią Arrheniusa nadaje tym związkom charakter kwasowy:
- RCOOH + H2O ⇄ RCOO– + H3O+
Kwasy karboksylowe tworzą chętnie wiązania wodorowe z grupą aminową, hydroksylową i innymi. Kwasy karboksylowe z krótkimi grupami alkilowymi są dobrze rozpuszczającymi się w wodzie cieczami o ostrym, nieprzyjemnym zapachu i toksycznych własnościach. Wraz ze wzrostem długości grupy alkilowej wzrasta temperatura topnienia tych kwasów (prawidłowość tę widać dla kwasów wyższych niż kwas heksanowy). Kwasy karboksylowe zawierające poniżej 10 atomów węgla są cieczami w temperaturze pokojowej, a zawierające więcej niż 10 atomów węgla, ciałami stałymi. Kwasy monokarboksylowe zawierające 4-28 atomów węgla o prostym łańcuchu noszą nazwę kwasów tłuszczowych (czasem pojęcie kwasów tłuszczowych rozszerza się na wszystkie alifatyczne niecykliczne kwasy karboksylowe).
KWASY JEDNOKARBOKSYLOWE:

1) Kwas mrówkowy - jest to organiczny związek chemiczny i najprostszy kwas karboksylowy. Sole oraz estry kwasu mrówkowego to mrówczany. Występuje on m.in. we włoskach parzących pokrzyw oraz w jadzie mrówek.
Metody otrzymywania:
I. Synteza z CO i NaOH: Najstarszą metodą przemysłową jest reakcja tlenku węgla z wodorotlenkiem sodu. Proces ten prowadzi się w podwyższonej temperaturze oraz ciśnieniu, np. 180 stopni Celsjusza i 15-18 atm: NaOH + CO -> HCOONa .
Powstający w tym etapie mrówczan sodu krystalizuje i jest przeprowadzany w kwas mrówkowy poprzez zakwaszenie mieszaniny poreakcyjnej stężonym kwasem siarkowym: 2HCOONa + H
2SO
4 → 2HCOOH + Na
2SO
4
II. Synteza z CO i MeOH: jest to dominująca obecnie metoda produkcji kwasu mrókowego z metanolu i CO rozpoczyna się ona od otrzymania z tych substratów mrówczanu metylu w obecności silnych zasad, np. metanolanu sodu lub metanolanu potasu. Reakcję prowadzi się typowo w fazie ciekłej, w temperaturze 80 stopni Celsjusza, pod ciśnieniem 40-45 atm, choć w Związku Sowieckim opracowano proces przebiegający pod ciśnieniem 8 atm: CH
3OH + CO → HCOOCH
3.
W drugim etapie otrzymany ester poddaje się hydrolizie katalizowanej kwasami: HCOOCH
3 + H
2O ⇄ HCOOH + CH
3OHProces ten jest trudny ze względu na odwracalność reakcji i odtwarzanie estru podczas przerobu. Do czasu opracowania wydajnych technologii izolowania kwasu mrówkowego w 2 połowie XX w., mrówczan metylu przetwarzano na formamid i dopiero ten produkt hydrolizowano za pomocą np. ok 70% kwasu siarkowego:
- HCOOCH
3 + NH
3 → HCONH
2 + CH
3OH - 2HCONH
2 + H
2SO
4 + 2H
2O → 2HCOOH + (NH
4)
2SO
4 - Utlenianie węglowodorów: W zależności od technologii produkcji i substratów, na tonę kwasu octowego otrzymywanego w wyniku utleniania węglowodorów powstaje 50-250 kg kwasu mrókowego. Pordukty utlenienia rozdzielane są za pomocą destylacji azeotropowej w mieszaninie z benzenem lub chlorowanymi węglowodorami.
- Inne metody: Jest możliwa teoretycznie bezpośrednia synteza z wody i tlenku węgla
- C
2H
2(COOH)
2 + H
2 → C
2H
4(COOH)
2 - Kwas bursztynowy jest stosowany głównie do produkcji pochodnych (bezwodnik bursztynowy, imid kwasu bursztynowego, NBS). W przemyśle spożywczym jako regulator kwasowości i wzmacniacz smaku (jako dodatek żywności E363).
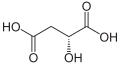 4) Kwas jabłkowy (kwas hydroksybursztynowy, łac. Acidum malicum) - jest to hydroksykwas dikarboksylowy występujący m.in. w jabkach i rabarbarze. Jest produktem ubocznym emtabolizmu węglowodanów. Jego forma zjonizowana (jabłczan) występuje jako produkt pośredni w cyklu kwasu cytrynowego (cyklu Krebsa). Zawiera on jedno centrum stereogeniczne i jego cząsteczka jest chiralna. naturalnie występuje enacjomer o konfiguracji L (konfiguracja absolutna S), wykazujący skręcalność właściwą. Syntetyczny kwas jabłkowy jest racematem. Podczas ogrzewania bez dostępu powietrza ulega dehydratacji do mieszaniny kwasu fumarowego i kwasu maleinowego. Stosuje się go w przemyśle spożywczym jako konserwant oraz w przemyśle farmaceutycznym.
4) Kwas jabłkowy (kwas hydroksybursztynowy, łac. Acidum malicum) - jest to hydroksykwas dikarboksylowy występujący m.in. w jabkach i rabarbarze. Jest produktem ubocznym emtabolizmu węglowodanów. Jego forma zjonizowana (jabłczan) występuje jako produkt pośredni w cyklu kwasu cytrynowego (cyklu Krebsa). Zawiera on jedno centrum stereogeniczne i jego cząsteczka jest chiralna. naturalnie występuje enacjomer o konfiguracji L (konfiguracja absolutna S), wykazujący skręcalność właściwą. Syntetyczny kwas jabłkowy jest racematem. Podczas ogrzewania bez dostępu powietrza ulega dehydratacji do mieszaniny kwasu fumarowego i kwasu maleinowego. Stosuje się go w przemyśle spożywczym jako konserwant oraz w przemyśle farmaceutycznym. - 5) Kwas winowy (łac. acidum tartaricum) - jest to hydroksykwas dikarboksylowy zawierający dwie grupy hydroksylowe (-OH). Występuje on w owocach (zwykle jako enacjomer D), zwłaszcza winogronach w stanie wolnym i w postaci soli.
- XIX-wiecznych chemików zastanawiało występowanie kwasu winowego w dwóch formach, z których naturalna skręcała płaszczyznę światła w prawo, a druga była optycznie nieczynna. Ludwik Pasteur zdołał za pomocą pęsety i szkła powiększającego rozdzielić enacjomorficzne kryształy L- i D-winianu amonowo-sodowego, udowadniając, że kwas gronowy to mieszanina dwóch odmian kwasu winowego.
- Kwas winowy posiada trzy izomery optyczne: dwa enacjomery (+)-(R,R) (-)-(S,S) i formę mezo (R,S). Odmiana (+)-(R,R) skręca płaszczyznę światła spolaryzowanego w prawo (-)-(S,S) w lewo, odmiana mezo, zwana również kwasem antywinowym, jest nieaktywna optycznie. Nieczynna optycznie jest także równomolowa mieszanina odmian (+)-(R,R) i (-)-(S,S), czyli racemat, zwany również kwasem gronowym, posiadająca właściwości inne aniżeli odmiana mezo (formy optycznie czynne są diastereoizomerami formy mezo). Podczas ogrzewania, ok. 165 stopni Celsjusza odmiany (+)-(R,R) i (-)-(S,S) przechodzą w odmianę mezo, a w około 175 stopniach Celsjusza tworzy się racemat.

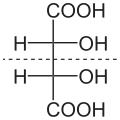 kwas (+)-winowy
kwas (+)-winowy
konfiguracja R,R, czyli L
(naturalny)kwas (–)-winowy
konfiguracja S,S, czyli Dkwas mezo-winowy
konfiguracja R,S- ZASTOSOWANIE KWASU WINOWEGO: Kwas winowy wyizolowano po raz pierwszy z wodorowinianu potasu COOK−(CHOH)2COOH (kwaśnego winianu potasu, tzw.
- winnego kamienia), który osadza się w kadziach i beczkach przy fermentacji wina. Kwas winowy i
- jego sole są stosowane jako dodatki do żywnosci regulujące kwasowość. Ich oznaczenia według norm
- Unii Europejskiej: kwas winowy to E334, winian sodu E335, winian potasu E336, winian sodowo-
- potasowy (tzw. sól Signette'a) E337. Kwas winowy i jego sole wykorzystuje się też przy produkcji serów
- topionych (ser topiony to produkt pochodny sera, wytworzony przez topienie go z dodatkiem topników.
- Jako topniki używane są: kwas cytrynowy, kwas winowy, kwas mlekowy i ich sole. Ser przetapiany jest
- obecnie w temperaturach 90-99 stopni Celsjusza). Winian antymonylu-potasu (COOK−(CHOH)
H2O + CO ⇄ HCOOH, jednakże dla przesunięcia równowagi w kierunku produktu wymagana jest
bardzo wysoka temperatura i ciśnienie, i do czasu opracowania wydajnych katalizatorów proces
ten jest nieopłacalny z ekonomicznego punktu widzenia. Kwas mrówkowy charakteryzuje
duża lotność, ciśnienie par 4,2 kPa (20 stopni Celsjusza), jest to związek żrący i powodujący korozję.
Ze względu na obecność atomu wodoru przy węglu karbonylowym (ugrupowanie aldehydowe) wykazuje
właściwości redukujące (czym wyróżnia się spośród innych prostych kwasów karboksylowych). Np. z
roztworu azotanu srebra podgrzewanego z kwasem mrówkowym wydziela się metaliczne srebro; redukcji
ulegają też jony rtęci, złota, platyny oraz niektóre związki organiczne, np. iminy. Kwas mrówkowy hamuje
aktywnosć enzymów, zwłaszcza katalaz. Optimum skuteczności działania przypada na zakres pH 3-4 i niżej.
Przy pH 6,0 zawiera zaledwie 0,56% czynnej, niezdysocjowanej formy kwasu mrówkowego.
Kwas mrówkowy ze względu na swoje właściwości grzybobójcze często wykorzystywany jest jako składnik
preparaatów grzybobójczych i zakwaszających. Często występuje w mieszaninach z innymi kwasami bądź
naniesiony na nośnik. Ma szerokie zastosowanie w syntezie organicznej. W pszczelarstwie jest stosowany do
zwalczania roztocza Varroa destructor. Kwas mrówkowy jest stosowany również jako konserwant o silnych
właściwościach grzybobócjzych, przy wysokich stężeniach i niskim zakresie pH zakres jego działanie
- obejmuje również bakterie.
 2) Kwas octowy (CH3COOH) - kwas octowy jest otrzymywany przemysłowo przez karbonylowanie metanolu (proces Monsanto, Acetica i inne), bezpośrednie utlenianie butanu lub niskooktanowych benzyn oraz utlenianie aldehydu octowego (otrzymywanego z acetylenu). Fermentacja octowa etanolu otrzymywanego z fermentacji alkoholowej cukrów jest źródłem spożywczego kwasu octowego (ocet, vinegar). Kwas octowy jest także produktem ubocznym suchej destylacji drewna. Izoluje się go z destylatu przez wytrącenie wapnem octanu wapnia (tzw. "szare wapno"), który następnie poddaje się reakcji z kwasem siarkowym i oddestylowuje kwas octowy.
2) Kwas octowy (CH3COOH) - kwas octowy jest otrzymywany przemysłowo przez karbonylowanie metanolu (proces Monsanto, Acetica i inne), bezpośrednie utlenianie butanu lub niskooktanowych benzyn oraz utlenianie aldehydu octowego (otrzymywanego z acetylenu). Fermentacja octowa etanolu otrzymywanego z fermentacji alkoholowej cukrów jest źródłem spożywczego kwasu octowego (ocet, vinegar). Kwas octowy jest także produktem ubocznym suchej destylacji drewna. Izoluje się go z destylatu przez wytrącenie wapnem octanu wapnia (tzw. "szare wapno"), który następnie poddaje się reakcji z kwasem siarkowym i oddestylowuje kwas octowy.
- Właściwości kwasu octowego: czysty kwas octowy jest bezbarwną, żrącą cieczą; jest mieszalny z wodą, a przy mieszaniu ulega kontrakcji objętości (zjawisku fizycznemu polegającemu na zmienie objętości roztworu lub mieszaniny wskutek reakcji chemicznej lub oddziaływań międzycząsteczkowych pomiędzy składnikami mieszaniny); 100% kwas octowy jest bardzo hugroskopijny i pochłania wilgoć z powietrza, zaś proces rozpuszczania się w nim wody ma charakter silnie endotermiczny. Powoduje to, że po otwarciu butelki z takim kwasem w wilgotnym pomieszczeniu zaczyna on pochłaniać wilgoć z powietrza, co skutkuje jego zauważalnym ochłodzeniem i szronieniem się ścianek butelki. W skrajnych przypadkach, jeśli w pomieszczeniu jest bardzo wilgotno, a otwór butelki jest szeroki, czysty kwas octowy może zestalić się po otwarciu. Ze względu na tworzenie kryształów w temp. poniżej 16 stopni Celsjusza, które wyglądem przypominają lód, czysty kwas octowy nazywany jest kwasem octowym lodowatym. Kwas o stężeniu 70-80% nosi nazwę esencji octowej. Stosunkowo wysoka temperatura wrzenia, a także efekty endotermiczne przy rozcieńczaniu wynikają z silnych wiązań wodorowych występujących między cząsteczkami kwasu. Wiązania wodorowe tworzone przez kwas octowy są na tyle silne, że obserwowano ich występowanie także w fazie gazowej. Jak każdy niższy kwas karboksylowy, kwas octowy ulega dysocjacji i dobrze przewodzi prąd elektryczny, jednak jest on kwasem słabym. Spala się niebieskim płomieniem. Kwas octowy powstaje m.in. w wyniku utleniania etanolu lub aldehydu octowego, a także podczas reakcji (np. hydrolizy) estrów kwasu octowego, bezwodnika octowego lub chlorku acetylu. Z metalami tworzy sole, a z alkoholami i fenolami - estry; obie te grypu związków nazywane są octanami.
- Historia kwasu octowego: Kwas octowy znany był ludzkości od zamierzchłych czasów pod postacią octu. Jako pierwszy substancję tę wyizolował z octu arabski alchemik Dżabir Ibn Hajjan. Produkcję czystego związku rozpoczęto jednak dopiero po roku 1700, kiedy to niemiecki chemik Georg Ernst Stahl dokonał destylacji kwasu octowego z octu.
 3) Kwas propionowy (kwas propanowy) - występuje on w mleku i jest wytwarzany w przewodzie pokarmowym zwierząt. Jest jednym z nasyconych kwasów karboksylowych. W temperaturze pokojowej jest to bezbarwna ciecz rozpuszczalna w wodzie o nieprzyjemnym ostrym zapachu. Stosowany jest przy wyrobie rozcieńczalników oraz substancji zapachowych. Kwas propionowy jest palny, a jego pary tworzą z powietrzem mieszaniny wybuchowe. Jest stosowany w przemyśle spożywczym jako środek do konserwacji żywności o symbolu E280. Dodawany jest on do chleba paczkowanego krojonego i chleba żytniego oraz do wyrobów ciastkarskich. Maksymalna dawka to 3000 mg/kg. Dodawany jest on również do pasz zwierzęcych jako środek przeciwpleśniowy. Bakterie propionowe należące do rodzaju Propionibacterium wytwarzają kwas propionowy w fermentacji propionowej i mają zdolność rozkładu cukrów, błonnika i pektyn. Guma guar oraz pektyny są znacznie szybciej metabolizowane przez bakterie jelita grubego. Wytwarzany w tym procesie kwas propionowy i kwas masłowy, korzystnie oddziałuje na organizm człowieka. Kwas propionowy sprzyja hamowaniu syntezy cholesterolu, a kwas masłowy może być stymulatorem jelitowego systemu odpornościowego. Kwas propionowy jest wchłaniany do organizmu człowieka przez drogi oddechowe, skórę i przewód pokarmowy. Wdychane pary kwasu drażną śluzówkę jamy ustnej, oczu, nosa, górnych dróg oddechowych. Działanie kwasu propionowego może spowodować łzawienie , niezyt nosa, kaszel, bóle w klatce piersowej, nieżyt nżółądka,. Kwas propionowy w kontakcie ze skórą powoduje oparzenia. Oparzenia oczu mogą doprowadzić z kolei do nieodwracalnej utraty wzroku.
3) Kwas propionowy (kwas propanowy) - występuje on w mleku i jest wytwarzany w przewodzie pokarmowym zwierząt. Jest jednym z nasyconych kwasów karboksylowych. W temperaturze pokojowej jest to bezbarwna ciecz rozpuszczalna w wodzie o nieprzyjemnym ostrym zapachu. Stosowany jest przy wyrobie rozcieńczalników oraz substancji zapachowych. Kwas propionowy jest palny, a jego pary tworzą z powietrzem mieszaniny wybuchowe. Jest stosowany w przemyśle spożywczym jako środek do konserwacji żywności o symbolu E280. Dodawany jest on do chleba paczkowanego krojonego i chleba żytniego oraz do wyrobów ciastkarskich. Maksymalna dawka to 3000 mg/kg. Dodawany jest on również do pasz zwierzęcych jako środek przeciwpleśniowy. Bakterie propionowe należące do rodzaju Propionibacterium wytwarzają kwas propionowy w fermentacji propionowej i mają zdolność rozkładu cukrów, błonnika i pektyn. Guma guar oraz pektyny są znacznie szybciej metabolizowane przez bakterie jelita grubego. Wytwarzany w tym procesie kwas propionowy i kwas masłowy, korzystnie oddziałuje na organizm człowieka. Kwas propionowy sprzyja hamowaniu syntezy cholesterolu, a kwas masłowy może być stymulatorem jelitowego systemu odpornościowego. Kwas propionowy jest wchłaniany do organizmu człowieka przez drogi oddechowe, skórę i przewód pokarmowy. Wdychane pary kwasu drażną śluzówkę jamy ustnej, oczu, nosa, górnych dróg oddechowych. Działanie kwasu propionowego może spowodować łzawienie , niezyt nosa, kaszel, bóle w klatce piersowej, nieżyt nżółądka,. Kwas propionowy w kontakcie ze skórą powoduje oparzenia. Oparzenia oczu mogą doprowadzić z kolei do nieodwracalnej utraty wzroku.
 4) Kwas masłowy (kwas butanowy) - jest to organiczny związek chemiczny z grupy kwasów karboksylowych. Występuje on w zjełczałym maśle, nadaje lekko gorzki posmak wielu serom. Jego sole i estry to maślany. Kwas masłowy produkuje się najczęściej w tzw. masłowej fermentacji skrobi, w której do wodnego roztworu skrobi dodaje się bakterii normalnie stosowanych do fermentacji serów (Bacillis subtilis). W laboratorium można go również otrzymać poprzez przepuszczanie tlenku węgla (CO) przez mieszaninę octanu sodu (CH3COONa) i etanolanu sodu (CH3CH2ONa) w temperaturze 205 stopni Celsjusza. W wielu procesach przemysłowych kwas masłowy powstaje jako produkt uboczny, który najczęściej wyodrębnia się poprzez strącanie go wodorotlenkiem wapnia - Ca(OH)2, gdyż sól wapniowa kwasu masłowego jest nierozpuszczalna w wodzie. W mniejszych stężeniach (10-100 ppm) nadaje on potrawom lekko gorzki smak z zauważalną słodką nutą. W nieco większych stężeniach jego zapach kojarzy się wielu ludziom z wymiocinami, ze względu na to, że to właśnie owy związek nadaje charakterystyczny zapach wymiocinom małych dzieci, które są nadmiernie karmione mlekiem. W większych stężeniach ma ostry, intensywny, trudny do zniesienia zapach zjełczałego tłuszczu. Likwidację zapachu przyspiesza wietrzenie i ozonowanie. Kwas masłowy ma zastosowanie w produkcji środków zapachowych, barwników oraz leków. Estry kwasu masłowego często mają zapach przyjemny dla ludzi i są stosowane w przemyśle spożywczym do produkcji sencji owocowych. Na przykład maślan butylu ma zapach ananasa. Badania fizjologii przewodu pokarmowego wykazały, że kwas masłowy ma podstawowe znaczenie jako substrat używany przez komórki nabłonka jelitowego do produkcji energii. Ilość kwasu masłowego dostarczanego w pożywieniu (sery twarde, mleko i jego przetwory, kiszonki - ogórki, kapusta) nie ma praktycznie znaczenia, ponieważ jest zużywana zanim dotrze do jelita cienkiego. W jelicie głównym kwas masłowy produkowany jest przez bakterie fermentujące niestrawione węglowodany i oligomery heksozy. Znaczenie fizjologiczne działania kwasu masłowego polega na oddziaływaniu na ścianę jelit, florę bakteryjną jelit, narządy i tkanki poza przewodem pokarmowym, po wchłonięciu go do krwi. Te działania sprzyjają utrzymaniu prawidłowej struktury i funkcji jelit oraz zachowaniu integralności nabłonka jelitowego.
4) Kwas masłowy (kwas butanowy) - jest to organiczny związek chemiczny z grupy kwasów karboksylowych. Występuje on w zjełczałym maśle, nadaje lekko gorzki posmak wielu serom. Jego sole i estry to maślany. Kwas masłowy produkuje się najczęściej w tzw. masłowej fermentacji skrobi, w której do wodnego roztworu skrobi dodaje się bakterii normalnie stosowanych do fermentacji serów (Bacillis subtilis). W laboratorium można go również otrzymać poprzez przepuszczanie tlenku węgla (CO) przez mieszaninę octanu sodu (CH3COONa) i etanolanu sodu (CH3CH2ONa) w temperaturze 205 stopni Celsjusza. W wielu procesach przemysłowych kwas masłowy powstaje jako produkt uboczny, który najczęściej wyodrębnia się poprzez strącanie go wodorotlenkiem wapnia - Ca(OH)2, gdyż sól wapniowa kwasu masłowego jest nierozpuszczalna w wodzie. W mniejszych stężeniach (10-100 ppm) nadaje on potrawom lekko gorzki smak z zauważalną słodką nutą. W nieco większych stężeniach jego zapach kojarzy się wielu ludziom z wymiocinami, ze względu na to, że to właśnie owy związek nadaje charakterystyczny zapach wymiocinom małych dzieci, które są nadmiernie karmione mlekiem. W większych stężeniach ma ostry, intensywny, trudny do zniesienia zapach zjełczałego tłuszczu. Likwidację zapachu przyspiesza wietrzenie i ozonowanie. Kwas masłowy ma zastosowanie w produkcji środków zapachowych, barwników oraz leków. Estry kwasu masłowego często mają zapach przyjemny dla ludzi i są stosowane w przemyśle spożywczym do produkcji sencji owocowych. Na przykład maślan butylu ma zapach ananasa. Badania fizjologii przewodu pokarmowego wykazały, że kwas masłowy ma podstawowe znaczenie jako substrat używany przez komórki nabłonka jelitowego do produkcji energii. Ilość kwasu masłowego dostarczanego w pożywieniu (sery twarde, mleko i jego przetwory, kiszonki - ogórki, kapusta) nie ma praktycznie znaczenia, ponieważ jest zużywana zanim dotrze do jelita cienkiego. W jelicie głównym kwas masłowy produkowany jest przez bakterie fermentujące niestrawione węglowodany i oligomery heksozy. Znaczenie fizjologiczne działania kwasu masłowego polega na oddziaływaniu na ścianę jelit, florę bakteryjną jelit, narządy i tkanki poza przewodem pokarmowym, po wchłonięciu go do krwi. Te działania sprzyjają utrzymaniu prawidłowej struktury i funkcji jelit oraz zachowaniu integralności nabłonka jelitowego.
 5) Kwas walerianowy - jest to organiczny związek chemiczny z grupy alifatycznych kwasów karboksylowych. Występuje on w korzeniach niektórych roślin, na przykład arcydzięgla i kozłka lekarskiego. Charakteryzuje się on specyficznym zapachem, przez jednych odbieranym jako przykry, przez innych zaś jako słodki i miodowy. Uważany jest za afrodyzjak dla kotów. Kwas walerianowy w temperaturze pokojowej ejst oleistą, bezbarwną cieczą. Łatwo rozpuszcza się w wodzie i większości organicznych rozpuszczalników polarnych, m.in. acetonie, etanolu, eterze. Używany jest głównie do otrzymywania estrów. Estry kwasu walerianowego, czyli walerianiany, mają przyjemny zapach, w związku z czym stosuje się je w przemyśle perfumeryjnym i kosmetycznym.
5) Kwas walerianowy - jest to organiczny związek chemiczny z grupy alifatycznych kwasów karboksylowych. Występuje on w korzeniach niektórych roślin, na przykład arcydzięgla i kozłka lekarskiego. Charakteryzuje się on specyficznym zapachem, przez jednych odbieranym jako przykry, przez innych zaś jako słodki i miodowy. Uważany jest za afrodyzjak dla kotów. Kwas walerianowy w temperaturze pokojowej ejst oleistą, bezbarwną cieczą. Łatwo rozpuszcza się w wodzie i większości organicznych rozpuszczalników polarnych, m.in. acetonie, etanolu, eterze. Używany jest głównie do otrzymywania estrów. Estry kwasu walerianowego, czyli walerianiany, mają przyjemny zapach, w związku z czym stosuje się je w przemyśle perfumeryjnym i kosmetycznym.
 6) Kwas pelargonowy (kwas nonanowy) - jest to organiczny związek chemiczny z grupy nasyconych kwasów tłuszczowych. Ma postać bezbarwnej lub żółtawej oleistej cieczy o charakterystycznym zapachu. W obniżonej temperaturze ma postać bezbarwnych kryształów o blaszkowatym kształcie. W przyrodzie kwas pelargonowy występuje w postaci estrów w olejku eterycznym otrzymywanym z pelargonii.
6) Kwas pelargonowy (kwas nonanowy) - jest to organiczny związek chemiczny z grupy nasyconych kwasów tłuszczowych. Ma postać bezbarwnej lub żółtawej oleistej cieczy o charakterystycznym zapachu. W obniżonej temperaturze ma postać bezbarwnych kryształów o blaszkowatym kształcie. W przyrodzie kwas pelargonowy występuje w postaci estrów w olejku eterycznym otrzymywanym z pelargonii.

KWASY DWUKARBOKSYLOWE:
 1) Kwas szczawiowy (kwas etanodiowy), HOOC -COOH - jest to organiczny związek chemiczny, najprostszy kwas dikarboksylowy. Występuje w wielu roślinach, m.in. w szczawiu i rabarbarze. Otrzymuje się go przez ogrzewanie mrówczanu sodu do temperatury ok. 400 stopni Celsjusza, w wyniku czego powstaje szczawian sodu, który następnie przeprowadza się w kwas szczawiowy za pomocą rozcieńczonego kwasu siarkowego. Inne metody to przepuszczenie dwutlenku węgla nad metalicznym sodem lub potasem w temperaturze 360 stopni Celsjusza, a także utlenienie glikolu etylowego lub utlenianie wielu innych związków organicznych (np. cukrów) kwasem azotowym. Kwas szczawiowy można także otrzymać w reakcji acetylenu z nadmanganianem potasu. Kwas szczawiowy rozpuszcza się zarówno w wodzie, jak i rozpuszczalnikach organicznych (etanol, eter dietylowy). Z roztworu wodnego krystalizuje w postaci dihydratu (COOH)2·2H2O. Kwas szczawiowy jest jednym z najsilniejszych kwasów karboksylowych. Podczas ogrzewania ulega dekarboksylacji do kwasu mrówkowego i dwutlenku węgla: HOOC–COOH → H–COOH +CO2.
1) Kwas szczawiowy (kwas etanodiowy), HOOC -COOH - jest to organiczny związek chemiczny, najprostszy kwas dikarboksylowy. Występuje w wielu roślinach, m.in. w szczawiu i rabarbarze. Otrzymuje się go przez ogrzewanie mrówczanu sodu do temperatury ok. 400 stopni Celsjusza, w wyniku czego powstaje szczawian sodu, który następnie przeprowadza się w kwas szczawiowy za pomocą rozcieńczonego kwasu siarkowego. Inne metody to przepuszczenie dwutlenku węgla nad metalicznym sodem lub potasem w temperaturze 360 stopni Celsjusza, a także utlenienie glikolu etylowego lub utlenianie wielu innych związków organicznych (np. cukrów) kwasem azotowym. Kwas szczawiowy można także otrzymać w reakcji acetylenu z nadmanganianem potasu. Kwas szczawiowy rozpuszcza się zarówno w wodzie, jak i rozpuszczalnikach organicznych (etanol, eter dietylowy). Z roztworu wodnego krystalizuje w postaci dihydratu (COOH)2·2H2O. Kwas szczawiowy jest jednym z najsilniejszych kwasów karboksylowych. Podczas ogrzewania ulega dekarboksylacji do kwasu mrówkowego i dwutlenku węgla: HOOC–COOH → H–COOH +CO2.
ZASTOSOWANIE KWASU SZCZAWIOWEGO: Kwas szczawiowy stosowany jest do usuwania rdzy; w elektrotechnice jest on środkiem pomocniczym przy elektrolitycznym oksydowaniu glinu (Eloxal); w analizie mareczkowej jest substancją wzrocową do nastawiania miana roztworów utleniających; w pszczelarstwie jest stosowany do zawalczania roztocza Varroa destructor; służy również do wywabiania plam atramentu. W dużych stężeniach kwas szczawiowy działa drażniąco na skórę i błony śluzowe, ale nawet w ilościach spotykanych w żywności może być szkodliwy - z jonami wapnia tworzy trudno rozpuszczalny szczawian wapnia, który osadza się w psotaci kamieni w nerkach. Dlatego czesto spożywanie dużych ilości warzyw zawierających ten kwas może być przyczyną kamicy nerkowej a także niedoboru wapnia w organizmie.
 2) Kwas malonowy (kwas propanodiowy), HOOC-CH2-COOH - jest to organiczny związek chemiczny z grupy kwasów dikarboksylowych. Jego sole i estry są nazywane malonianami. Jego nazwa pochodzi od łacińskiego słowa malum oznaczającego "jabłko". Posiada własnosci silnie drażniące skórę i błony śluzowe. Jego moc jest zbliżona do mocy kwasu octowego. Po podgrzaniu do 150 stopni Celsjusza następuje jego dekarboksylacja do kwasu octowego i dwutlenku węgla. Odawadniając kwas malonowy otrzymuje się podtlenek węgla. Kwas octowy chloruje się do kwasu chlorooctowego. Tworzy się sól sodową za pomocą węglanu sodu, która następnie reaguje z cyjankiem sodu tworząc sól sodową kwasu cyjanooctowego w reakcji substytucji nukleofilowej. Grupą nitrylową hydrolizuje się za pomocą wodorotlenku sodu do malonianu sodu, który po zakwaszeniu tworzy kwas malonowy. Kwas malonowy i jego pochodne mają szerokie zastosowanie w przemyśle do produkcji leków, witamin, barwników, klejów, substancji zapachowych, a także w agrochemii. Może być użyty do wprowadzania fragmentu kwasu octowego w łagodnych warunkach w drodze kondensacji Knoevenagela, po której następuje dekarboksylacji. Jako przykład można podać preparatykę kwasu cynamonowego wykorzystywanego do produkcji niesteroidowego leku przeciwzapalnego - acemetacyny. Substancję aromatyczną γ-nonanolakton można także wytworzyć w kondensacji Knoevenagela z kwasu malonowego i heptanalu (heptanaldehyd), a następnie domknięcia pierścienia. Jego ester dietylowy jest wykorzystywany w syntezie organicznej. Warto wspomnieć, że kwas malonowy jest jednym ze składników służących do przeprowadzenia widowiskowej reakcji chemicznej z oscylacjami stężenia składników (reakcja Biełousowa-Żabotyńskiego).
2) Kwas malonowy (kwas propanodiowy), HOOC-CH2-COOH - jest to organiczny związek chemiczny z grupy kwasów dikarboksylowych. Jego sole i estry są nazywane malonianami. Jego nazwa pochodzi od łacińskiego słowa malum oznaczającego "jabłko". Posiada własnosci silnie drażniące skórę i błony śluzowe. Jego moc jest zbliżona do mocy kwasu octowego. Po podgrzaniu do 150 stopni Celsjusza następuje jego dekarboksylacja do kwasu octowego i dwutlenku węgla. Odawadniając kwas malonowy otrzymuje się podtlenek węgla. Kwas octowy chloruje się do kwasu chlorooctowego. Tworzy się sól sodową za pomocą węglanu sodu, która następnie reaguje z cyjankiem sodu tworząc sól sodową kwasu cyjanooctowego w reakcji substytucji nukleofilowej. Grupą nitrylową hydrolizuje się za pomocą wodorotlenku sodu do malonianu sodu, który po zakwaszeniu tworzy kwas malonowy. Kwas malonowy i jego pochodne mają szerokie zastosowanie w przemyśle do produkcji leków, witamin, barwników, klejów, substancji zapachowych, a także w agrochemii. Może być użyty do wprowadzania fragmentu kwasu octowego w łagodnych warunkach w drodze kondensacji Knoevenagela, po której następuje dekarboksylacji. Jako przykład można podać preparatykę kwasu cynamonowego wykorzystywanego do produkcji niesteroidowego leku przeciwzapalnego - acemetacyny. Substancję aromatyczną γ-nonanolakton można także wytworzyć w kondensacji Knoevenagela z kwasu malonowego i heptanalu (heptanaldehyd), a następnie domknięcia pierścienia. Jego ester dietylowy jest wykorzystywany w syntezie organicznej. Warto wspomnieć, że kwas malonowy jest jednym ze składników służących do przeprowadzenia widowiskowej reakcji chemicznej z oscylacjami stężenia składników (reakcja Biełousowa-Żabotyńskiego).  3) Kwas bursztynowy (kwas butanodiowy) - jest to związek organiczny z grupy kwasów dikarboksylowych. Jest on rozpuszczalny w wodzie, etanolu i eterze. Dość powszechnie występuje w przyrodzie, ejst obecny w większości owoców i warzyw. Stanowi produkt pośredni w cyklu Krebsa. W przemyśle jest otrzymywany przez uwodornienie kwasu maleinowego wg reakcji:
3) Kwas bursztynowy (kwas butanodiowy) - jest to związek organiczny z grupy kwasów dikarboksylowych. Jest on rozpuszczalny w wodzie, etanolu i eterze. Dość powszechnie występuje w przyrodzie, ejst obecny w większości owoców i warzyw. Stanowi produkt pośredni w cyklu Krebsa. W przemyśle jest otrzymywany przez uwodornienie kwasu maleinowego wg reakcji: 2COOSbO), znany również jako emetyk, był stosowany jako środek pobudzający do wymiotów. Kwas winowy lub wodorowinian sodu stosuje się w analizie chemicznej do wykrywania jonów potasu .
- ZASTOSOWANIE W MEDYCYNIE: Kwas winowy podawany doustnie w postaci roztworu powoduje ugaszenie pragnienia. Wykazuje on działanie przeciwbiegunkowe - w małych dawkach, natomiast w większych jest osmotycznym środkiem przeczyszczającym. Wzmaga procesy regeneracji nabłonków przewodu pokarmowego, zapobiega ponadto niestrawności. Posiada dość silne właściwości prebiotyczne. Zastosowany miejscowo odznacza sie działaniem antyseptycznym i ściągającyym. Ponadto działa także przeciwzzapalnie, hamując obrzęki oraz nadmierne wydzielanie sebum. W dermatologii stosowany miejscowo w postaci roztworów wodnych 0,5-5%. Ponadto szeroko stosowany jest w przemyśle farmaceutycznym do przygotowywania postaci leku (granulaty, formy musujące - effervescens i inne) oraz jako regulator kwasowości, substancja stabilizująca.
KWASY TRÓJKARBOKSYLOWE:
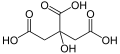 1) Kwas cytrynowy (łac. Acidum citricum) - organiczny związek chemiczny z grupy hydroksykwasów karboksylowych. Zawiera 3 grupy karboksylowe. Kwas cytrynowy jest uważany za związek bezpieczny, jednak może powodować uszkodzenia oczu w przypadku bezpośredniego kontaktu. Doniesienia o możliwym działanu rakotwórczym są całkowicie błędne. Kwas cytrynowy występuje w niewielkich ilościach w większości organizmów żywych, gdyż spełnia ważną rolę w ich metabolizmie węglowodanów. Jego forma zjonizowana (cytrynian) jest ważnym produktem przejściowym w cyklu Krebsa (zwanym stąd cyklem kwasu cytrynowego). W większych ilościach występuje w niektórych owocach, np. w cytrynach, w których stanowi nawet do 8% suchem asy (co odpowiada 0,65% masy świeżej cytryny). W przemyśle kwas cytrynowy jest otrzymywany głównie przez fermentację cytrynową na pożywce z oczyszczonego cuktru lub hydrolizatu skrobi za pomocą kultur kropidlaka czarnego (Aspergillus niger) hodowanego na podłożu o początkowym pH 2,5-3,5. Może być otrzymywany syntetycznie. Można go uzyskać w postaci krystalicznej w formie bezwodnej lub jako monohydrat i w obu tych postaciach jest dostępny w handlu. Kwas cytrynowy używany jest jako regulator kwasowości i przeciwutleniacz w produktach spożywczych, a także jako kwasowy środek myjący w różnych procesach czyszczących. Sole kwasu cytrynowego - cytryniany - są stosowane jako leki przy niedoborze określonego metalu w organizmie. Jest wykorzystywany także w przemyśle farmaceutycznym oraz w gospodarstwie domowym pod nazwą kwasek cytrynowy.
1) Kwas cytrynowy (łac. Acidum citricum) - organiczny związek chemiczny z grupy hydroksykwasów karboksylowych. Zawiera 3 grupy karboksylowe. Kwas cytrynowy jest uważany za związek bezpieczny, jednak może powodować uszkodzenia oczu w przypadku bezpośredniego kontaktu. Doniesienia o możliwym działanu rakotwórczym są całkowicie błędne. Kwas cytrynowy występuje w niewielkich ilościach w większości organizmów żywych, gdyż spełnia ważną rolę w ich metabolizmie węglowodanów. Jego forma zjonizowana (cytrynian) jest ważnym produktem przejściowym w cyklu Krebsa (zwanym stąd cyklem kwasu cytrynowego). W większych ilościach występuje w niektórych owocach, np. w cytrynach, w których stanowi nawet do 8% suchem asy (co odpowiada 0,65% masy świeżej cytryny). W przemyśle kwas cytrynowy jest otrzymywany głównie przez fermentację cytrynową na pożywce z oczyszczonego cuktru lub hydrolizatu skrobi za pomocą kultur kropidlaka czarnego (Aspergillus niger) hodowanego na podłożu o początkowym pH 2,5-3,5. Może być otrzymywany syntetycznie. Można go uzyskać w postaci krystalicznej w formie bezwodnej lub jako monohydrat i w obu tych postaciach jest dostępny w handlu. Kwas cytrynowy używany jest jako regulator kwasowości i przeciwutleniacz w produktach spożywczych, a także jako kwasowy środek myjący w różnych procesach czyszczących. Sole kwasu cytrynowego - cytryniany - są stosowane jako leki przy niedoborze określonego metalu w organizmie. Jest wykorzystywany także w przemyśle farmaceutycznym oraz w gospodarstwie domowym pod nazwą kwasek cytrynowy.
INNE KWASY KARBOKSYLOWE:
 1) Acemetacyna (łac. Acemetacinum) - jest to organiczny związek chemiczny, lek z grupy niesteroidowych leków przeciwzapalnych, hamujący COX-1 i COX-2. Działa on przeciwzapalnie, wykazuje także właściwości przeciwbólowe i przeciwgorączkowe. Acemetacyna jest estrem indometacyny, która jest jej głównym metabolitem. Acemetacyna jest stosowana głównie w chorobie zwyrodnieniowej stawów, ponadto w przewlekłych zapaleniach stawów, mięśni i ścięgien, reumatoidalnym zapaleniu stawów, bólu pooperacyjnym, ostrych napadach dny moczanowej i łuszczycowym zapaleniu stawów. Acemetacyna może zwiększać stężenie digoksyny i litu we krwi. Stosowana łącznie z lekami przeciwzakrzepowymi, kortykosteroidami i nnymi NLPZ zwiększa ryzyko krwawienia, zwłaszcza z przewodu pokarmowego. Lek ten może również opróżniać wydalanie penicylin, osłabiać działanie hipotensyjne leków moczopędnych i innych leków obniżających ciśnienie krwi.
1) Acemetacyna (łac. Acemetacinum) - jest to organiczny związek chemiczny, lek z grupy niesteroidowych leków przeciwzapalnych, hamujący COX-1 i COX-2. Działa on przeciwzapalnie, wykazuje także właściwości przeciwbólowe i przeciwgorączkowe. Acemetacyna jest estrem indometacyny, która jest jej głównym metabolitem. Acemetacyna jest stosowana głównie w chorobie zwyrodnieniowej stawów, ponadto w przewlekłych zapaleniach stawów, mięśni i ścięgien, reumatoidalnym zapaleniu stawów, bólu pooperacyjnym, ostrych napadach dny moczanowej i łuszczycowym zapaleniu stawów. Acemetacyna może zwiększać stężenie digoksyny i litu we krwi. Stosowana łącznie z lekami przeciwzakrzepowymi, kortykosteroidami i nnymi NLPZ zwiększa ryzyko krwawienia, zwłaszcza z przewodu pokarmowego. Lek ten może również opróżniać wydalanie penicylin, osłabiać działanie hipotensyjne leków moczopędnych i innych leków obniżających ciśnienie krwi.  2) Acetylocysteina (łac. Acetylcysteinum; N-acetylocysteina, ACC, NAC) - jest to organiczny związek chemiczny, N-acetylowa pochodna L-cysteiny o działaniu mukolitycznym. Stosowana także w postaci soli sodowej. Mechanizm jej działania opiera się na zmniejszaniu lepkości wydzieliny poprzez rozrywanie wiązań disiarczkowych w polipeptydach śluzu, z utworzeniem produktów o zwiększonej hydrofilowości. Usprawnia również czynność nabłonka oddechowego odpowiedzialnego za usuwania nadmiaru wydzieliny w drogach oddechowych. Wskazaniem do stosowania cetylocysteiny są ostre i przewlekłe zapalenia oskrzeli, mukowiscydoza, stosowanie tych leków zawsze połączone z kinezyterapią (leczenie ruchem, gimnastyka). Acetylocysteina stosowana jest jako antidotum w przypadku zatruć paracetamolem, inaktywuje jego toksyczne metabolity (głównie N-acetylo-p-benzochinominę) i utrzymuje prawidłowy poziom glutanionu w wątrobie. W niektórych badaniach wykazano, że podwanie acetylocysteiny zmniejsza ryzyko nefropatiii wywołanej środkami kontrastowymi, jednakże wyniki innych badań podają to w wątpliwość. Stosowana również w leczeniu AIDS - poprzez hamowanie aktywacji białka NF-kB; wówczas geny HIV nie są transkrybowane.
2) Acetylocysteina (łac. Acetylcysteinum; N-acetylocysteina, ACC, NAC) - jest to organiczny związek chemiczny, N-acetylowa pochodna L-cysteiny o działaniu mukolitycznym. Stosowana także w postaci soli sodowej. Mechanizm jej działania opiera się na zmniejszaniu lepkości wydzieliny poprzez rozrywanie wiązań disiarczkowych w polipeptydach śluzu, z utworzeniem produktów o zwiększonej hydrofilowości. Usprawnia również czynność nabłonka oddechowego odpowiedzialnego za usuwania nadmiaru wydzieliny w drogach oddechowych. Wskazaniem do stosowania cetylocysteiny są ostre i przewlekłe zapalenia oskrzeli, mukowiscydoza, stosowanie tych leków zawsze połączone z kinezyterapią (leczenie ruchem, gimnastyka). Acetylocysteina stosowana jest jako antidotum w przypadku zatruć paracetamolem, inaktywuje jego toksyczne metabolity (głównie N-acetylo-p-benzochinominę) i utrzymuje prawidłowy poziom glutanionu w wątrobie. W niektórych badaniach wykazano, że podwanie acetylocysteiny zmniejsza ryzyko nefropatiii wywołanej środkami kontrastowymi, jednakże wyniki innych badań podają to w wątpliwość. Stosowana również w leczeniu AIDS - poprzez hamowanie aktywacji białka NF-kB; wówczas geny HIV nie są transkrybowane.  3) Baklofen (łac. Baclofenum) - jest to lek spazmolityczny stosowany w leczeniu spastyczności, pochodna kwasu gamma-aminomasowego (GABA). Jest agonistą (substancją łączącą się z receptorem i powodującą reakcję w komórce) receptorów GABAB ssaków. Baklofen zmniejsza napięcie mięśni szkieletowych hamując odruchy mono- i polisynaptyczne na poziomie rdzenia kręgowego, w którym znajduje się punkt uchwytu leku. Dokładny mechanizm działania baklofenu nie jest jednak poznany. Bezpośredni wlew do przestrzeni podpajęczynówkowej przez pompę intratekalną pozwala cząsteczkom leku związać się z miejscami receptorowymi w rogach tylnych, co umożliwia leczenie dawkami co najmniej 100-krotnie mniejszymi od tych stosowanych doustnie. Korzystną cechą baklofenu jest niewywoływanie widocznej tolerancji, nawet po wielu latach stosowania. Baklofen stosowany jest w leczeniu stwardnienia rozsianego, stwardnienia zanikowego boczngo, diplegii spastycznej, neuralgii trójdzielnej i uporczywej czkawki. Baklofen znajduje także zastosowanie w leczeniu uzależnienia od alkoholu. Znane jest również jego działanie znoszące objawy głodu alkoholowego.
3) Baklofen (łac. Baclofenum) - jest to lek spazmolityczny stosowany w leczeniu spastyczności, pochodna kwasu gamma-aminomasowego (GABA). Jest agonistą (substancją łączącą się z receptorem i powodującą reakcję w komórce) receptorów GABAB ssaków. Baklofen zmniejsza napięcie mięśni szkieletowych hamując odruchy mono- i polisynaptyczne na poziomie rdzenia kręgowego, w którym znajduje się punkt uchwytu leku. Dokładny mechanizm działania baklofenu nie jest jednak poznany. Bezpośredni wlew do przestrzeni podpajęczynówkowej przez pompę intratekalną pozwala cząsteczkom leku związać się z miejscami receptorowymi w rogach tylnych, co umożliwia leczenie dawkami co najmniej 100-krotnie mniejszymi od tych stosowanych doustnie. Korzystną cechą baklofenu jest niewywoływanie widocznej tolerancji, nawet po wielu latach stosowania. Baklofen stosowany jest w leczeniu stwardnienia rozsianego, stwardnienia zanikowego boczngo, diplegii spastycznej, neuralgii trójdzielnej i uporczywej czkawki. Baklofen znajduje także zastosowanie w leczeniu uzależnienia od alkoholu. Znane jest również jego działanie znoszące objawy głodu alkoholowego.
KWASY CUKROWE:

1) Kwasy aldarowe - są to pochodne aldoz, w których końcowe grupy aldehydowa i hydroksylowa zostały utlenione do grup karboksylowych. Utlenienie jedynie grupy aldehydowej prowadzi do powstania kwasu aldonowego, a grupy hydroksylowej - kwasu uronowego.
HOOC[CH(OH)]nCOOH.

2) Kwasy aldonowe - jest to grupa kwasów cukrowych o wzorze ogólnym HOCH2[CH(OH)]nCOOH, pochodnych aldoz, w których końcowa grupa aldehydowa została utleniona do grupy karboksylowej. Utlenianie końcowej grupy hydroksylowej zamiast aldehydowej, prowadzi natomiast do powstania kwasu uronowego, a obu grup końcowych - kwasu aldarowego.
 3) Kwas arabinowy - jest to związek z grupy kwasów cukrowych, który wraz ze swoimi solami wapniowymi, magnezowymi i potasowymi, w postaci polisacharydu jest głównym składnikiem gumy arabskiej. Może zostać uzyskany porzez działanie kwasem mineralnym na gumę arabską i następne dodanie alkoholu. Rozpuszcza się w wodzie, chyba że zostanie uprzednio wysuszony. Guma arabska (łac. Gummi arabicum, syn. Gummi Aciaciae) to twardniejąca na powietrzu guma roślinna, będąca wydzieliną wyciekającą naturalnie w wyniku uszkodzeń lub otrzymywaną przez nacięcie pnia i gałęzi akacji senegalskiej i innych gatunków z rodzaju Acacia pochodzących z Afryki. Znana była już w starożytności. Guma arabska jest nierozpuszczalna w etanolu, eterze i olejach, słabo w glicerolu. Prawie całkowicie, lecz bardzo powoli, rozpuszcza się w podwójnej w stosunku do swej masy ilości wody. Otrzymany roztwór jest bezbarwny lub żółtawy, gęsty, lepki, kleisty i lekko kwasowy. Po wysuszeniu występuje jako żółtawobiałe, żółte lub jasnobursztynowe, czasem z różowawym odcieniem, kruche, nieprzezroczyste, kuliste, owalne lub nerkowate kawałki (łezki) o średnicy ok. 1-3 mm, często ze spękaną powierzchnią, łatwo łamiące się na nieregularne, białawe lub jasnożółtawe, kanciaste bryłki o strukturze muszlowatej, szkliste i przezroczyste. Niekiedy surowiec jest sproszkowany, według Farmakopei polskiej jest to "guma arabska suszona rozpyłowo" - co to jest suszenie rozpyłowe? - LINK. Głównym składnikiem gumy arabskiej jest polisacharyd zwany arabiną, będący solą wapniową magnezową lub potasową kwasu arabinowego. Ponadto w surowcu tym są zwykle zawarte enzymy utleniające - oksydazy i peroksydazy, które mogą powodować niezgodności w recepturze aptecznej np. z witaminą A lub azotanem bizmutu (III).
3) Kwas arabinowy - jest to związek z grupy kwasów cukrowych, który wraz ze swoimi solami wapniowymi, magnezowymi i potasowymi, w postaci polisacharydu jest głównym składnikiem gumy arabskiej. Może zostać uzyskany porzez działanie kwasem mineralnym na gumę arabską i następne dodanie alkoholu. Rozpuszcza się w wodzie, chyba że zostanie uprzednio wysuszony. Guma arabska (łac. Gummi arabicum, syn. Gummi Aciaciae) to twardniejąca na powietrzu guma roślinna, będąca wydzieliną wyciekającą naturalnie w wyniku uszkodzeń lub otrzymywaną przez nacięcie pnia i gałęzi akacji senegalskiej i innych gatunków z rodzaju Acacia pochodzących z Afryki. Znana była już w starożytności. Guma arabska jest nierozpuszczalna w etanolu, eterze i olejach, słabo w glicerolu. Prawie całkowicie, lecz bardzo powoli, rozpuszcza się w podwójnej w stosunku do swej masy ilości wody. Otrzymany roztwór jest bezbarwny lub żółtawy, gęsty, lepki, kleisty i lekko kwasowy. Po wysuszeniu występuje jako żółtawobiałe, żółte lub jasnobursztynowe, czasem z różowawym odcieniem, kruche, nieprzezroczyste, kuliste, owalne lub nerkowate kawałki (łezki) o średnicy ok. 1-3 mm, często ze spękaną powierzchnią, łatwo łamiące się na nieregularne, białawe lub jasnożółtawe, kanciaste bryłki o strukturze muszlowatej, szkliste i przezroczyste. Niekiedy surowiec jest sproszkowany, według Farmakopei polskiej jest to "guma arabska suszona rozpyłowo" - co to jest suszenie rozpyłowe? - LINK. Głównym składnikiem gumy arabskiej jest polisacharyd zwany arabiną, będący solą wapniową magnezową lub potasową kwasu arabinowego. Ponadto w surowcu tym są zwykle zawarte enzymy utleniające - oksydazy i peroksydazy, które mogą powodować niezgodności w recepturze aptecznej np. z witaminą A lub azotanem bizmutu (III).
*KWASY URONOWE - jest to grupa kwasów cukrowych pochodnych aldoz, w których końcowa grupa hydroksylowa została utleniona do grupy karboksylowej. Wchodzą one w skład polisacharydów i glikozydów w organizmie oraz śluzów roślinnych. Utlenianie końcowej grupy aldehydowej zamiast hydroksylowej prowadzi natomiast do powstania kwasu aldonowego, a obu grup końcowych - kwasu aldarowego.
 4) Kwas galakturonowy - jest to organiczny związek chemiczny z grupy kwasów uronowych, powstający na skutek utlenienia mikrobiologicznego galaktozy.
4) Kwas galakturonowy - jest to organiczny związek chemiczny z grupy kwasów uronowych, powstający na skutek utlenienia mikrobiologicznego galaktozy.
5) Kwas glicerynowy - pochodna gliceryny zawierająca grupę karboksylową -COOH.

6) Kwas glukarowy (kwas sacharowy) - jest to kwas dikarboksylowy. Produkt utleniania glukozy przy węglu C1 i C6.
7) Kwas glukonowy - jest to organiczny związek chemiczny, pochodna glukozy, powstała przez utlenienie jej grupy aldehydowej (-CHO). W lecznictwie jest wykorzystywany do leczenia alergii, a jego sól wapniowa - glukonian wapnia - w przypadkach niedoboru tego pierwiastka.
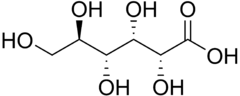
 8) Kwas glukuronowy - pochodna glukozy zawierająca grupę karboksylową (-COOH) przy atomie węgla C6 glukozy (powstaje w reakcji utleniania węgla C6 glukozy). Naturalnie występuje w konfiguracji D. Bierze udział w procesach detoksykacji (biotransformacji ksenobiotyków). W wątrobie człowieka łączy się z ksenobiotykami i słabo rozpuszczalnymi metabolitami (jak np. bilirubina i sterole), tworząc glikuronidy następnie wydalane z moczem. Jest składnikiem mukopolisacharydów, kwasu hialuronowego, glikoprotein, hemiceluloz. Otrzymywany jest z gumy arabskiej. Znajduje zastosowanie jako środek przeciwreumatyczny.
8) Kwas glukuronowy - pochodna glukozy zawierająca grupę karboksylową (-COOH) przy atomie węgla C6 glukozy (powstaje w reakcji utleniania węgla C6 glukozy). Naturalnie występuje w konfiguracji D. Bierze udział w procesach detoksykacji (biotransformacji ksenobiotyków). W wątrobie człowieka łączy się z ksenobiotykami i słabo rozpuszczalnymi metabolitami (jak np. bilirubina i sterole), tworząc glikuronidy następnie wydalane z moczem. Jest składnikiem mukopolisacharydów, kwasu hialuronowego, glikoprotein, hemiceluloz. Otrzymywany jest z gumy arabskiej. Znajduje zastosowanie jako środek przeciwreumatyczny.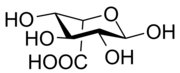 9) Kwas iduronowy - jest to organiczny związek chemiczny z grupy kwasów uronowych. Jest on głównym przedstawicielem tej klasy związków w glikozaminoglikanach: heparynie i siarczanie dermatanu. Jest to produkt utleniania L-idozy.
9) Kwas iduronowy - jest to organiczny związek chemiczny z grupy kwasów uronowych. Jest on głównym przedstawicielem tej klasy związków w glikozaminoglikanach: heparynie i siarczanie dermatanu. Jest to produkt utleniania L-idozy.  10) Kwas muraminowy - jest to organiczny związek chemiczny z grupy kwasów cukrowych, pochodna glukozaminy oraz kwasu mlekowego połączonych wiązaniem eterowym. Występuje naturalnie jako N-acetylowa pochodna glukozaminy, to znaczy kwas N-acetylomuraminowy, w peptydoglikanie, pełniącym wiele różnych funkcji biologicznych, na przykład komponentu łańcuchów polisacharydowych tworzących ściany komórkowe niektórych bakterii.
10) Kwas muraminowy - jest to organiczny związek chemiczny z grupy kwasów cukrowych, pochodna glukozaminy oraz kwasu mlekowego połączonych wiązaniem eterowym. Występuje naturalnie jako N-acetylowa pochodna glukozaminy, to znaczy kwas N-acetylomuraminowy, w peptydoglikanie, pełniącym wiele różnych funkcji biologicznych, na przykład komponentu łańcuchów polisacharydowych tworzących ściany komórkowe niektórych bakterii.
ETERY Z GRUPĄ KARBOKSYMETYLOWĄ:
1) Cetyryzyna (łac. Cetirizinum) - jest to antagonista receptora H1, pochodna hydroksyzyny. Jest to lek przeciwhistaminowy II generacji. Blokuje receptory H1 i hamuje chemotaksję eozynofili. W lecznictwie stosuje się również aktywny izomer lewoskrętny: lewocetyryzynę. Stosowany jest w przypadku alergicznego nieżytu nosa, alergicznego zapalenia spojówek, skórnych odczynó∑ alergicznych i pokrzywki.
 2) Karboksymetyloceluloza - polimer, półsyntetyczna pochodna celulozy otrzymana przez przyłączenie do jednej z reszt hydroksylowych glukopiranozy z grupy karboksymetylowej (-CH2-COOH). Często używana jest w postaci soli sodowej. W przemyśle spożywczym jest oznaczana symbolem E466 i należy do grupy emulgatorów i środków zagęszczających. Karboksymetyloceluloza jest syntetyzowana w wyniku katalizowanej zasadowo reakcji celulozy z kwasem chlorooctowym. Sól sodową otrzymuje się poprzez działanie chlorooctanu sodu na alkalicelulozę.
2) Karboksymetyloceluloza - polimer, półsyntetyczna pochodna celulozy otrzymana przez przyłączenie do jednej z reszt hydroksylowych glukopiranozy z grupy karboksymetylowej (-CH2-COOH). Często używana jest w postaci soli sodowej. W przemyśle spożywczym jest oznaczana symbolem E466 i należy do grupy emulgatorów i środków zagęszczających. Karboksymetyloceluloza jest syntetyzowana w wyniku katalizowanej zasadowo reakcji celulozy z kwasem chlorooctowym. Sól sodową otrzymuje się poprzez działanie chlorooctanu sodu na alkalicelulozę.
3) Kwas 2,4 - dichlorofenoksyoctowy i 2,3,5 - trichlorofenoksyoctowy:
Kwas 2,4 -
dichlorofenoksyoctowy to organiczny związek chemiczny z grupy kwasów fenoksyoctowych. Jest fitoksycznym bojowym
środkiem trującym. W latach 40-tych XX wieku badania nad nim prowadzono w USA i Wielkiej Brytanii.
Był stosowany na skalę masową przez Amerykanów w wojnie wietnamskiej. Istnieje ponad 1500 środków
 |
| Kwas 2,4 - dichlorofenoksyoctowy |
ochrony roślin zawierających 2,4-D. Sole sodowe i amonowe 2,4-D dobrze rozpuszczają się w wodzie,
natomiast estry są w niej nierozpuszczalne. 2,4-D może być stosowany w postaci czystej lub w mieszaninach
z innymi fitotoksycznymi bojowymi środkami trującymi. Jest składnikiem mieszanki czerwonej i pomarańczowej
(tęczowe herbicydy stanowiły grupę chemikaliów używanych jako broń chemiczna podczas działań wojennych
przeprowadzonych przez Armię Stanów Zjednoczonych w celu zniszczenia roślinności dżungli oraz pól uprawnych.
Armia amerykańska używała herbicydów tęczowych w celu niszczenia roślinności dżungli. Operacja ta miała
dwa cele: doprowadzenie do zrzucenia liści przez drzewa w celu uniemożliwienia ukrycia się partyzantów na
danym terenie i spowodowanie zniszczenia upraw w celu doprowadzenia do braków żywności u wroga.
 |
| Kwas 2,4,5-trichlorofenoksyoctowy |
 |
| Źródło: Wikipedia. Właściwości trujące Agent Orange. |
4) Kwas etakrynowy (łac. Acidum etacrynicum) - jest to wielofunkcyjny organiczny związek chemiczny, który
należy do środków moczpędnych typu diuretyków pętlowych. Jest lekiem bardzo toksycznym. Powodowane przez niego
uszkodzenie słuchu może być nieodwracalne. W przeciwieństwie do pozostałych stosowanych diuretyków pętlowych nie
ma budowy sulfonamidowej i może być stosowany u chorych wykazujących nadwrażliwość na sulfonamidy.
Wskazania są takie same jak dla pozostałych diuretyków pętlowych. Kwas etakrynowy jest obecnie w leczenictwie
5) Lewocetyryzyna - jest to organiczny związek chemiczny, antagonista receptora H1, aktywny lewoskre†ny
enacjomer cetyryzyny o silniejszym działaniu. W postaci dichlorowodorku jest stosowana w leczeniu alergicznego
nieżytu nosa, alergicznego zapalenia spojówek oraz przewlekłej pokrzywki idiopatycznej. Preparaty produkowane
KWASY FENOLOWE:
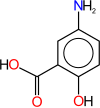 1) Mesalazyna (kwas 5-aminosalicylowy) - jest to organiczny związek chemiczny, aminowa pochodna kwasu salicylowego. Stosowany jest jako niesteroidowy lek przeciwzapalny, głównie w leczeniu wrzodziejącego zapalenia jelita grubego i choroby Leśniowskiego-Crohna. Mechanizm działania mesalazyny polega na hamowaniu syntezy prostaglandyny PGE2, prostacykliny PGL2, tromboksanu A2 oraz leukotrienu B4. Ponadto bierze udział w hamowaniu reakcji utleniania w błonie śluzowej okrężnicy.
1) Mesalazyna (kwas 5-aminosalicylowy) - jest to organiczny związek chemiczny, aminowa pochodna kwasu salicylowego. Stosowany jest jako niesteroidowy lek przeciwzapalny, głównie w leczeniu wrzodziejącego zapalenia jelita grubego i choroby Leśniowskiego-Crohna. Mechanizm działania mesalazyny polega na hamowaniu syntezy prostaglandyny PGE2, prostacykliny PGL2, tromboksanu A2 oraz leukotrienu B4. Ponadto bierze udział w hamowaniu reakcji utleniania w błonie śluzowej okrężnicy.  2) Kwas p-aminosalicylowy - jest to organiczny związek chemiczny z grupy aromatycznych aminokwasów, lek przeciwgruźliczy wprowadzony do lecznictwa w 1946 roku, jako lek wspomagający przy terapii innymi lekami przeciwgruźliczymi, np. streptomycyną. Miał on za zadanie utrudnianie wytwarzania się szczepów opornych na leki. Obecnie jest to zastępczy lek przeciwgruźliczny, rzadko stosowany, ponieważ jest źle tolerowany przez chorych. Lek ten może wywoływać m.in. zaburzenia żołądkowo-jelitowe (nudności, wymioty, bóle brzucha, biegunkę), odwracalny zespół tocznia rumieniowatego układowego i objawy przypominające mononukleozę (gorączka, wysypka, powiększenie węzłów chłonnych i wątroby) a także methemoglobinemię, plamicę naczyniową czy oksydatywną hemolizę.
2) Kwas p-aminosalicylowy - jest to organiczny związek chemiczny z grupy aromatycznych aminokwasów, lek przeciwgruźliczy wprowadzony do lecznictwa w 1946 roku, jako lek wspomagający przy terapii innymi lekami przeciwgruźliczymi, np. streptomycyną. Miał on za zadanie utrudnianie wytwarzania się szczepów opornych na leki. Obecnie jest to zastępczy lek przeciwgruźliczny, rzadko stosowany, ponieważ jest źle tolerowany przez chorych. Lek ten może wywoływać m.in. zaburzenia żołądkowo-jelitowe (nudności, wymioty, bóle brzucha, biegunkę), odwracalny zespół tocznia rumieniowatego układowego i objawy przypominające mononukleozę (gorączka, wysypka, powiększenie węzłów chłonnych i wątroby) a także methemoglobinemię, plamicę naczyniową czy oksydatywną hemolizę.
3) Kwas embonowy - jest to organiczny związek chemiczny z grupy kwasów dikarboksylowych zawierający dwa układy naftalenowe:
 - układ naftalenowy.
- układ naftalenowy.- Otrzymywany z kwasu 2-hydroksy-3-naftoesowego i formaldehydu. Rozkłada się powyżej 280 stopni Celsjusza. Praktycznie nie rozpuszcza się w wodzie, etanolu, eterze dietylowym, benzenie i kwasie octowym, natomiast rozpuszcza się w nitrobenzenie i pirydynie oraz nieco słabiej w chlorofomie. Tworzy on sole zwane embonianami (pamonianami), w postaci których stosowane są niektóre leki (np. embonian pyrantelu, pamonian hydroksyzyny) i stanowią nieaktywny składnik tych środków.

 4) Kwas ferulowy (kwas 4-hydroksy-3-metoksycynamonowy) - jest to pochodna kwasu cynamonowego. Rozpuszcza się w wodzie i etanolu. Wykazuje działanie żółciopędne i lipotropowe. Kwas ferulowy występuje naturalnie w wielu roślinach, głównie w liściach, nasionach oraz korze drzew iglastych, w ziarnach pszenicy, ryżu, kukurydzy i żyta. Zawiera go również kapusta, kora wierzby, rzęsa, szpinak, ziele bodziszków, ziele czartawy, ziele gwiazdnic, ziele widłaków. Kwas ferulowy, podobnie jak i wiele innych fenoli jest przeciwutleniaczem i dezaktywuje rodniki, m.in. reaktywne formy tlenu, redukując stres oksydacyjny i tworzenie dimerów tymidynowych (powodujących uszkodzenia DNA i prowadząc do rozwoju chorób nowotworowych i przyspieszonego starzenia się skóry). Badania in vitro wskazują, że kwas ferulowy może wykazywać bezpośrednią
4) Kwas ferulowy (kwas 4-hydroksy-3-metoksycynamonowy) - jest to pochodna kwasu cynamonowego. Rozpuszcza się w wodzie i etanolu. Wykazuje działanie żółciopędne i lipotropowe. Kwas ferulowy występuje naturalnie w wielu roślinach, głównie w liściach, nasionach oraz korze drzew iglastych, w ziarnach pszenicy, ryżu, kukurydzy i żyta. Zawiera go również kapusta, kora wierzby, rzęsa, szpinak, ziele bodziszków, ziele czartawy, ziele gwiazdnic, ziele widłaków. Kwas ferulowy, podobnie jak i wiele innych fenoli jest przeciwutleniaczem i dezaktywuje rodniki, m.in. reaktywne formy tlenu, redukując stres oksydacyjny i tworzenie dimerów tymidynowych (powodujących uszkodzenia DNA i prowadząc do rozwoju chorób nowotworowych i przyspieszonego starzenia się skóry). Badania in vitro wskazują, że kwas ferulowy może wykazywać bezpośrednią - aktywność przeciw rakowi piersi i wątroby (kwas ferulowy może być czynnikiem apoptycznym w komórkach rakowych, indukując ich samozniszczenie).
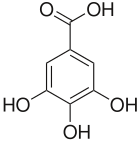 5) Kwas galusowy - jest to jeden z kwasów fenolowych, trihydroksylowa pochodna kwasu bezoesowego. Tworzy bezbarwne, rozpuszczalne w wodzie kryształy. Kompleksuje jony żelaza (III) (Fe3+), dając związki o intensywnym ciemnym zabarwieniu. Kwas galusowy występuje w wielu roślinach zarówno w stanie wolnym, jak również w postaci galotaniny. Kwas ten zawiera na przykład ziele żurawki jak również liść i kora oczaru. W roślinach z rodzaju brezylka (Caesalpinia) oraz w galasach występuje w postaci kwasu galusowo-taninowego. Kwas galusowy jest składnikiem liści herbaty. Można go wykryć w herbacie za pomocą roztworu chlorku żelaza (III) (reakcja charakterystyczna dla fenoli - roztwór przyjmuje charakterystyczne granatowo-fioletowe zabarwienie). Kwas galusowy jest otrzymywany z galasów przez ekstrakcję. Jest wykorzystywany m.in. do wyrobu barwników i atramentów. Znane są "atramenty galusowe" zawierające oprócz niebieskiego barwnika (dla uwidocznienia pisma) także prawie bezbarwny galusan żelaza (II). W wyniku utlenienia tlenem z powietrza przechodzi on w czarny związek żelaza (III), uwidaczniając w ten sposób wcześniej naniesiony tekst. Dermatol (zasadowy galusan bizmutu) stosowany jest w medycynie i kosmetyce jako środek ściągający i wysuszający wydzieliny. Estry kwasu galusowego są stosowanego w przemyśle jako przeciwutleniacze przeciwdziałające jełczeniu tłuszczów jadalnych. Wykazuje zdolność blokowania związków rakotwórczych powstających w cyklu przemian metabolicznych niektórych kancerogenów oraz wykazuje właściwości ściągające antyseptyczne i przeciwpotne. Kwas galusowy czasami wykorzystuje się w pirotechnice, ponieważ zmieszany z silnymi utleniaczami, np. chloranami (głównie potasu o
5) Kwas galusowy - jest to jeden z kwasów fenolowych, trihydroksylowa pochodna kwasu bezoesowego. Tworzy bezbarwne, rozpuszczalne w wodzie kryształy. Kompleksuje jony żelaza (III) (Fe3+), dając związki o intensywnym ciemnym zabarwieniu. Kwas galusowy występuje w wielu roślinach zarówno w stanie wolnym, jak również w postaci galotaniny. Kwas ten zawiera na przykład ziele żurawki jak również liść i kora oczaru. W roślinach z rodzaju brezylka (Caesalpinia) oraz w galasach występuje w postaci kwasu galusowo-taninowego. Kwas galusowy jest składnikiem liści herbaty. Można go wykryć w herbacie za pomocą roztworu chlorku żelaza (III) (reakcja charakterystyczna dla fenoli - roztwór przyjmuje charakterystyczne granatowo-fioletowe zabarwienie). Kwas galusowy jest otrzymywany z galasów przez ekstrakcję. Jest wykorzystywany m.in. do wyrobu barwników i atramentów. Znane są "atramenty galusowe" zawierające oprócz niebieskiego barwnika (dla uwidocznienia pisma) także prawie bezbarwny galusan żelaza (II). W wyniku utlenienia tlenem z powietrza przechodzi on w czarny związek żelaza (III), uwidaczniając w ten sposób wcześniej naniesiony tekst. Dermatol (zasadowy galusan bizmutu) stosowany jest w medycynie i kosmetyce jako środek ściągający i wysuszający wydzieliny. Estry kwasu galusowego są stosowanego w przemyśle jako przeciwutleniacze przeciwdziałające jełczeniu tłuszczów jadalnych. Wykazuje zdolność blokowania związków rakotwórczych powstających w cyklu przemian metabolicznych niektórych kancerogenów oraz wykazuje właściwości ściągające antyseptyczne i przeciwpotne. Kwas galusowy czasami wykorzystuje się w pirotechnice, ponieważ zmieszany z silnymi utleniaczami, np. chloranami (głównie potasu o- raz sodu) tworzy mieszaninę zdolną przy odpowiednich warunkach do gwałtownego palenia.
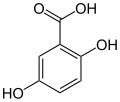 6) Kwas gentyzynowy - jest to organiczny związek chemiczny z grupy kwasów fenolowych, dihydroksypochodna kwasu benzoesowego, występuje w goryczce oraz w moczu psów po spożyciu salicylanów. Jest także metabolitem Penicillium patulum i Polyporus tumulosus. Może być otrzymywany z hydrochinonu, z kwasu 5-bromo-2-hydroksybenzoesowego oraz poprzez utlenianie kwasu salicylowego nadsiarczanem potasu i w reakcji Kolbego.
6) Kwas gentyzynowy - jest to organiczny związek chemiczny z grupy kwasów fenolowych, dihydroksypochodna kwasu benzoesowego, występuje w goryczce oraz w moczu psów po spożyciu salicylanów. Jest także metabolitem Penicillium patulum i Polyporus tumulosus. Może być otrzymywany z hydrochinonu, z kwasu 5-bromo-2-hydroksybenzoesowego oraz poprzez utlenianie kwasu salicylowego nadsiarczanem potasu i w reakcji Kolbego. 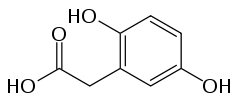 7) Kwas homogentyzynowy - jest to związek chemiczny z grupy kwasów karboksylowych, produkt pośredni w metabolizmie aminokwasów. Powstaje w nadmiernych ilościach w alkaptonurii (ochronozie) - genetycznie uwarunkowanym defekcie enzymatycznym. Kwas homogentyzynowy jest jednym z metabolitów przemian aminokwasów (fenyloalanina, tyrozyna). Niedobór enzymu - oksydazy homogentyzynianowej powoduje, że gromadzi się w tkankach chorej osoby, wywołując alkaptonurię. Ma powinowactwo do tkanki łącznej i chrząstki z biegiem czasu prowadzi do uszkodzeń układu kostno-stawowego. Pod wpływem tlenu atmosferycznego utlenia się i ciemnieje, co jest łatwo widoczne w pozostawionym na powietrzu moczu chorego.
7) Kwas homogentyzynowy - jest to związek chemiczny z grupy kwasów karboksylowych, produkt pośredni w metabolizmie aminokwasów. Powstaje w nadmiernych ilościach w alkaptonurii (ochronozie) - genetycznie uwarunkowanym defekcie enzymatycznym. Kwas homogentyzynowy jest jednym z metabolitów przemian aminokwasów (fenyloalanina, tyrozyna). Niedobór enzymu - oksydazy homogentyzynianowej powoduje, że gromadzi się w tkankach chorej osoby, wywołując alkaptonurię. Ma powinowactwo do tkanki łącznej i chrząstki z biegiem czasu prowadzi do uszkodzeń układu kostno-stawowego. Pod wpływem tlenu atmosferycznego utlenia się i ciemnieje, co jest łatwo widoczne w pozostawionym na powietrzu moczu chorego.  8) Kwas 3-hydroksybenzoesowy - jest to związek z grupy kwasów monohydroksybenzoesowych. Występuje on naturalnie w kastoreum - wydzielinie łojowej bobra kanadyjskiego (Castor canadensis) i bobra europejskiego (Castor fiber), używanej w perfumerii. Kastoreum zwane strójem bobrowym to żółtawa wydzielina gruczołów skórnych bobra - aromatycznym składnikiem owej substancji jest przede wszystkim kastoramina. Służy tym zwierzetom do natłuszczania futra i - w połączeniu z moczem - do znaczenia swego terytorium. Bobry obu płci mają parę gruczołów, znajdujących się w dwóch wnękach pod skórą między miednicą a nasadą ogona, oraz parę worków, w których gromadzi się ich wydzielina. Aby zwiększyć ilość pozyskiwanej wydzieliny przenosi się zapachy z jednych żeremi do drugich, samiec bobra instynktownie pokrywa obcy zapach własnym, produkując dużą ilość wydzieliny do specjalnie przygotowanych zbiorniczków. Kasotreum uzyskuje się przez ekstrakcję tych wydzielin, a także przez macerację (wyodrębnianie wybranych składników z materiału, np. surowca roślinnego, poprzez moczenie go w rozpuszczalniku, najczęściej wodzie) wysuszonych gruczołów, w których powstaje wydzielina. Gruczoły mają masę ok. 100 gram Po wysuszeniu są ciemne, twarde i dają się łatwo rozdrobnić. Poprzez odpowiednie odbranie technologii można uzyskać tinkturę, absolut, lub poprzez zastosowanie ekstrakcji alkoholem na gorąco - rezynoid Roztwory kasoreum, podobnie jak ambra, są utrwalaczami zapachu w perfumach oraz stanowią dodatek zapachowy do mydeł i pudrów. Kwas 3-hydroksybenzoesowy został też zidentyfikowany jako jeden z produktów metabolizmu kwasu 3-chlorobenzoesowego (składnika niektórych herbicydów) przez bakterie glebowe z rodzaju Pseudomonas.
8) Kwas 3-hydroksybenzoesowy - jest to związek z grupy kwasów monohydroksybenzoesowych. Występuje on naturalnie w kastoreum - wydzielinie łojowej bobra kanadyjskiego (Castor canadensis) i bobra europejskiego (Castor fiber), używanej w perfumerii. Kastoreum zwane strójem bobrowym to żółtawa wydzielina gruczołów skórnych bobra - aromatycznym składnikiem owej substancji jest przede wszystkim kastoramina. Służy tym zwierzetom do natłuszczania futra i - w połączeniu z moczem - do znaczenia swego terytorium. Bobry obu płci mają parę gruczołów, znajdujących się w dwóch wnękach pod skórą między miednicą a nasadą ogona, oraz parę worków, w których gromadzi się ich wydzielina. Aby zwiększyć ilość pozyskiwanej wydzieliny przenosi się zapachy z jednych żeremi do drugich, samiec bobra instynktownie pokrywa obcy zapach własnym, produkując dużą ilość wydzieliny do specjalnie przygotowanych zbiorniczków. Kasotreum uzyskuje się przez ekstrakcję tych wydzielin, a także przez macerację (wyodrębnianie wybranych składników z materiału, np. surowca roślinnego, poprzez moczenie go w rozpuszczalniku, najczęściej wodzie) wysuszonych gruczołów, w których powstaje wydzielina. Gruczoły mają masę ok. 100 gram Po wysuszeniu są ciemne, twarde i dają się łatwo rozdrobnić. Poprzez odpowiednie odbranie technologii można uzyskać tinkturę, absolut, lub poprzez zastosowanie ekstrakcji alkoholem na gorąco - rezynoid Roztwory kasoreum, podobnie jak ambra, są utrwalaczami zapachu w perfumach oraz stanowią dodatek zapachowy do mydeł i pudrów. Kwas 3-hydroksybenzoesowy został też zidentyfikowany jako jeden z produktów metabolizmu kwasu 3-chlorobenzoesowego (składnika niektórych herbicydów) przez bakterie glebowe z rodzaju Pseudomonas. - 9) Kwas 5-hydroksyindolooctowy - produkt metabolizmu tryptofanu i rozpadu serotoniny. Stosowany jest przy oznaczaniu poziomu serotoniny w organizmie.
 10) Kwas karminowy (koszenila) - jest to organiczny związek chemiczny, naturalny ciemnoczerwony barwnik pozyskiwany z wysuszonych, zmielonych owadów, zwanych czerwcami kaktusowymi (Dactulopius coccus), żyjących w Meksyku. Od starożytności aż po XVI wiek uzyskiwano go także z czerwców polskich (Porphyrophora polonica). Jest jednym z nielicznych rozpuszczalnych w wodzie naturalnych barwników, które nie ulegają degradacji z upływem czasu. Jest najbardziej odporny na działanie światła, podwyższonej temperatury i utlenianie spośród wszystkich naturalnych barwników, a nawet bardziej trwały niż niektóre barwniki syntetyczne. Ekstrakt koszenili to ciemnoczerwony płyn, a po wysuszeniu - proszek. Produkt handlowy barwnika występuje w połączeniu z kationami amonu, wapnia, sodu i potasu, pojedynczo lub w kombinacjach. Może także zawierać materiał białkowy pochodzący z innych owadów. Czerwce do produkcji koszenili zabija się przez wystawienie na działanie wysokiej temperatury. Można to robić na wiele sposobów (np. zanurzenie w gorącej wodzie, wystawienie na działanie światła słonecznego, pary wodnej czy podwyższonej temperatury w cieplarce), uzyskując w ten sposóļ różną barwę produktu. Inaczej wyglądała produkcja tego barwnika w Polsce. Polska koszenila stosowana była na szeroką skalę w przemyśle tekstylnym do połowy XIX wieku. Wytwarzano ją z innego gatunku owadów - czerwców polskich (Porphyrophora polonica).
10) Kwas karminowy (koszenila) - jest to organiczny związek chemiczny, naturalny ciemnoczerwony barwnik pozyskiwany z wysuszonych, zmielonych owadów, zwanych czerwcami kaktusowymi (Dactulopius coccus), żyjących w Meksyku. Od starożytności aż po XVI wiek uzyskiwano go także z czerwców polskich (Porphyrophora polonica). Jest jednym z nielicznych rozpuszczalnych w wodzie naturalnych barwników, które nie ulegają degradacji z upływem czasu. Jest najbardziej odporny na działanie światła, podwyższonej temperatury i utlenianie spośród wszystkich naturalnych barwników, a nawet bardziej trwały niż niektóre barwniki syntetyczne. Ekstrakt koszenili to ciemnoczerwony płyn, a po wysuszeniu - proszek. Produkt handlowy barwnika występuje w połączeniu z kationami amonu, wapnia, sodu i potasu, pojedynczo lub w kombinacjach. Może także zawierać materiał białkowy pochodzący z innych owadów. Czerwce do produkcji koszenili zabija się przez wystawienie na działanie wysokiej temperatury. Można to robić na wiele sposobów (np. zanurzenie w gorącej wodzie, wystawienie na działanie światła słonecznego, pary wodnej czy podwyższonej temperatury w cieplarce), uzyskując w ten sposóļ różną barwę produktu. Inaczej wyglądała produkcja tego barwnika w Polsce. Polska koszenila stosowana była na szeroką skalę w przemyśle tekstylnym do połowy XIX wieku. Wytwarzano ją z innego gatunku owadów - czerwców polskich (Porphyrophora polonica).  11) Kwas kawowy (kwas 3,4-dihydroksycynamonowy) - jest to organiczny związek chemiczny z grupy kwasów fenolowych. Występuje w roślinach np. jemiole pospolitej (Viscum album), glistniku jaskółczym zielu (Chelidonium maius). Posiada właściwości przeciwzapalne, żółciopędne, immunostymulacyjne, przeciwmiaż
11) Kwas kawowy (kwas 3,4-dihydroksycynamonowy) - jest to organiczny związek chemiczny z grupy kwasów fenolowych. Występuje w roślinach np. jemiole pospolitej (Viscum album), glistniku jaskółczym zielu (Chelidonium maius). Posiada właściwości przeciwzapalne, żółciopędne, immunostymulacyjne, przeciwmiaż- dżycowe, antyagregacyjne, fungistatyczne (hamujące wzrost grzybów) i bakteriostatyczne.
 12) Kwas kumarowy - jest to związekz grupy kwasów fenolowych, pochodna kwasu cynamonowego. Ze względu na położenie grupy hydroksylowej można wyróżnić trzy izomery: orto, meta i para. Izomer para jest izomerem najbardziej rozpowszechnionym w przyrodzie. Kwas kumarowy jest jednym z głównym budulców lignocelulozy. Znajduje się w wielu gatunkach roślin, m.in. orzeszkach ziemnych, pomidorach, marchwii i czosnku. Ma własności przeciwutleniające. Uważa się, że zmniejsza ryzyko wystąpienia raka żołądka przez ograniczenie powstawania nitroamin.
12) Kwas kumarowy - jest to związekz grupy kwasów fenolowych, pochodna kwasu cynamonowego. Ze względu na położenie grupy hydroksylowej można wyróżnić trzy izomery: orto, meta i para. Izomer para jest izomerem najbardziej rozpowszechnionym w przyrodzie. Kwas kumarowy jest jednym z głównym budulców lignocelulozy. Znajduje się w wielu gatunkach roślin, m.in. orzeszkach ziemnych, pomidorach, marchwii i czosnku. Ma własności przeciwutleniające. Uważa się, że zmniejsza ryzyko wystąpienia raka żołądka przez ograniczenie powstawania nitroamin. 
| Nazwa | Numer CAS | Struktura |
|---|---|---|
| Kwas o-kumarowy | 614-60-8 | 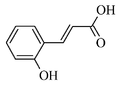 |
| Kwas m-kumarowy | 621-54-5 |  |
| Kwas p-kumarowy | 501-98-4 |  |

 14) Mesalazyna (kwas 5-aminosalicylowy) - jest to organiczny związek chemiczny, aminowa pochodna kwasu salicylowego. Stosowany jest jako niestroidowy lek przeciwzapalny, głównie w leczeniu wrzodziejącego zapalenia jelita grubego i choroby Leśniowskiego-Crohna. Mechanizm działania mesalazyny polega na hamowaniu syntezy prostaglandyny PGE2, prostacykliny PGL2, tromboksanu A2 oraz leukotrienu B4. Ponadto bierze udział w hamowaniu reakcji utleniania w błonie śluzowej okrężnicy. Lek jest zwykle dobrze tolerowany, jednak nie można zupełnie wykluczyć działanie ogólnego, bo niewielka część tego kwasu dostaje się z jelit do krwiobiegu.
14) Mesalazyna (kwas 5-aminosalicylowy) - jest to organiczny związek chemiczny, aminowa pochodna kwasu salicylowego. Stosowany jest jako niestroidowy lek przeciwzapalny, głównie w leczeniu wrzodziejącego zapalenia jelita grubego i choroby Leśniowskiego-Crohna. Mechanizm działania mesalazyny polega na hamowaniu syntezy prostaglandyny PGE2, prostacykliny PGL2, tromboksanu A2 oraz leukotrienu B4. Ponadto bierze udział w hamowaniu reakcji utleniania w błonie śluzowej okrężnicy. Lek jest zwykle dobrze tolerowany, jednak nie można zupełnie wykluczyć działanie ogólnego, bo niewielka część tego kwasu dostaje się z jelit do krwiobiegu.  15) Kwas protokatechowy - jest to organiczny związek chemiczny z grupy kwasów fenolowych. Występuje w śladowych ilościach w ziarnach (suchy, niepękający owoc traw będący jednonasienną niełupką) i siewkach pszenicy i w innch roślinach. Kwas protokatechowy można otrzymać w reakcji waniliny z wodnym roztworem wodorotlenku sodu lub potasu w podwyższonej temperaturze. Do mieszaniny poreakcyjnej zawierającej sól kwasu protokatechowego dodaje się nastepnie kwas solny, a całość oczyszcza.
15) Kwas protokatechowy - jest to organiczny związek chemiczny z grupy kwasów fenolowych. Występuje w śladowych ilościach w ziarnach (suchy, niepękający owoc traw będący jednonasienną niełupką) i siewkach pszenicy i w innch roślinach. Kwas protokatechowy można otrzymać w reakcji waniliny z wodnym roztworem wodorotlenku sodu lub potasu w podwyższonej temperaturze. Do mieszaniny poreakcyjnej zawierającej sól kwasu protokatechowego dodaje się nastepnie kwas solny, a całość oczyszcza. 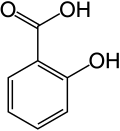 16) Kwas salicylowy (łac. acidum salicylicum) - jest to organiczny związek chemiczny z grupy aromatycznych hydroksykwasów karboksylowych. Zawiera on jedną grupę hydroksylową i jedną grupę karboksylową przyłączone do pierścienia benzenowego w układzie orto. Kwas salicylowy po raz pierwszy został otrzymany przez wyodrębnienie go z kory wierzby (łac. Salix, stąd nazwa). Metoda syntezy chemicznej została wynaleziona przypadkowo przez niemieckiego chemika Hermanna Kolbego. W 1859 roku rozpoczął on poszukiwania sposobu taniej, chemicznej syntezy indyga (barwnika). Otrzymany ze smoły pogazowej fenol umieścił w zamkniętym naczyniu z dwutlenkiem węgla i mieszaninę tę ogrzewał. W wyniku tej reakcji zamiast oczekiwanego granatowego barwnika otrzymał kwas salicylowy:
16) Kwas salicylowy (łac. acidum salicylicum) - jest to organiczny związek chemiczny z grupy aromatycznych hydroksykwasów karboksylowych. Zawiera on jedną grupę hydroksylową i jedną grupę karboksylową przyłączone do pierścienia benzenowego w układzie orto. Kwas salicylowy po raz pierwszy został otrzymany przez wyodrębnienie go z kory wierzby (łac. Salix, stąd nazwa). Metoda syntezy chemicznej została wynaleziona przypadkowo przez niemieckiego chemika Hermanna Kolbego. W 1859 roku rozpoczął on poszukiwania sposobu taniej, chemicznej syntezy indyga (barwnika). Otrzymany ze smoły pogazowej fenol umieścił w zamkniętym naczyniu z dwutlenkiem węgla i mieszaninę tę ogrzewał. W wyniku tej reakcji zamiast oczekiwanego granatowego barwnika otrzymał kwas salicylowy:
Doświadczenie to było jednym z pierwszych dowodów obalających hipotezę istnienia siły życiowej (łac. vis vitalis), dowodziło bowiem możliwości otrzymania ze składników mineralnych (za takie uważany był wówczas fenol i CO2) związku organicznego. Odkrycie Kolbego uważa się również za początek chemicznego przemysłu farmaceutycznego, gdyż kwas salicylowy był pierwszym lekiem wytwarzanym na skalę przemysłową na drodze syntezy chemicznej. Dziś reakcję tę nazywa się reakcją Kolbego. Przebiega ona pod zwiększonym ciśnieniem w temperaturze 130 stopni Celsjusza.
REAKCJA KOLBEGO - INFORMACJE, ŹRÓDŁO: WIKIPEDIA:
 |
| Źródło: Wikipedia. Wierzba biała to naturalne źródło kwasu salicylowego. |
 17) Sulfasalazyna (salazosulfapirydyna) - jest to wielofunkcyjny związek chemiczny z grupy sulfonamidów. Zawiera resztę mesalazyny (kwasu 5-aminosalicylowego) sprzężoną z resztą amidu kwasu sulfanilowego w postaci pochodnej azowej. Część amidową tworzą 2-aminopirydyna. Stosowana jest jako lek o działaniu przeciwzapalnym i przeciwreumatycznym. Wchłania się ona z przewodu pokarmowego, gdzie najpierw rozpada się na kwas 5-aminosalicylowy i sulfapirydynę. Jej mechanizm działania nie jest do końca poznany, ale wiąże się go z hamowaniem miejscowej jelitowej produkcji prostaglandyny PGE2, leukotrienów i zwiększeniu produkcji immunoglobuliny IgA i IgG.
17) Sulfasalazyna (salazosulfapirydyna) - jest to wielofunkcyjny związek chemiczny z grupy sulfonamidów. Zawiera resztę mesalazyny (kwasu 5-aminosalicylowego) sprzężoną z resztą amidu kwasu sulfanilowego w postaci pochodnej azowej. Część amidową tworzą 2-aminopirydyna. Stosowana jest jako lek o działaniu przeciwzapalnym i przeciwreumatycznym. Wchłania się ona z przewodu pokarmowego, gdzie najpierw rozpada się na kwas 5-aminosalicylowy i sulfapirydynę. Jej mechanizm działania nie jest do końca poznany, ale wiąże się go z hamowaniem miejscowej jelitowej produkcji prostaglandyny PGE2, leukotrienów i zwiększeniu produkcji immunoglobuliny IgA i IgG. 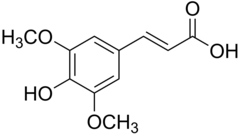 18) Kwas synapinowy (kwas synapowy) - jest to organiczny związek chemiczny, pochodna kwasu i kumarowego z dwiema grupami metoksylowymi (-OCH3) w pozycjach orto i meta. Układ podstawników pierścienia aromatycznego ma taki sam, jak kwas syryngowy. Występuje w gorczycy (Sinapis), czartawie (Circaea), brokułach oraz innych roślinach. Stosowany może on być w leczeniu stwardnienia rozsianego (SM).
18) Kwas synapinowy (kwas synapowy) - jest to organiczny związek chemiczny, pochodna kwasu i kumarowego z dwiema grupami metoksylowymi (-OCH3) w pozycjach orto i meta. Układ podstawników pierścienia aromatycznego ma taki sam, jak kwas syryngowy. Występuje w gorczycy (Sinapis), czartawie (Circaea), brokułach oraz innych roślinach. Stosowany może on być w leczeniu stwardnienia rozsianego (SM). 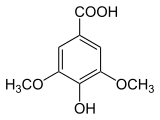 19) Kwas syryngowy - jest to pochodna kwasu galusowego. Ma działanie antybakteryjne i przeciwutleniające. Występuje m.in. w konyzie kanadyjskiej (Conyza canadensis), kasztanie japońskim (Castanea crenata), rdeście wężowniku (Polygonum bistorta), Aristolochia fangchi, Knoxia valerianoides, babce lancetowatej (Plantago lanceolata) oraz miodzie z manuki (Leptospermum scoparium). Otrzymywany syntetycznie przez selektywną, częściową demetylację kwasu 3,4,5-trimetoksybenzoesowego za pomocą dymiącego kwasu siarkowego lub jodku magnezu. Ogrzewany powyżej 250 stopni Celsjusza ulega dekarboksylacji do pirogalolu.
19) Kwas syryngowy - jest to pochodna kwasu galusowego. Ma działanie antybakteryjne i przeciwutleniające. Występuje m.in. w konyzie kanadyjskiej (Conyza canadensis), kasztanie japońskim (Castanea crenata), rdeście wężowniku (Polygonum bistorta), Aristolochia fangchi, Knoxia valerianoides, babce lancetowatej (Plantago lanceolata) oraz miodzie z manuki (Leptospermum scoparium). Otrzymywany syntetycznie przez selektywną, częściową demetylację kwasu 3,4,5-trimetoksybenzoesowego za pomocą dymiącego kwasu siarkowego lub jodku magnezu. Ogrzewany powyżej 250 stopni Celsjusza ulega dekarboksylacji do pirogalolu.  20) Tyrozyna (Tyr lub Y) - organiczny związek chemiczny. Stereoizomer L jest jednym z 20 podstawowych aminokwasów białkowych. Nazwa tyrozyna pochodzi od gr. tyros - ser. Łańcuch boczny tyrozyny stanowi niepolarny pierścień aromatyczny z przyłączoną w pozycji "para" grupą hydroksylową (-OH), połączony z atomem węgla alfa przez mostek metylenowy. Tyrozyna spełnia ważne biologicznie zadanie jako wewnątrzkomórkowy przekaźnik (może być fosforylowana przez kinazy białkowe), a także jest prekursorem ważnych hormonów i biologicznie czynnych substancji (tyroksyna, trójjodotyronina, adrenalina, noradrenalina oraz dopamina). Jest on aminokwasem endogennym, tzn. organizm ludzki oraz większość zwierząt jest w stanie syntetyzować go pod warunkiem dostatecznego zaopatrzenia w fenyloalaninę, od której tyrozyna różni się obecnością jednej grupy hydroksylowej. Tyrozynę można też traktować jako pochodną fenyloetyloaminy, aczkolwiek w biochemicznych cyklach syntetycznych nie powstaje ona z tego związku. W praktyce laboratoryjnej również nie produkuje się jej z fenyloetyloaminy, gdyż prościej można ją otrzymać przez hydrolizę odpowiednich białek. Tyrozyna jest bardzo istotna dla prawidłowego funkcjonowania tarczycy i przysadki mózgowej. Brak tego aminokwasu wywołuje niedoczynność tarczycy, co może objawiać się w postaci zmęczenia i wyczerpania. Zmniejszenie ilości tyrozyny w organizmie powoduje niedobór norepinefryny i dopaminy, co może wywoływać depresję.
20) Tyrozyna (Tyr lub Y) - organiczny związek chemiczny. Stereoizomer L jest jednym z 20 podstawowych aminokwasów białkowych. Nazwa tyrozyna pochodzi od gr. tyros - ser. Łańcuch boczny tyrozyny stanowi niepolarny pierścień aromatyczny z przyłączoną w pozycji "para" grupą hydroksylową (-OH), połączony z atomem węgla alfa przez mostek metylenowy. Tyrozyna spełnia ważne biologicznie zadanie jako wewnątrzkomórkowy przekaźnik (może być fosforylowana przez kinazy białkowe), a także jest prekursorem ważnych hormonów i biologicznie czynnych substancji (tyroksyna, trójjodotyronina, adrenalina, noradrenalina oraz dopamina). Jest on aminokwasem endogennym, tzn. organizm ludzki oraz większość zwierząt jest w stanie syntetyzować go pod warunkiem dostatecznego zaopatrzenia w fenyloalaninę, od której tyrozyna różni się obecnością jednej grupy hydroksylowej. Tyrozynę można też traktować jako pochodną fenyloetyloaminy, aczkolwiek w biochemicznych cyklach syntetycznych nie powstaje ona z tego związku. W praktyce laboratoryjnej również nie produkuje się jej z fenyloetyloaminy, gdyż prościej można ją otrzymać przez hydrolizę odpowiednich białek. Tyrozyna jest bardzo istotna dla prawidłowego funkcjonowania tarczycy i przysadki mózgowej. Brak tego aminokwasu wywołuje niedoczynność tarczycy, co może objawiać się w postaci zmęczenia i wyczerpania. Zmniejszenie ilości tyrozyny w organizmie powoduje niedobór norepinefryny i dopaminy, co może wywoływać depresję. 
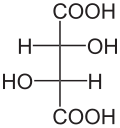






Świetnie napisane. Pozdrawiam serdecznie.
OdpowiedzUsuń