INFORMACJA WSTĘPNA: Wytłumaczenie czym są hormony roślinne warto rozpocząć od porównania owych cząsteczek, w istocie będących pod względem funkcji regulatorami wzrostu i rozwoju roślin z typowymi hormonami zwierzęcymi. Czy w ogóle te cząsteczki, które wytwarzane są w roślinach i regulują ich metabolizm zasługują na miano "hormonów"? Co wspólnego mają z hormonami zwierzęcymi, a czym się różnią? Takie pytania stawiać należy celem zrozumienia istotnej różnicy pomiędzy tymi obydwiema grupami sygnalizatorów biochemicznych.
Widzimy zatem iż istnieje wiele różnic pomiędzy hormonami roślinnymi i zwierzęcymi. Przede wszystkim hormony roślinne nie wykazują działania specyficznego w przeciwieństwie do hormonów zwierzęcych - jest to bardzo istotna różnica. Nie są ponadto produkowane w specjalnych strukturach zwanych gruczołami - często jeden hormon roślinny może produkowany być w zasadzie w całej roślinie. Może następować transport hormonu roślinnego w roślinie, ale nie musi, bo hormony roślinne mogą działać lokalnie. Te wszystkie różnice wymienione powyżej są bardzo ważne i warto pamiętać je przygotowując się do Egzaminu Maturalnego z Biologii. Zdefiniujmy teraz hormony roślinne, wymieńmy ich cechy, przedstawmy ogólny schemat działania i przejdźmy do omówienia poszczególnych grup regulatorów wzrostu i rozwoju roślin.
Hormony roślinne (czyli Fitohormony) stanowią grupę organicznych związków, które należą do regulatorów wzrostu oraz rozwoju roślin. Kryterium uznania związku za fitohormon jest wywoływanie reakcji w organizmie rośliny w stężenia rzędu 10-6 mol dm-3 lub mniejszych. Hormony roślinne nie muszą wykazywać działania poza miejscem ich wytwarzania, miejsce wytwarzania może być jednocześnie miejscem reakcji. Znane są związki wykazujące aktywność biologiczną analogiczną do tych, które są naturalnie wytwarzane w roślinie.
CECHY FITOHORMONÓW:
1) Hormon wiąże się ze specyficznym receptorem białkowym znajdującym się na powierzchni błony komórkowej (lub w komórce). Każdy receptor o charakterystycznej strukturze przestrzennej może wiązać cząsteczki tylko określonego hormonu.
2) Przyłączenie hormonu aktywuje białko G w błonie komórkowej, po czym białko to wyzwala produkcję wtórnego przekaźnika (wewnątrzkomórkowej cząsteczki sygnałowej wpływającej na funkcje komórki, np. Ca2+,
3) Wzrost stężenia jonów Ca2+ lub innego wtórnego przekaźnika może prowadzić do interakcji z określonym białkiem i w konsekwencji do aktywacji (lub inaktywacji) niektórych enzymów, np. kinaz białkowych,
4) Enzymy te katalizują fosforylację specyficznych białek, które w pewien sposób zmieniają aktywność metaboliczną komórki, np. zmieniają przepuszczalność błon i (lub) ekspresję określonych genów.
 |
| Źródło: https://slideplayer.pl/slide/404932/ - Porównanie hormonów roślinnych i zwierzęcych. |
Hormony roślinne (czyli Fitohormony) stanowią grupę organicznych związków, które należą do regulatorów wzrostu oraz rozwoju roślin. Kryterium uznania związku za fitohormon jest wywoływanie reakcji w organizmie rośliny w stężenia rzędu 10-6 mol dm-3 lub mniejszych. Hormony roślinne nie muszą wykazywać działania poza miejscem ich wytwarzania, miejsce wytwarzania może być jednocześnie miejscem reakcji. Znane są związki wykazujące aktywność biologiczną analogiczną do tych, które są naturalnie wytwarzane w roślinie.
CECHY FITOHORMONÓW:
- związki oligodynamiczne (syntetyzowane w małych ilościach, ale o dużej aktywności fizjologicznej),
- działanie plejotropowe (jeden czynnik ma więcej niż jeden efekt),
OGÓLNY SCHEMAT DZIAŁANIA HORMONÓW ROŚLINNYCH:
1) Hormon wiąże się ze specyficznym receptorem białkowym znajdującym się na powierzchni błony komórkowej (lub w komórce). Każdy receptor o charakterystycznej strukturze przestrzennej może wiązać cząsteczki tylko określonego hormonu.
2) Przyłączenie hormonu aktywuje białko G w błonie komórkowej, po czym białko to wyzwala produkcję wtórnego przekaźnika (wewnątrzkomórkowej cząsteczki sygnałowej wpływającej na funkcje komórki, np. Ca2+,
3) Wzrost stężenia jonów Ca2+ lub innego wtórnego przekaźnika może prowadzić do interakcji z określonym białkiem i w konsekwencji do aktywacji (lub inaktywacji) niektórych enzymów, np. kinaz białkowych,
4) Enzymy te katalizują fosforylację specyficznych białek, które w pewien sposób zmieniają aktywność metaboliczną komórki, np. zmieniają przepuszczalność błon i (lub) ekspresję określonych genów.
PRZYKŁADY HORMONÓW ROŚLINNYCH:
1) ETEN (Etylen):
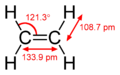 Jest on najprostszym dotychczas poznanym hormonem roślinnym, a jednocześnie najprostszym możliwym alkenem (węglowodorem nienasyconym z obecnym wiązaniem podwójnym w łańcuchu węglowym). Ma wzór C2H4. Występuje w stanie gazowym. Odgrywa on istotną rolę w funkcjonowaniu rośliny na wszystkich etapach jej rozwoju. Wpływa m.in. na kiełkowanie nasion, wzrost, starzenie roślin i dojrzewanie owoców. Bierze udział również w reakcjach rośliny na różne biotyczne, jak i abiotyczne czynniki środowiskowe.
Jest on najprostszym dotychczas poznanym hormonem roślinnym, a jednocześnie najprostszym możliwym alkenem (węglowodorem nienasyconym z obecnym wiązaniem podwójnym w łańcuchu węglowym). Ma wzór C2H4. Występuje w stanie gazowym. Odgrywa on istotną rolę w funkcjonowaniu rośliny na wszystkich etapach jej rozwoju. Wpływa m.in. na kiełkowanie nasion, wzrost, starzenie roślin i dojrzewanie owoców. Bierze udział również w reakcjach rośliny na różne biotyczne, jak i abiotyczne czynniki środowiskowe.
Eten jest gazem bezbarwnym, o słodkawym zapachu. Jest substancją łatwopalną. Rozpuszcza się bardzo dobrze w rozpuszczalnikach niepolarnych np. arenach i alkanach. Jest to cząsteczka płaska, symetryczna, a kąty pomiędzy wiązaniami (H-C-H) wynoszą 120 stopni. Długości wiązania w tej cząsteczce wynoszą odpowiednio: pomiędzy atomem węgla a atomami wodoru 110 pm, a pomiędzy atomami węgla 134 pm. W wyniku hybrydyzacji orbitali sp2 w obu atomach węgla, pomiędzy nimi występuje jedno wiązanie Pi i jedno wiązanie Sigma. Ulega reakcjom addycji, utlenienia i polimeryzacji. W mieszaninie z powietrzem jest wybuchowy w granicach stężeń 2,75-28,6% oraz podczas ogrzewania pod zwiększonym ciśnieniem.
ETYLEN STYMULUJE:
- dojrzewanie owoców,
 |
| Źródło: https://notatek.pl/wyklad-7-fizjologia-rozwoju-roslin - Zmiany zachodzące podczas dojrzewania owoców klimakterycznych. |
- starzenie się tkanek, organów i całej rośliny,
- wzrost na grubość:
 |
| Źródło: https://notatek.pl/wyklad-7-fizjologia-rozwoju-roslin - Stymulacja wzrostu na grubość rośliny przez etylen. |
- tworzenie warstwy odcinającej i odpadanie organów,
- epinastię liści (proces szczególnie widoczny u roślin których korzenie są zalewane wodą),
- indukuje formowanie włośników,
- odgrywa pewną rolę w obronie przed patogenami i w stresach abiotycznych, np. stresie oksydacyjnym,
- indukuje tworzenie aerenchymy w korzeniach zalewanych wodą
ETYLEN HAMUJE:
- elongacje pędu,
- przedłuża utrzymanie liścieni w kształcie haczyka (patrz: hamuje zmianę ich kształtu)
PRAKTYCZNE ZASTOSOWANIE ETYLENU:
- przyspieszanie dojrzewania owoców: jabłek, bananów, pomidorów, odzieleniania cytryn,
- indukcja równoczesnego opadania niektórych owoców,
- defoliacja (pozbawianie rośliny liści)
ETYLEN W BIOCHEMII: Etylen jest hormonem roślinnym, stymulującym opadanie liści, dojrzewanie owoców, starzenie się roślin. Wydzielany jest przez praktycznie wszystkie części rośliny.
CYKL YANGA:

BIOSYNTEZA ETYLENU: 1- syntaza SAM; 2 - syntaza ACC; 3 - Oksydaza ACC; 4 - ACC N-malonylotransferaza, 5- nuklozydaza metyliotioadenozyny; 6 - kinaza metylotiorybozy, S - reakcja spontaniczna; 7 - transaminazza, ACC - kwas 1-aminocyklopropano-1-karboksylowy.
Biosynteza etylenu przebiega w kilku etapach. Substratem jest metionina, która jest przekształcana w S-adenozylometioninę (SAM) przez enzym o nazwie syntaza SAM. Następnie SAM jest przekształcana w kwas 1-aminocyklopropano-1-karboksylowy (ACC) przez syntazę ACC (ACS), natomiast metionina jest regenerowana w cyklu Yanga (Cykl Yanga przedstawia schemat powyżej, to jest cykl w którym regenerowana jest Metionina i wystepuje ona jako początkowy substrat) Ostatnim etapem jest konwersja ACC do etylenu przez oksydazę ACC (ACO), gdzie ACC jest utleniany przy udziale oksydazy ACC do etylenu oraz dwutlenku węgla i cyjanowodoru.
 |
| Źródło: www.wolffund.org.il - Shang Fa Yang. |
Shang Fa Yang ( chiński : 楊祥 發 ; pinyin : Yáng Xiángfā ; 10 listopada 1932 - 12 lutego 2007) był tajwańsko-amerykańskim naukowcem i profesorem na University of California w Davis . Został odznaczony Wolf Prize w rolnictwie i wybrany członkiem Narodowej Akademii Nauk USA .Yang był znany ze swoich badań, które odblokowały klucz do przedłużenia świeżości owoców i kwiatów. Jego badania koncentrowały się na tym, jak rośliny wytwarzają etylen , co jest ważne w regulowaniu wielu funkcji roślin, od kiełkowania nasion do dojrzewania owoców. Zbadał ścieżkę biosyntezy etylenu i jednoznacznie udowodnił centralną rolę metioniny jako prekursora etylenu. Odkrywa, że proces ten jest cykliczny i dlatego otrzymuje nazwę „Cykl Yang”. Etylen stanowi jeden z pięciu głównych hormonów wpływających na rozwój i dojrzewanie roślin. Był pierwszym naukowcem, który zgłosił S-adenozylometioninę jako związek pośredni w konwersji metioniny do etylenu. Następnie w 1979 r. Odkrył kwas aminokarbopropano-1-karboksylowy (ACC) jako półprodukt. Jego odkrycie syntazy ACC otworzyło drogę do zrozumienia procesu regulującego biosyntezę etylenu. Więcej informacji na temat działalności badawczej Yanga znajdziesz: tutaj (klik!).
 ZASTOSOWANIE ETYLENU: W przechowalniach owoców skuteczne usuwanie etylenu wydzielanego przez owoce zapobiega ich przedwczesnemu dojrzewaniu. Natomiast przed sprzedażą owoce poddaje się działaniu etylenu w celu szybkiego doprowadzenia ich do stanu dojrzałości. Takiemu zabiegowi standardowo poddaje się banany, które zbierane są zielone, w stadium dojrzałości zbiorczej i po dotarciu na miejsce przeznaczenia dla uzyskania jednolitych jakościowo owoców poddane są zabiegowi gazowania etylenem przez okres 4-7 dni. Przedwczesnemu dojrzewaniu zapobiega się blokując działanie etylenu za pomocą 1-Metylocyklopropenu.
ZASTOSOWANIE ETYLENU: W przechowalniach owoców skuteczne usuwanie etylenu wydzielanego przez owoce zapobiega ich przedwczesnemu dojrzewaniu. Natomiast przed sprzedażą owoce poddaje się działaniu etylenu w celu szybkiego doprowadzenia ich do stanu dojrzałości. Takiemu zabiegowi standardowo poddaje się banany, które zbierane są zielone, w stadium dojrzałości zbiorczej i po dotarciu na miejsce przeznaczenia dla uzyskania jednolitych jakościowo owoców poddane są zabiegowi gazowania etylenem przez okres 4-7 dni. Przedwczesnemu dojrzewaniu zapobiega się blokując działanie etylenu za pomocą 1-Metylocyklopropenu.
POTRÓJNA ODPOWIEDŹ U ROŚLIN: Etylen jest odpowiedzialny za tzw. potrójną odpowiedź u roślin. Gdy nasiono kiełkuje i napotyka przeszkodę, musi wykonać manewr, aby ją ominąć. Etylen stymuluje grubienie łodygi, zmniejszenie elongacji i wykrzywienie się rośliny, tak by ta mogła przedostać się na powierzchnię. Zanim poznano rolę etylenu w tym procesie naukowcy obserwowali, że siewki grochu rosnące w laboratorium ogrzewanym piecem węglowym, wykazywały zachowania, które później określono mianem odpowiedzi potrójnej.
 |
| Źródło: https://notatek.pl/wyklad-7-fizjologia-rozwoju-roslin - Odpowiedź potrójna. |
 |
| Źródło: https://notatek.pl/wyklad-7-fizjologia-rozwoju-roslin - Odpowiedź potrójna u Arabidopsis thaliana. |
Do badań i wykorzystywania etylenu w praktyce stosuje się: etefon inaczej zwany etrelem. Związek ten jest łatwo pobierany przez tkanki roślinne, a w nich stosunkowo wolno na drodze enzymatycznej uwalnia się z etrelu etylen.
SZCZEGÓŁÓWY MECHANIZM DZIAŁANIA ETYLENU: TUTAJ - "Szlaki przekazywania sygnałów indukowane przez etylen" - K. Frankowski, J. Kęsy, W. Kotarba, J. Kopcewicz.
MUTACJE: występuje kilka rodzajów mutacji roślin związanych z etylenem: eln - roślina nie ma receptorów etylenu; eto - roślina produkuje za dużo etylenu, ale reaguje na podawane przez człowieka inhibitory; ctr - nie reagują na inhibitory (ponieważ nie występuje u nich kinaza, będąca normalnie negatywnym regulatorem ekspresji) i dlatego przeprowadzają potrójną odpowiedź nawet w powietrzu.
2) AUKSYNY:
HISTORIA ODKRYCIA AUKSYN:
 |
| Karol Darwin - pionier w dziedzinie badań nad auksynami, znany głównie jako twórca teorii ewolucji. |
 |
| Źródło: i.pinimg.com - Eksperyment Darwinów. |
 |
| Źródło: Wikipedia (EN) - Frits Warmolt Went. |
 |
| Źródło: Wydawnictwo Pearson Benjamin Cummings. |
Charakterystyczną właściwością auksyny jest pobudzanie wydłużania łodyg (procesu elongacji) i koleoptyli. Hormon ten prawdopodobnie przyczynia się do zakwaszenia ściany komórkowej, zwiększając jej plastyczność, a tym samym możliwość jej rozciągania pod wpływem turgorowego ciśnienia komórki (PATRZ: HIPOTEZA WZROSTU KWASOWEGO).
Działanie auksyn na wydłużanie komórek pozwala również wytłumaczyć ich rolę w fototropizmie. Jeżeli roślina oświetlona zostanie tylko z jednej strony, to część auksyny przemieszcza się poziomo do zacienionej części łodygi, zanim zacznie przesuwać się w dół transportem polarnym. Ponieważ w tych warunkach wzrasta stężenie auksyny po zacienionej stronie łodygi, komórki w tej części zaczynają wydłużać się szybciej niż po stronie oświetlonej, co prowadzi do wygięcia się łodygi w kierunku źródła światła.
 |
| Źródło: VADEMECUM MATURA 2009 wyd OPERON, str. 207 |
W roślinach o dużej dominacji wierzchołkowej wytwarzana w merystemie wierzchołkowym auksyna hamuje rozwój pąków bocznych, z których wskutek tego nie mogą się rozwinąć gałęzie boczne. Usunięcie merystemu szczytowego oznacza usunięcie źródła auksyny, więc pąki boczne zaczynają się rozwijać, i wyrastają boczne gałęzie. Często jednak dominacja wierzchołkowa powraca, gdy jedno z odgałęzień zaczyna hamować wzrost innych. Inne hormony (Etylen i cytokininy) są współodpowiedzialne za dominację wierzchołkową. Tak jak w wielu innych procesach fizjologicznych, za dominację wierzchołkową mogą być odpowiedzialne zmiany w stosunku ilościowym jednych hormonów do innych.
Auksyna wytwarzana w rozwijających się nasionach stymuluje rozwój owocu. W spryskanych nią kwiatach, w których nie doszło do zapłodnienia (nie mogą zatem rozwinąć się nasiona), w wielu przypadkach zalążnia rozwija się w owoc bez nasion. W ten sposób produkuje się np. pozbawione nasion pomidory. Auksyna to jednak nie jedyny hormon odpowiedzialny za rozwój owocu.
NATURALNE AUKSYNY:
 |
| Źródło: Wikipedia. Kwas indolilooctowy. |
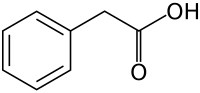
- a) Kwas indolilooctowy (IAA, a ang. indoleacetic acid) - jest to organiczny związek chemiczny zbudowany z reszt indolu i kwasu octowego. Hormon roślinny z grupy naturalnych auksyn. Reguluje wzrost i rozwój roślin. Struktura IAA jest podobna do aminokwasu tryptofanu, z którego jest syntetyzowany przez rośliny. Fitohormon IAA jest syntetyzowany w merystemie wierzchołkowym pędu, liściach i nasionach. BIOSYNTEZA IAA: w komórkach roślinnych IAA powstaje w wyniku przekształcenia jednego z aminokwasów aromatycznych, tryptofanu. Związek ten może być przekształcany w IAA na kilka sposobów. Dominującym szlakiem jest deaminacja tryptofanu przez enzym, monooksydazę tryptofanu. Powstający kwas indolilo-3-pirogronowy jest następnie przekształcany do aldehydu indolilo-3-octowego i ostatecznie do kwasu indolilo-3-octowego. Synteza IAA może zachodzić również przez przekształcenie tryptofanu do tryptaminy, z której w kolejnej reakcji powstaje aldehyd indolilo-3-octowy lub indolilo-3-acetonitryl. Oba związki mogą zostać przekształcone w kwas indolilo-3-octowy.
 |
| Źródło: Wikipedia. Kwas indolilomasłowy. |
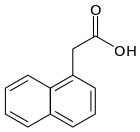
b) Kwas indolilomasłowy (IBA, z ang. indole-3-butyric acid) - jest to organiczny związek chemiczny, indolowa pochodna kwasu masłowego. Należy do fitohormonów z grupy auksyn. Stosowany jest jako ukorzeniacz sadzonek i środek stymulujący proces wzrostu roślin. Jest białym do jasnożółtego koloru krystalicznym ciałem stałym. IBA, ponieważ nie rozpuszcza się w wodzie, to jest na ogół rozpuszczany w 75% czystego etanolu do stosowania w instalacjach korzeniowych. Następnie rozcieńcza się ten roztwór wodą destylowaną, do pożądanego stężenia. IBA jest również dostępny w postaci soli, która jest rozpuszczalna w wodzie. Związek ten uważany bł za ściśle syntetyczny, jednakże stwierdzono, że związek został wyizolowany z liści i nasion kukurydzy i innych gatunków. IBA kukurydzy wykazano, iż można je zsyntetyzować in vivo przy użyciu IAA i innych związków jako prekursorów. IBA ma zastosowanie w hodowlach tkankowych roślin. Są one tam wykorzystywane do inicjacji ukorzeniania in vitro - procedura ta zwie się mikropropagacją (POLECAM: Ciekawe opracowanie nt. "Mikropropagacji roślin" przygotowane przez Katedrę Genetyki, Uniwersytetu Śląskiego z 2012r.)
MIKROPROPAGACJA = MIKROROZMNAŻANIE. IBA jest używany, by spowodować powstawanie mas niezróżnicowanych komórek zwanych kalusem. Z komórek kalusa różnicują się inne komórki i tkanki, takie jak korzenie w procesie organogenezy.
MIKROPROPAGACJA = MIKROROZMNAŻANIE. IBA jest używany, by spowodować powstawanie mas niezróżnicowanych komórek zwanych kalusem. Z komórek kalusa różnicują się inne komórki i tkanki, takie jak korzenie w procesie organogenezy.
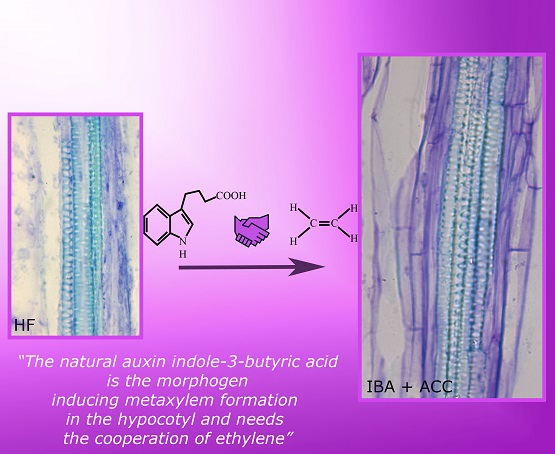 |
| Źródło: "Indole-3-Butyric Acid Induces Ectopic Formation of Metaxylem in the Hypocotyl of Arabidopsis thaliana without Conversion into Indole-3-Acetic Acid and with a Positive Interaction with Ethylene" - L. Fattorini, F.D.Rovere, E. Andrelini, M.Ronzan, G. Falasca, M.M. Altamura. |
 |
| Źródło: Wikipedia (EN). |
INNE: indoliloacetonitryl (IAN); KWAS 3-INDOLILOPIROGRONOWY (IPA).
SYNTETYCZNE REGULATORY WZROSTU O WŁAŚCIWOŚCIACH ZBLIŻONYCH DO AUKSYN:
 |
| Źródło: Wikipedia. |
 |
| Źródło: Wikipedia. |
 |
| Źródło: Wikipedia. |
Dokument o konsekwencjach użycia "Agent Orange" podczas Wojny Wietnamskiej:
INNE: kwas 2-metoksy-3,6-dichlorobenzoesowy (dicamba); kwas 4-amino-3,5,6-trichloropikolinowy (picloran, tordon).
Auksyny mogą występować w organizmie roślinnym w postaci wolnej lub w połączeniu z cukrami, aminokwasami lub peptydami. Pochodne fitohormonów nazywane są koniugatami i nie wykazują zwykle aktywności biologicznej. Połączenie związków odbywa się przy udziale grupy karboksylowej IAA. U roślin dwuliściennych wykryto amidy IAA, zaś u jednoliściennych koniugatami są zwykle estry IAA. Tworzenie koniugatów umożliwia odwracalną inaktywację, powstałe związki są formą transportową hormonów. Odtworzenie aktywnej postaci fitohormonu jest możliwe dzięki obecności enzymów hydrolizujących. Wykazano, że w tkankach roślin obecne są enzymy hydrolizujące estry oraz amidy IAA.
 |
| Źródło: http://plantphys.info/plant_physiology/images/boundauxins.gif - Koniugaty IAA. |
BIOSYNTEZA AUKSYN: Glówny przedstawiciel auksyn, IAA, może być wytwarzany w organizmie roślinnym na dwa sposoby. Szlak pierwszy rozpoczyna się od tryptofanu (Trp-zależny), szlak drugi jest niezależny od tego związku i określany jako Trp-niezależny. Biosynteza w efekcie szlaku Trp-zależnego jest niezbędna do embriogenezy, wzrostu siewek, rozwoju kwiatu, powstawania naczyń i innych procesów rozwojowych. Rola szlaku Trp-niezależnego jest słabo wyjaśniona.
Synteza IAA z tryptofanu przebiega w dwóch etapach. Etap pierwszy prowadzi do powstania kwasu indolo-3-pirogronowego i jest katalizowany przez enzym TAA należący do rodziny aminotransferaz. Etap drugi katalizowany jest przez enzym YUCCA (YUC) z rodziny monooksygenaz flawinowych. U Arabidopsis thaliana istnieje 11 genów YUC. Możliwy jest udział kilku innych enzymów w syntezie IAA. CYP79B2/CYP79B3, nitrylazy, oksydaza aldehydowa dekarboksylaza IPA mogą uczestniczyć w syntezie w niewielkim stopniu lub tylko u niektórych gatunków.
 |
| Źródło: http://www.plantphysiol.org/content/plantphysiol/169/2/1001/F1.large.jpg?width=800&height=600&carousel=1 - Dwa szlaki biosyntezy IAA w roślinie - szlak Trp-zależny i Trp-niezależny. |
DZIAŁANIE AUKSYN: Działanie auksyn jest związane z dwoma rodzajami reakcji. Odpowiedzi szybkie nie wiążą się z regulacją ekspresji genów i prawdopodobnie są związane z białkami wiążącymi auksyny (ABP - ang. auxin-binding-proteins). Ciekawa publikacja: "AUXIN BINDING PROTEIN: functional and evolutionary aspects" - Alexandre Tromas, Ivan Paponov, CatherinePerrot-Rechenmann.
Druga grupa reakcji to odpowiedzi powolne związane z ekspresją genów i białkami z domeną F (ang. F-box proteins).
Jedną z ważniejszych funkcji auksyn jest pobudzenie wzrostu komórek roślin. Mają one pośredni wpływ na rozciągliwość ścian komórkowych. Mechanizm regulacji powiększania komórki nie jest w pełni wyjaśniony. Opisywana w literaturze koncepcja wzrostu kwasowego przyjmuje, że auksyny pobudzają działanie pompy protonowej w błonach komórkowych, w wyniku czego jony hydroniowe (H3O+) przenikają z cytoplazmy do ściany komórkowej. Powoduje to zakwaszenie ściany komórkowej rozerwanie niekowalencyjnych wiązań między składnikami ściany oraz i aktywację białek z grupy ekspansyn, będących enzymami hydrolitycznymi hemicelulozy. Ściana wówczas staje się plastyczna i zdolna do rozciągania pod wpływem ciśnienia turgorowego i powiększania się komórki. Hipoteza wzrostu kwasowego znajduje potwierdzenie w doświadczeniach z zakwaszeniem apoplastu, które także prowadzi do wzrostu komórki bez obecności IAA. Zatrzymanie wzrostu komórki następuje po umieszczeniu jej w buforze. W takich warunkach wzrost nie jest indukowany przez IAA. Dowodem potwierdzającym hipotezę jest również możliwość zahamowania reakcji na IAA przez pozbawienie środowiska jonów K+. Przyjmuje się, że pompa protonowa działa na zasadzie antyportu z tymi jonami. Brak jest jednak bezpośrednich dowodów w postaci wyizolowanego białka będącego receptorem i pompą protonową. Nie zawsze stwierdza się również konieczność obniżenia pH apoplastu przy wzroście komórki. Możliwe, że istnieje więcej niż jeden mechanizm stymulacji wzrostu komórki przez auksyny. Nie jest także jasne czy inne niż IAA auksyny indukują wzrost na podobnej zasadzie.
Poza wzrostem komórek auksyny stymulują także podziały komórkowe, indukują tworzenie się korzeni przybyszowych, wpływają na powstawanie owoców oraz kształtowanie się ksylemu.
U truskawki powstawanie owocu rzekomego związane jest z wytwarzaniem auksyn przez orzeszki.
Możliwa jest stymulacja rozwoju dna kwiatowego (ta mięsista czerwona część to jest rozrośnięte dno kwiatowe) przez podanie auksyny zastępującej substancję wytwarzaną przez orzeszki.
Auksyny wpływają hamująco na formowanie się tkanki odcinającej i padanie liści, są także odpowiedzialne za zjawisko dominacji wierzchołkowej, polegające na zahamowaniu rozwoju pąków pędowych. Auksyny wytwarzane przez merystem wierzchołkowy powodują, że pąki znajdujące się poniżej pozostają w stanie uśpienia. Gdy wierzchołek pędu głównego zostanie usunięty lub uszkodzony rośliny rozkrzewiają się w wyniku wzrostu obudzonych pąków pachwinowych. Podwyższone stężenie auksyn powoduje zahamowanie wzrostu wydłużeniowego korzeni. Wysoka zawartość auksyn prowadzi również do zwiększonej ilości kwiatów żeńskich, a jeśli kwiaty są obupłciowe następuje symulacja rozwoju zalążni i hamowanie rozwoju pręcików. U roślin dwupiennych, takich jak konopie siewne, obserwowano powstawanie kwiatów żeńskich na osobnikach męskich.
TRANSPORT AUKSYN: Przemieszczanie auksyn w roślinie odbywa się na dwa sposoby. Z organów będących źródłem auksyn takich jak kwiaty albo młode liście auksyny w sposób nieregulowany przemieszczane są przez dojrzały floem. Transport floemem jest stosunkowo szybki. Wolniej i w sposób polegający na regulacji auksyn przemieszczane są przez kambium. Transport z komórki do komórki odbywa się od pędu w kierunku korzenia. Powolne, kontrolowane przemieszczanie auksyn w ograniczonym zakresie odbywa się również przy udziale innych tkanek. Polarny transport auksyn został wykazany dla IAA i IBA. Szybkość przemieszczania tych fitohormonów została określona na 8 do 10 mm na godzinę.
RECEPTORY AUKSYN: Odbiór informacji przenoszonej przez hormon jest możliwy dzięki obecności w kompetentnych komórkach specyficznych białek pełniących rolę receptora sygnału. Receptory auksyn określane jako białka wiążące auksyny (ABP) zostały wykryte w błonie komórkowej oraz w siateczce śródplazmatycznej oraz tonoplaście. Białko pełniące funkcję receptora jest homodimerem o masie około 40-45 kDa. Masa podjednostek to około 20-22 kDa. Funkcja ABP została potwierdzona w doświadczeniach na syntetycznej błonie fosfolipidowej, która ulegała polaryzacji po dodaniu do układu auksyny, ABP i ATP. Wzrost indukowany przez auksyny może zostać zahamowany przez podanie przeciwciał specyficznych wobec ABP. Doświadczenia wykazały również zwiększoną zawartość ABP w tkankach silnie reagujących na auksyny w stosunku do tkanek w niewielkim stopniu reagującym na IAA.
ZASTOSOWANIE AUKSYN W ROLNICTWIE: Niezapłodnione kwiaty niektórych gatunków potraktowane auksyną IAA powiększają swoją zalążnię i przekształcają się w owoce partenokarpiczne, niemające nasion, co jest wykorzystywane w rolnictwie do produkcji bezpestkowych owoców oraz warzyw. Często auksyna stosowana jest w szklarniach. W niewielkich stężeniach mogą być stosowane w ukorzeniaczach. Kwas 2,4-dichlorofenoksyoctowy (tzw. 2,4-D), będący syntetyczną auksyną, hamuje wzrost oraz rozwój roślin. Rośliny jednoliścienne są mniej wrażliwe na 2,4-D niż dwuliścienne, co sprawia, że 2,4-D jest stosowany do opryskiwania upraw roślin jednoliściennych takich jak żyto, pszenica, w celu wyniszczenia chwastów dwuliściennych. Zbyt duże stężenie auksyn pobudza produkcję etylenu, co opóźnia wzrost rośliny.
AUKSYNY U MIKROORGANIZMÓW: Zdolność do wytwarzania IAA jest szeroko rozpowszechniona u bakterii zasiedlających ryzosferę. Wytwarzana auksyna może być stosowana zarówno w patogenezie, jak i w stymulacji wzrostu roślin. Genetyczny mechanizm syntezy auksyn został dobrze poznany u Pseudomonas, Agrobacterium, Rhizobium, Bradyrhizobium i Azospirillum. Stymulacja wzrostu korzeni roślin umożliwa wejście mikroorganizmom w relację symbiotyczną i obejście mechanizmów obronnych roślin. Bakterie glebowe poza IAA wytwarzają także kwas 3-indolilopirogronowy i prawdopodobnie indolilo-3-acetoamid. Geny niezbędne do biosyntezy auksyn mogą być zlokalizowane zarówno na plazmidzie jak i na chromosomie.
3) GIBERELINY:
 |
| Źródło: Wikipedia. Struktura gibereliny 452D |

HISTORIA ODKRYCIA GIBERELIN: W latach 20. i 30. XX wieku biolog japoński - Elichi Kurosawa prowadził badania nad chorobą ryżu, którego siewki bardzo szybko rosły, stawały się wysokie i wysmukłe, przewracały się i ostatecznie zamierały. Przyczyną występowania tej choroby był grzyb (Gibberella fujikuroi), który wytwarzał związek nazwany gibereliną (GA). Wkrótce po zakończeniu II wojny światowej naukowcy z Europy i Ameryki Północnej zainteresowali się obserwacją dokonaną przez Japończyków. Badania prowadzone w latach 1950-1970 w Stanach Zjednoczonych oraz Wielkiej Brytanii wykazały, iż gibereliny wytwarzają również zdrowe rośliny, podobnie jak grzyb wywołujący chorobę siewek.
 |
Źródło: agriskmanagementforum.org - Choroba ryżu - -"Bakanae
infection", której przyczyną jest wytwarzanie nadmiernej ilości
gibereliny przez grzyba Gibberella fujikuroi.
|
DZIAŁANIE GIBERELIN (przykłady):
- STYMULACJA TRAWIENIA BIELMA W ZIARNACH ZBÓŻ: najlepiej poznanym efektem działania giberelin jest stymulacja produkcji alfa-amylazy w nasionach zbóż. W wyjaśnieniu przyspieszania kiełkowania zbóż przez gibereliny pomocna była wiedza o tym, że z warstwy aleuronowej wydzielane są enzymy degradujące skrobię tylko w obecności zarodka. Zarodek może być zastąpiony przez podanie kwasu giberelinowego. To właśnie gibereliny wydzielane przez zarodek stymulują trawienie bielma. Dalsze badania wykazały, iż giberelina zwiększa poziom mRNA dla alfa-amylazy poprzez stymulację transkrypcji. Przypuszcza się, że w stymulacji transkrypcji przez gibereliny uczestniczą białka związane z DNA.
- WPŁYW NA WZROST WYDŁUŻENIOWY: Innym przykładem działania giberelin jest wpływ na wzrost wydłużeniowy pędu. Mechanizm działania giberelin w tym przypadku polega prawdopodobnie na zwiększaniu plastyczności ścian komórkowych. Przypuszcza się, że gibereliny poprzez hamowanie aktywności peroksydaz zapobiegają reakcjom, które powodują usztywnianie ścian komórkowych. Usztywnianie to następuje w wyniku wbudowania komponentów fenolowych w ścianę komórkową, takich jak np. kwas ferulowy. Kwas giberelinowy stymuluje poziom mRNA enzymu beta-1-3-glukanazy, hydrolizującego jeden z głównych polisacharydów ściany komórkowej bielma jęczmienia. Możliwe jest również indukowanie wzrostu przez zmanę poziomu wapnia w tkance. Jony Ca2+ hamują wzrost hipokotyli sałaty a zjawisko to może być odwrócone przez giberelinę.
- UDZIAŁ W WYCHODZENIU NASION ZE STANU SPOCZYNKU: Gibereliny biorą również udział w procesie wychodzenia nasion ze stanu spoczynku. Ustępowanie stanu głębokiego spoczynku podczas stratyfikacji w niskiej temperaturze przebiega w końcowym etapie równocześnie ze zwiększeniem się poziomu giberelin uwalnianych zarówno z form związanych, jak i pochodzących z biosyntezy. Aktywny udział giberelin w tym procesie został potwierdzony przez ich podawanie egzogennie.
- UDZIAŁ W PROCESIE ROZMNAŻANIA ROŚLIN: w kwiatach, gdzie głównym źródłem giberelin są pręciki hormon ten zapewnia żywotność pyłku, a nawet, po zapłodnieniu żywotność zygoty. Gwałtowny wzrost łagiewki pyłkowej jak również zapłodnienie jest pod kontrolą giberelin. Gibereliny wpływają również na płeć kwiatów, szczególnie roślin rozdzielnopłciowych. Wysoki poziom giberelin w tkankach lub dostarczenie ich z zewnątrz sprzyja tworzeniu się kwiatów męskich, czemu towarzyszy zwykle intensywny wzrost wegetatywny. Roślinami u których obserwowano takie działanie giberelin są: morwa, topola, klon oraz ogórek. U roślin które występują w formie juwenilnej i dojrzałej (często mają one różny kształt liści) mogą się one przekształcać jedna w drugą pod wpływem giberelin zależnie od gatunku rośliny. U Hedera helix (Bluszcz pospolity) GA3 może powodować powrót formy dojrzałej do juwenilnej, zaś wiele drzew szpilkowych przechodzi w fazę generatywną po podaniu niepolarnych giberelin takich jak GA4+GA7.
- UDZIAŁ W INDUKCJI KWITNIENIA: Gibereliny biorą również udział w indukowaniu kwitnienia roślin. Mogą one zastępować działanie światła lub niskiej temperatury u roślin wymagających dla kwitnienia długiego dnia lub chłodzenia. Podczas indukcji kwitnienia zmienia się w roślinie zarówno ilość endogennych giberelin, jak i ich rodzaj. Retardanty (antygibereliny - grupa syntetycznych regulatorów wzrostu i rozwoju roślin o różnej budowie chemicznej, których wspólną cechą jest hamowanie wzrostu roślin wyższych, dlatego znalazły zastosowanie w rolnictwie oraz ogrodnictwie do ograniczania długości pędów bez jednoczesnego obniżania produktywności uprawy) mogą hamować indukcję kwitnienia poprzez obniżenie poziomu giberelin i ograniczenie ich metabolizmu. W warunkach niesprzyjającego fotoperiodu, nie dochodzi do biosyntezy giberelin i rośliny dnia długiego nie zakwitają, zaś rośliny dnia krótkiego pozostają w stanie rozety. W przypadku indukcji kwitnienia u poszczególnych gatunków roślin musi zadziałać określona giberelina, w określonym stężeniu. Rośliny dnia długiego wykazują istotną zależność od giberelin o szkielecie dziewiętnastowęglowym z grupą hydroksylową przy atomie węgla dwunastym, trzynastym i piętnastym. Również czas i miejsce stosowania gibereliny może mieć znaczenie dla indukcji kwitnienia. W przypadku roślin dnia krótkiego, GA1 podana przed indukcją stymuluje kwitnienie, ale zastosowana tuż po indukcji działa hamująco. Szczególną cechą giberelin indukujących kwitnienie roślin, jest ich minimalny efekt na wydłużanie się pędów. Gibereliny bardzo skuteczne w pobudzaniu wzrostu wydłużeniowego muszą być stosowane w bardzo wysokich dawkach, aby wywołać kwitnienie. Wśród wielu giberelin obecnych w roślinie jest tylko jedna, nazywana "efektorem" jest aktywna w danym procesie. Pozostałe gibereliny to najczęściej nieaktywne ogniwa w łańcuchu biosyntezy lub produkty unieczynnienia efektora. Przykładem efektora stymulacji kwitnienia u jabłoni jest GA4. Równocześnie obecne w jabłoni gibereliny GA3, GA19, GA20, GA53 są wcześniejszymi ogniwami w biosyntezie GA4, a gibereliny GA7 i GA9 są produktami degradacji aktywnej gibereliny GA4.
FORMY WYSTĘPOWANIA GIBERELIN: Znane są trzy chemicznie różne formy występowania giberelin w roślinach i są to:
a) wolne związki (ekstrahowane najczęściej alkoholem i octanem etylu);
b) kompleksy typu glikozydów lub estrów glikozydowych.
c) gibereliny związane z białkiem (rozpuszczalne w wodzie i ekstrahowane butanolem)
Rola giberelin związanych w kompleksach typu glikozydów lub estrów glikozydowych nie jest do końca wyjaśniona. Wyższa polarność giberelin połączonych z cukrami może umożliwiać magazynowanie tych związków w wakuoli. Jedną z funkcji glikozydów i estrów zawierających gibereliny jest udział tych związków w transporcie giberelin w tkankach przewodzących. Możliwe jest również, iż związane formy gibereliny ułatwiają transport między przedziałami komórki oraz przemieszczanie giberelin przez ścianę komórkową. Zapewne związane z cukrem gibereliny stanowią również formę zapasową. Kompleksy typu glikozydów mogą być rozkładane podczas kiełkowania i mogą być źródłem giberelin jeszcze przed syntezą de novo giberelin. Jednak nie wszystkie związki giberelin z cukrami są biologicznie aktywne. Związki biologicznie nieaktywne mogą brać udział w procesach katabolicznych prowadzących do rozkładu giberelin i być jednocześnie pierwszym ogniwem dezaktywacji giberelin. Łatwość powstawania kompleksów giberelina-cukier oraz łatwość jego hydrolizy może umożliwiać regulację puli wolnych giberelin. Przechodzenie form związanych w wolne gibereliny i odwrotnie obserwowano np. u siewek kukurydzy. Wykazano występowanie giberelin w połączeniu z białkami cytozolu hypokotyla ogórka i grochu. Wyizolowano także z jądra komórkowego siewek fasoli białka o masie 80-100 kDa. Dodanie tych białek do preparatu jądrowego zwiększało około dwukrotnie aktywność transkrypcyjną. Białka łączące się z gibereliną w tych przypadkach mają prawdopodobnie charakter receptora.
4) CYTOKININY: (uwaga: NIE MYLIĆ Z CYTOKINAMI!)
 |
Źródło: nap.edu - Folke K. Skoog.
|
 |
| Źródło: Wikimedia. Gottlieb Haberlandt. |
Badania, które prowadziły do okrycia cytokinin zapoczątkował Gottlieb Haberlandt około roku 1913. Zauważył on, iż w izolowanych fragmentach tkanki miękiszowej ziemniaka można wywołać podziały komórek poprzez przyłożenie niewielkich fragmentów tkanki przewodzącej. W roku 1955 Folke Skoog zastosował do stymulacji podziałów komórek w tkance miękiszowej tytoniu wyciąg z mleka kokosowego lub drożdży, a następnie stary preparat DNA poddany działaniu wysokiej temperatury. otrzymany w ten sposób roztwór wykazywał zdolność do stymulacji podziałów komórkowych. Z hydrolizatu DNA udało się wykrystalizować substancję aktywną, którą nazwano kinetyną. Kinetyny nie udało się nigdy wyizolować z roślin. Jednak w roku 1964 David Lentham wyizolował z bielma ziarniaków kukurydzy substancję podobną do kinetyny, którą nazwał zeatyną. Obecnie oprócz kinetyny znane są inne związki wykazujące aktywność biologiczną - część z nich występuje naturalnie w roślinach, a część jest związkami syntetycznymi.
BIOSYNTEZA CYTOKININ: Głównym miejscem syntezy cytokinin jest korzeń, skąd są one transportowane elementami przewodzącymi - drewnem do nadziemnych części rośliny. Mniejsze ilości cytokinin powstają także w owocach, nasionach oraz młodych liściach. Istnieją dwa szlaki syntezy cytokinin. W początkowym etapie szlaku pierwszego syntezy zeatyny cząsteczka pirofsforanu izopent-2-enylu przyłącza się do cząsteczki AMP, ADP lub ATP. Reakcja katalizowana jest przez transferazę izopentenylową. Powstały produkt - monofosforan izopentenyloadenozyna przekształcany jest następnie przez odłączenie fosforybozy, do izopentenyloadeniny, a po hydroksylacji grupy metylowej w pozycji trans reszty izopentenylowej powstaje naturalna cytokinina - zeatyna. Drugim źródłem cytokinin jest degradacja kwasów nukleinowych, szczególnie tRNA. Degradacja cytokinin polega na oderwaniu reszty izopentenylowej.
FUNKCJE CYTOKININ:
- Cytokininy to substancje regulujące tempo podziałów komórkowych,
- Cytokininy pobudzają wzrost objętościowy komórek,
- Cytokininy stymulują różnicowanie się chloroplastów,
- Cytokininy powodują transport metabolitów w kierunku organów o wyższej zawartości cytokinin,
- Biorą udział w regulacji starzenia się roślin (poprzez hamowanie rozkładu białek i syntezę RNA),
- Indukują różnicowanie się pędów,
- Stymulują wzrost pąków pachwinowych,
- Uczestniczą w kiełkowaniu nasion - wychodzeniu nasion ze stanu spoczynku.
Pamiętać należy, iż wiele procesów zachodzących w roślinach zależy od relacji zawartości różnych regulatorów wzrostu oraz rozwoju i nie jest możliwe przypisanie regulacji tych procesów do działania tylko jednego związku. W ogrodnictwie i rolnictwie stosuje się także syntetyczne cytokininy, np. do przedłużania trwałości ciętych kwiatów. Powodują efekt Richmonda-Langa, czyli powstrzymują i hamują starzenie się organów i tkanek roślinnych, np. liście umieszczone w roztworze cytokininy zachowują świeżość i zieloną barwę, mogą odmładzać też liście pobudzając wytwarzanie chlorofilu, białek, kwasów nukleinowych.
 |
| Źródło: https://ramneetkaur.com/cytokinin/ - Efekt Richmonda-Langa. |
 |
| Źródło: microgarden.pl - Związek pomiędzy działaniem auksyny i cytokininy. |
PRZYKŁAD ZADANIA MATURALNEGO DOTYCZĄCEGO WZAJEMNYCH STOSUNKÓW STĘŻEŃ AUKSYN I CYTOKININ:
HIPOTEZA BADAWCZA 1: Rozwój korzeni lub pędów z kallusa zależy od proporcji auksyn w stosunku do cytokinin.
HIPOTEZA BADAWCZA 2: Przewaga cytokin nad auksynami powoduje wykształcenie się pędów z kallusa.
HIPOTEZA BADAWCZA 3: Przewaga auksyn nad cytokininami powoduje wykształcenie się korzeni z kallusa.
5) Jasmonidy (Jasmoniany):
 Jest to grupa organicznych związków chemicznych, do której zalicza się kwas jasmonowy, jasmonian metylu, kwas kukurbinowy (będący zredukowaną pochodną kwasu jasmonowego) oraz kilka stereoizomerów tych związków wykazujących aktywność biologiczną. Struktura jasmonidów jest podobna do prostaglandyn (hormonów zwierzęcych). Pierwszym poznanym jasmonidem był jasmonian metylu, wyodrębniony z olejku zapachowego kwiatu jaśminu i rozmarynu w roku 1962. Drugim związkiem był kwas jasmonowy wyodrębniony z grzyba Botryodiplodia theobromae w 1971 r. Jasmonidy zostały sklasyfikowane jako regulatory wzrostu w latach 80. XX wieku. Są obecnie zaliczane do endogennych regulatorów wzrostu i rozwoju roślin. Związki te są szeroko rozpowszechnione w roślinach wyższych. Podobnie jak inne fitohormony (auksyny, gibereliny, cytokininy, kwas abscysynowy, etylen) występują one w niewielkich ilościach w różnych tkankach roślinnych.
Jest to grupa organicznych związków chemicznych, do której zalicza się kwas jasmonowy, jasmonian metylu, kwas kukurbinowy (będący zredukowaną pochodną kwasu jasmonowego) oraz kilka stereoizomerów tych związków wykazujących aktywność biologiczną. Struktura jasmonidów jest podobna do prostaglandyn (hormonów zwierzęcych). Pierwszym poznanym jasmonidem był jasmonian metylu, wyodrębniony z olejku zapachowego kwiatu jaśminu i rozmarynu w roku 1962. Drugim związkiem był kwas jasmonowy wyodrębniony z grzyba Botryodiplodia theobromae w 1971 r. Jasmonidy zostały sklasyfikowane jako regulatory wzrostu w latach 80. XX wieku. Są obecnie zaliczane do endogennych regulatorów wzrostu i rozwoju roślin. Związki te są szeroko rozpowszechnione w roślinach wyższych. Podobnie jak inne fitohormony (auksyny, gibereliny, cytokininy, kwas abscysynowy, etylen) występują one w niewielkich ilościach w różnych tkankach roślinnych.
ODKRYCIE KWASU JASMONOWEGO I JEGO ESTRU METYLOWEGO: JA-Me wyizolowano po raz pierwszy jako lotny składnik olejów eterycznych z Jasminum grandiflorum (stąd nazwa: Jasmoniny) i Rosmarinus officinalis. JA natomiast wykryto w filtratach grzyba Lasiodiplodia theobromae. Dotychczas występowanie związków jasmonowych stwierdzono u przedstawicieli przeszło 160 rodzin.
 |
| Źródło: researchgate.net - Lasiodiplodia theobromae. |
BIOSYNTEZA JASMONIDÓW: Szlak biosyntezy JA zaproponowali Vick i Zimmerman. JA jest pochodną wielonienasyconych kwasów tłuszczowych. Prekursorem syntezy tego regulatora jest kwas linolenowy (LA). Zostaje on utleniony przy udziale enzymu lipoksygenazy do wodoronadtlenku kwasu linolenowego (13-HPLA). Enzymowi temu przypisuje się kluczową rolę w regulacji syntezy związków jasmonowych. W trakcie dalszych przemian 13-HPLA ulega cyklizacji. Produktem reakcji jest kwas 12-okso-fytodienowy (12-oxo-pDA), który w swojej cząsteczce zawiera cyklopentanonowy pierścień. Ten pośredni metabolit podlega redukcji, a następnie trzem kolejno po sobie następującym beta-oksydacjom. W wyniku wspomnianych reakcji boczny łańcuch zostaje skrócony i przyjmuje formę pentenylu. Produktem przemian LA jest dwunastowęglowy kwas (+)-7-iso-jasmonowy (+)-7-iso-JA. Związek ten łatwo epimeryzuje do (-) JA. Naturalny (-)JA, a także syntetyczny (+)JA jest mieszaniną izomerów składającą się w 90% z JA i 10% z 7-iso-JA. Stwierdzono również inną proporcję, np. w owocach Vicia faba stosunek molowy (-)JA do (+)-7-iso-JA wynosił 2:1. Produktem biosyntezy grzyba Botryodiplodia theobromae był przede wszystkim (+)-7-iso-JA.
Najbardziej znaną pochodną kwasu jasmonowego jest jego ester metylowy. W roślinach oraz u grzybów występują także inne analogi tego regulatora wzrostu. Podstawę budowy wszystkich związków jasmonowych stanowi cyklopentanonowy pierścień z trzema różnymi podstawnikami w pozycji C-3, C-6, C-7. Pochodne JA są dwojakiego rodzaju. Do pierwszej grupy zaliczono związki, które podobnie jak kwas jasmonowy powstają na drodze przemian kwasu linolenowego. Zalicza się tu 9,10-dihydro-JA, 3,7-didehydro-JA i 4,5-didehydro-JA, których obecność stwierdzono w liściach Equisetum sylvaticum i owocach Vicia faba. Natomiast u grzyba Botryodiplodia theobromae wykryto (+)-9,10-dihydro-7-iso-JA oraz (+)-4,5-didehydro-7-iso-JA. Redukcja grupy ketonowej w pozycji C-6 JA prowadzi do jej przemiany w grupę hydroksylową. Powstaje wówczas kwas kukurbitowy. Związek ten występuje w nasionach Cucurbita pepo. Kwas ten ulega metylacji, hydroksylacji oraz glukozylacji. Pochodne kwasu kukurbitowego wykryto w liściach Equisetum sp. oraz łodygach Hordeum vulgare.
Drugą grupę pochodnych JA stanowią związki powstałe w wyniku jego metabolicznych przemian. Są to tzw. metabolity wtórne. Obydwa izomery kwasu jasmonowego ulegają hydroksylacji, glukozylacji oraz łączą się z aminokwasami. Hydroksylacja w pozycji C-11 występuje częściej niż w pozycji C-12. Produktami powyższych przemian są kwas 12-hydroksy-jasmonowy (tuberynowy -TA) i jego pochodna O(12)-beta-glukopyranozyd. Występują one w roślinach Solanum tuberosum.
Ja tworzy połączenie jedynie z aminokwasami występującymi w konfiguracji S. Dotyczy to zarówno aminokwasów aromatycznych jak też alifatycznych. Koniugaty JA z fenyloalaniną, tryptofanem i tyrozyną wykryto w kwiatach, z izoleucyną w liściach oraz owocach, natomiast z leucyną oraz waliną w liściach Vicia faba.
WYSTĘPOWANIE ZWIĄZKÓW JASMONOWYCH: Jasmoniany wykryto u wielu gatunków roślin o różnej przynależności systematycznej. Obecność tych związków stwierdzono u wszystkich dotychczas badanych roślin należących do Angiospermae oraz jednego gatunku spośród Gymnospermae. Ponadto stwierdzono, że jasmoniany występują u Pteridophyta, np. Equisetum arvense i Equisetum sylvaticum. W ostatnich latach związki te wykryto również w roślinach niższych, a także u grzybów. JA i JA-Me wyizolowano z glonów Gelidium latifolium, Euglena gracilis, Spirulina maxima oraz Chlorella sp. U Chlorella pyrenoidosa występuje pełen system enzymów niezbędnych do przeprowadzenia syntezy kwasu jasmonowego, jednak w organizmach tych nie wykryto badanego regulatora. JA i jego analogi stwierdzono u grzybów Gibberella fujikuroi i Botryodiplodia theobromae. Okazało się, że związki jasmonowe obecne są we wszystkich prawie organach roślin wyższych. Wykryto je w pyłku kwiatowym, nasionach (zarodkach), łodygach, korzeniach, bulwach, kwiatach i owocach. Dotychczas nie ustalono, w której części komórki przebiega synteza tych regulatorów. Zawartość związków jasmonowych w roślinach jest bardzo zróżnicowana i waha się od 10 ng do 3 mikrogram na gram świeżej masy. Zależy ona od gatunku rośliny, rodzaju oraz wieku organu. Części generatywne roślin: owocnie, owoce i nasiona zawierają większe ilości badanych regulatorów, niż części wegetatywne, np. łodygi i liście. Najbogatszym źródłem związków jasmonowych są stadia młodociane wspomnianych organów. Wraz z wiekiem obniża się zawartość tych substancji. Stwierdzono, że JA występuje częściej niż jego ester metylowy. U niektórych roślin obydwa regulatory występują jednocześnie. Przykładem są owoce Malus sylvestris oraz pyłek kwiatowy Camellia sp. Znane są rośliny, np. Pseudotsuga menziesi i Artemisia absinthium, u których wykryto jedynie JA-Me. Ester metylowy kwasu jasmonowego jest składnikiem olejków eterycznych i nadaje woń wielu kwiatom, np. jaśminu oraz owocom, np. jabłoni. Ze względu na swoje zapachowe właściwości jest on syntetyzowany na dużą skalę dla potrzeb przemysłu perfumeryjnego.
DZIAŁANIE JASMONIDÓW: Zainteresowanie fizjologicznym znaczeniem JA rozpoczęło się od wykazania, że związek ten hamował wzrost siewek ryżu oraz przyspieszał starzenie się liści owsa. Aktualnie wiadomo, że egzogenne związki jasmonowe uczestniczą w regulacji wielu procesów fizjologicznych. Związki jasmonowe hamują, indukują bądź stymulują zmiany dokonujące się na morfologicznym, fizjologicznym, komórkowym i molekularnym poziomie. Na podstawie badań porównawczych, w których stosowano syntetyczne i naturalne pochodne JA, Yamane i współpracownicy ustalili, że jego fizjologiczną aktywność warunkują następujące właściwości strukturalne: 1) Obecność grupy acetylowej w pozycji C-1; 2) Obecność grupy ketonowej lub hydroksylowej w pozycji C-6; 3) Boczny łańcuch pentenylowy w pozycji C-7. Przeprowadzone dotychczas badania wykazały, że egzogenny JA lub JA-Me hamował procesy związane ze wzrostem roślin, natomiast stymulował dojrzewanie owoców, starzenie i opadanie liści. Ponadto wykazano, że w komórkach roślin poddanych działaniu związków jasmonowych, bądź zewnętrznych czynnników stresowych takich jak stres osmotyczny, wysuszenie, zranienie czy też patogeny, kumulowane są bardzo podobne białka.
WIĘCEJ INFORMACJI NA TEMAT DZIAŁANIA JASMONIDÓW ZNAJDZIESZ W PUBLIKACJI PT. "ROLA KWASU JASMONOWEGO I JEGO ESTRU METYLOWEGO WE WZROŚCIE I ROZWOJU ROŚLIN" - B. Białecka, J. Kępczyński.
FUNKCJE JASMONIDÓW:
- Hamują wzrost korzenia i hipokotyla, hamują powstawanie tkanki kalusowej, kiełkowanie ziaren pyłku, zarodników grzybów oraz nasion niespoczynkowych, których głównym materiałem zapasowym jest skrobia, np. kiełkowanie nasion Xanthium pennsylvanicum zostaje całkowicie zatrzymane przy stężeniach kwasu jasmonowego rzędu 0,1 mM,
- Hamują embriogenezę, tworzenie się pąków kwiatowych,
- Hamują aktywność procesów fotosyntezy,
- Hamują syntezę lub aktywność karboksylazy-1,5-bisfosforybozy (rubisco),
- Przyspieszają starzenie się liści, powstawanie warstwy odcinającej i opadanie liści,
- Hamują kiełkowanie nasion, w których materiałem zapasowym jest skrobia,
- Hamują kiełkowanie nasion nieznajdujących się w stanie spoczynku głębokiego i stymulują nasiona w głębokim spoczynku,
- Stymulują dojrzewanie owoców,
- Stymulują rozpad chlorofilu,
- Stymulują biosyntezę białek zapasowych liści oraz nasion,
- Stymulują syntezę inhibitorów proteinaz,
- Stymulują syntezę białek o niepoznanych funkcjach,
- Stymulują oddychanie liści oraz fotorespirację,
- Stymulują zamykanie się aparatów szparkowych,
- Pełnią rolę pośredników w reakcjach na stres i w mechanizmach obronnych roślin; wzrost ich stężenia w tkankach jest jedną z pierwszych odpowiedzi rośliny na stres,
- W wyniku mechanicznego uszkodzenia tkanek roślin, np. przez owady, zachodzi wzmożona synteza jasmonidów i następuje aktywacja lub indukcja biosyntezy enzymów odpowiedzialnych za gromadzenie się fitoaleksyn i inhibitorów proteinaz, które blokują aktywność proteinaz owadzich, uniemożliwiając tym samym dostęp owadów do roślinnych białek,
- Indukują syntezę wtórnych metabolitów roślinnych, np. alkaloidów,
- Stymulują syntezę lipooksygenaz, białek bogatych w reszty glicyny oraz hydroksyproliny, oraz niektórych niskocząsteczkowych białek z grupy LEA.
- Kwas jasmonowy aktywuje ekspresję genów kodujących niektóre białka obronne, np. osmotyny, oraz enzymy szlaku fenylopropanoidowego biorące udział w biosyntezie fitoaleksyn (grupy organicznych związków chemicznych należących do izoflawonoidów, seskwiterpenów, poliacetylenów i innych grup wytwarzanych przez rośliny w odpowiedzi na atak patogenów).
INHIBITORY WZROSTU I ROZWOJU ROŚLIN:
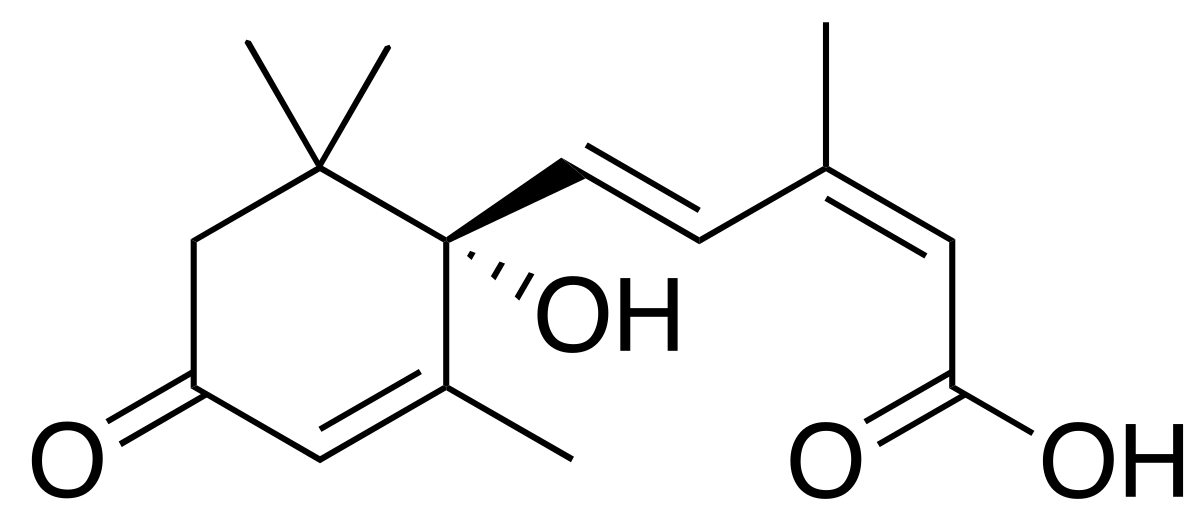 |
| Źródło: Wikipedia. Kwas abscysynowy. |
DZIAŁANIE KWASU ABSYSYNOWEGO:
- hamowanie wzrostu objętościowego komórek,
- odpowiadanie za stan spoczynku nasion; stanowi on inhibitor kiełkowania,
- odpowiedzialny jest za tworzenie warstwy odcinającej podczas opadania liści, owoców, kwiatów,
- odpowiedzialny jest za przechodzenie roślin w stan spoczynku,
- powoduje zamykanie się aparatów szparkowych,
- przyspiesza procesy starzenia tkanek,
- podwyższony poziom ABA jest reakcją roślin na stres, np. podczas braku wody ABA powoduje ograniczenie transpiracji, zwiększenie pobierania wody przez korzenie, a także indukowanie ekspresji genów rab oraz syntezę białek chroniących przed odwodnieniem.
 |
| Źródło: old-ib.bioninja.com.au - Działanie kwasu abscysynowego (ABA) powoduje zamknięcie aparatów szparkowych. |
 |
| Źródło: plantstomata.files.wordpress.com - Szczegółowy opis mechanizmu otwierania i zamykania szparki. |
W rolnictwie ABA jest stosowany do wywoływania lub przyspieszania desykacji roślin. Desykacja to stosowanie środków chemicznych (tzw. desykantów) w celu wysuszenia roślin przed zbiorem. Zabieg ten ma zastosowanie na plantacjach roślin o dużej i wolno wysychającej masie liści, jak koniczyna, lucerna, rzepak, słonecznik, nasienniki buraka, ziemniak na sadzeniaki, na 1-3 tygodnie przed zbiorem (sadzeniak to bulwa ziemniaka przeznaczona do sadzenia).
W części drugiej omówienia fitohormonów omówiona zostanie biosynteza owych zwiazków.
RETARDANTY WZROSTU ROŚLIN:
 |
| Źródło: Wikipedia. Przykład antygibereliny - Chlorek chlorocholiny. |
- chlorek 2-chloroetylotrimetyloamoniowy
- chlorek [2-metylo-4 (piperydylo-1'-karbamino)-5-izopropylofenylo]-trimetyloamoniowy (Amo 1618),
- chlorek trójbutylo-2,4-dwuchlorobenzylofosfoniowy,
- kwas N-dimetyloaminobursztynowy (B-995 lub B-9).
Mechanizm działanie retardantów jest zróżnicowany. Większość hamuje aktywność któregoś z enzymów odpowiedzialnych za syntezę giberelin. W wyniku powiązań szlaków metabolicznych retardanty wpływają także na syntezę kwasu abscysynowego, etenu, steroli, flawonoidów oraz innych związków organicznych. Znane są również retardanty o działaniu związanym z budową podobną do budowy naturalnych giberelin (na przykład 16, 17 - dihydro-GA5).
INNE HORMONY ROŚLINNE:
 |
| Źródło: Wikipedia. Wzór strukturalny brasinolidu. |
Najbogatszym źródłem brassinosteroidów są ziarna pyłku i niedojrzałe nasiona. W pędach oraz liściach notuje się ich niższą zawartość. Występowanie brassinosteroidów wykazano również w korzeniach niektórych roślin. Brassinosteroidy wykazują wysoką aktywność biologiczną wpływając na metabolizm, wzrost oraz rozwój roślin. Hormonom tym przypisuje się działania ochronne u roślin narażonych na stres biotycznych (patogeny wirusowe, bakteryjne, grzybowe) i abiotyczny (stres termiczny, wodny, solny i oksydacyjny, niedobór tlenu, metale ciężkie). W warunkach niskich temperatur (0-3 stopni Celsjusza) podnoszą odporność roślin na ochłodzenie i zwiększają przeżywalność roślin poddanych działaniu wysokich temperatur, stymulując syntezę białek szoku termicznego. Brassinosteroidy przyczyniają się do wzrostu masy korzeniowej i zwiększenia zawartości sacharozy. Stymulują aktywność syntetazy sacharozy pod wpływem stresu wodnego. W przypadku stresu solnego, hormony te przyspieszają kiełkowanie oraz rozwój nasion, hamują degradację barwników fotosyntetycznych i obniżają przepuszczalność błon plazmatycznych dla jonów sodowych. W warunkach stresu oksydacyjnego brassinosteroidy powodują wzrost aktywności antyoksydantów enzymatycznych oraz zawartości kwasu askorbinowego oraz karotenoidów. Brassinosteroidy ograniczają również akumulację metali ciężkich przez rośliny i wzmagają produkcję fitochelatyn.
BIOSYNTEZA BRASSINOSTEROIDÓW: Brassinosteroidy są wytwarzane z kampesterolu. Po raz pierwszy szlak syntezy został opisany przez badaczy japońskich, a następnie skorygowany przez analizę mutantów biosyntezy brassinosteroidów u Arabidopsis thaliana, pomidorów i grochu. Miejsce syntezy brassinosteroidów nie zostało doświadczalnie ustalone. Przyjmuje się hipotezę, że wszystkie tkanki roślinne są zdolne do syntezy BR, a jedynie u niektórych z organów roślinnych dochodzi do ekspresji genów odpowiedzialnych za tworzenie łańcucha przekazywania sygnału. Hipotezę tę potwierdzają obserwacje stosunkowo niewielkiego zasięgu działania hormonów z grupy brassinosteroidów. Doświadczenia wykazały, że akropetalny transport brassinosteroidów na większe odległości w organizmach roślin jest możliwy, jednak nie wiadomo czy taki transport ma jakieś znaczenie biologiczne.
 |
| Źródło: 6e.plantphys.net - Biosynteza brassinosteroidów. |
- Stymulacja wzrostu i wydłużania komórek we współdziałaniu z auksynami,
- Niejasna rola odgrywana także w zachodzeniu podziałów komórkowych i odtwarzaniu ściany komórkowej,
- Wywoływanie różnicowania się komórek naczyniowych,
- Konieczność przy formowaniu łagiewki pyłkowej,
- Przyspieszanie starzenia się komórek w zamierających hodowlach tkankowych. Opóźnienie starzenia w mutantach o obniżonej ilości brassinosteroidów wskazuje na takie działanie także w całych roślinach.
- Mogą działać ochronnie podczas okresu chłodu i suszy działającej na rośliny.
W regulacji reakcji nadwrażliwości stwierdzono udział, m.in. brassinosteroidów (BR), które wpływają na metabolizm, wzrost i rozwój roślin, a także pełnią funkcję ochronną przed niekorzystnymi warunkami środowiska. Współdziałają synergistycznie z innymi fitohormonami, np. etylenem, kwasem jamonowym czy kwasem salicylowym, które decydują o nabyciu przez rośliny odporności na infekcje. Brassinosteroidy regulują aktywność genów związanych z wydłużaniem ściany komórkowej oraz wpływają na aktywność enzymów modyfikujących ścianę komórkową, np. acetyloesterazę. Inicjują biosyntezę celulozy w ścianach komórkowych Arabidopsis thaliana (L.) Heynh zainfekowanych patogenami oraz przyspieszają działanie systemu antyoksydacyjnego. Brassinosteroidy uczestniczą w mechanizmach indukcji genów i transdukcji sygnałów związanych z odpornością nabytą i pod wpływem BR podnosi się odporność tytoniu zainfekowanego wirusem mozaiki tytoniowej (TMV) ogórka - Sphaerotheca fuliginea (Schlecht.) Pollacci czy pomidora - Botrytis cinerea Pers. Ponadto hormony te indukują ekspresję genów kodujących syntezę peroksydazy oraz białek związanych z przebiegiem patogenezy PR-3 (chitynazy). W liściach jęczmienia zainfekowanego grzybem Helminthosporium teres Sacc., a następnie traktowanych BR, stwierdzono podwyższony poziom peroksydazy oraz wolnych kwasów fenolokarboksylowych.
ŹRÓDŁO INFORMACJI: "ROLA BRASSINOSTEROIDÓW W ODPOWIEDZI ROŚLIN NA DZIAŁANIE PATOGENÓW": A. BAJGUZ, I. CIERESZKO.
-> Inna funkcja brassnosteroidów: ODPOWIEDŹ ROŚLIN NA STRES METALI CIĘŻKICH
 |
| Źródło: Wikipedia. Florigen ma bez- pośrednio wpływać na wykształcenie kwiatu. |
 |
| Źródło: spring8.or.jp - Schemat działania florigenu. |
 |
| Źródło: Wikipedia. Chemiczna struktura znanych karrikin. Zidentyfikowano tylko cztery karrikiny, wszystkie to pochodne butenolidowe. |
POWSTAWANIE KARRIKIN: Pochodzenie karrikin nie zostało w pełni wyjaśnione. Ekstrakty biologicznie czynne mogą być wytworzone poprzez podgrzanie, do temperatury 180 stopni Celsjusza przez 30 minut, roztworu aminokwasów lub białek oraz węglowodanów. Wskazuje to na możliwość powstawania karrikin podczas pożarów z węglowodanów i aminokwasów. Możliwe, że do powstania potrzebne jest jedynie spalenie celulozy.
DZIAŁANIE KARRIKIN: Wykazano stymulowanie kiełkowania u ponad 1200 gatunków roślin z 80 rodzajów przez dym pochodzący z pożarów. Są wśród nich gatunki z różnych stref klimatycznych i różnych ekosystemów, należące do nagozalążkowych i okrytozalążkowych. Na dym reagują nasiona w strefie objętej pożarem oraz znajdujące się w pobliżu. Wrażliwość na dym wykazują także niektóre gatunki roślin uprawnych. Mechanizm działania karrikin nie został wyjaśniony. Możliwe, że KAR1 wpływa na receptor odpowiedzialny za reakcje na wiele bodźców środowiskowych. Inną możliwością jest istnienie specyficznego receptora odpowiedzialnego za odebranie informacji o pożarze.
WIĘCEJ INFORMACJI: TUTAJ (STRONA 20, 21).
 4) 1-Metylocyklopropen (1-MCP) - jest to organiczny związek chemiczny, metylowa pochodna cyklopropenu. 1-MCP jest syntetycznym hormonem roślinnym zawierającym element strukturalny etylenu, naturalnego hormonu roślinnego. Jest również stosowany na skalę przemysłową do spowalniania dojrzewania owoców oraz utrzymywania świeżości kwiatów ciętych. 1-MCP jest cykloalkenem o wzorze chemicznym C4H6. W warunkach standardowych jest gazem. Skrapla się pod ciśnieniem normalnym w ok. 5-12 stopni Celsjusza. W stanie ciekłym jest niestabilny. Stosunkowo dobrze rozpuszcza się w wodzie.
4) 1-Metylocyklopropen (1-MCP) - jest to organiczny związek chemiczny, metylowa pochodna cyklopropenu. 1-MCP jest syntetycznym hormonem roślinnym zawierającym element strukturalny etylenu, naturalnego hormonu roślinnego. Jest również stosowany na skalę przemysłową do spowalniania dojrzewania owoców oraz utrzymywania świeżości kwiatów ciętych. 1-MCP jest cykloalkenem o wzorze chemicznym C4H6. W warunkach standardowych jest gazem. Skrapla się pod ciśnieniem normalnym w ok. 5-12 stopni Celsjusza. W stanie ciekłym jest niestabilny. Stosunkowo dobrze rozpuszcza się w wodzie. MECHANIZM DZIAŁANIA 1-MCP: Produkowany przez rośliny (głównie owoce) etylen występuje powszechnie w niewielkich ilościach i oddziałuje jako substancja śladowa na rośliny, stymulując bądź regulując wiele procesów biochemicznych, takich jak dojrzewanie owoców, otwieranie kwiatów czy zrzucanie liści. 1-MCP blokuje receptory etylenu w komórkach i hamuje procesy indukowane przez etylen.
ZASTOSOWANIE 1-MCP W PRAKTYCE: Wyróżnia się dwa główne komercyjne sposoby zastosowania 1-MCP w praktyce. Pierwsze z nich, w kwiaciarstwie, to utrzymywanie świeżości kwiatów ciętych, natomiast drugie, w przechowalnictwie owoców, do spowalniania procesu dojrzewania zebranych już owoców. 1-MCP jest stosowany w mieszaninie z innymi substancjami w roztworze wodnym, z którego są uwalniane do atmosfery w szczelnie zamkniętym pomieszczeniu (chłodnie owoców, przechowalnie, szklarnie, kontenery do transportu, chłodnie samochodowe).
 |
| Źródło: "1-MCP (1-methylcyclopropene) Treatment Protocol for Fruit or Vegetables" - G. Dan, G. Martin, S. Yosi, B. Dario, A. Asaph - Vol 7, Iss 10, May 20, 2017 - BioProtocol - https://bio-protocol.org/e2278 |
 |
| Źródło: Wikipedia. Poliaminy. |
Wysoki poziom poliamin występuje w tkankach charakteryzujących się wysoką intensywnością podziałów komórkowych. Najwyższy poziom obserwowano w komórkach pod koniec fazy G1. Prawdopodobnie związki te są niezbędne podczas replikacji DNA. Zarówno mutanty niemające zdolności syntezy poliamin, jak i rośliny potraktowane inhibitorami syntezy poliamin wykazują zahamowanie rozwoju. Poza wpływem na cykl komórkowy stwierdzono również udział PA w reakcji na stres, starzeniu oraz regulacji tempa wzrostu i różnicowania się komórek.
Znaczne ilości PA występują w organach młodych, a dodanie poliamin egzogennych może hamować starzenie się organów roślin. Stwierdzono również zaburzenia w morfogenezie u mutantów z defektami szlaków syntezy PA. Synteza poliamin u roslin wyższych może przebiegać przy udziale dekarboksylazy argininy (ADC) albo dekarboksylazy ornityny (ODC). U większości grzybów stwierdzono występowanie jedynie szlaku ODC, jednak u niektórych gatunków grzybów chorobotwórczych dla roślin występują obie drogi syntezy PA.
PODSUMOWANIE: Doskonałym podsumowaniem informacji na temat fitohormonów jest według mnie wykład Pana Tomasza Gełdona - nauczyciela biologii w V LO im. A. Witkowskiego w Krakowie pt. "Historia fitohormonów, czyli jak Darwin poruszył światem roślin". Serdecznie zapraszam do obejrzenia filmu z tego wykładu, który jest ogólnodostępny na kanale Centrum Nauki Kopernik w Warszawie:















Bardzo fajny wpis. Pozdrawiam.
OdpowiedzUsuńOj dla mnie to już jest zbyt skomplikowane i raczej na ten moment nic z tych rzeczy nie zrozumiem. Natomiast jestem zdania, że to co napisano w https://www.gazeta-mosina.pl/2019/jak-walczyc-z-chorobami-pszenicy-ozimej/ to jest bardzo ważna kwestia. W końcu walczyć z chorobami pszenicy ozimej należy od razu.
OdpowiedzUsuń