1) Aparat fotosyntetyczny (ang. photosynthetic apparatus) - jest to zestaw wszystkich elementów uczestniczących w przeprowadzaniu fotosyntezy. U eukariotycznych organizmów fotosyntetyzujących aparat fotosyntetyczny zlokalizowany jest w chloroplastach. U sinic są to tylakoidy.
2) Asymilaty - są to produkty fotosyntezy występujące u roślin i innych fotoautotrofów. Powstają one na skutek asymilacji (asymilacja, z łac. assimilatio - upodobanie, od similis - podobny - to w biologii proces przemiany substancji i materiałów pobranych z otoczenia na substancje dla potrzeb własnego organizmu; asymilacja jest częścią procesu przemiany materii) prostych związków nieorganicznych (najczęściej dwutlenku węgla i wody). Do asymilatów zalicza się zarówno bezpośrednie produkty fotosyntezy (triozy), jak i część ich pochodnych. Zwykle są to glukoza, sacharoza i skrobia.
3) Chlorosom (pęcherzyki Chlorobium) - jest to pęcherzykowata struktura występująca u bakterii zielonych, pełniąca rolę kompleksu antenowego zbierającego światło. Są strukturami połączonymi z błoną komórkową, w której znajdują się fotoukłąd bakteryjny - P840, do którego przekazywana jest energia wychwycona przez barwniki obecne w chlorosomach. Pojedynczy chlorosom ma elipsoidalny kształt szerokości 50-100 nm i wysokości 15-20 nm. Otoczony jest pojedynczą warstwą nieskładającą się z galaktolipidów i kilku białek. Wewnątrz chlorosomu znajdują się kompleksy zawierające głównie bakteriochjlorofile (c, d lub e - jako pigment anten oraz niewielkie ilości znajdującego się w błonie bakteriochlorofilu a bezpośrednio związanego fotosyntetycznym centrum reakcyjnym) i karotenoidy, ułożone w systemie lamellarnym, gdzie długie ogony farnezolu (farnezol to organiczny związek chemiczny, alkohol z grupy terpenów, stosowany głównie jako środek zapachowy o zapachu konwalii; jest składnikiem wielu olejków eterycznych, między innymi konwaliowego, lipowego, muszkatołowego i akacjowego. Otrzymuje się go z olejków kwiatu lipy. Stosowany jest w przemyśle perfumeryjno - kosmetycznym) bakteriochlorofili mieszają się z cząsteczkami karotenoidów, tworząc struktury przypominające wielowarstwę lipidową.
4) Chromatofor bakterii - w zależności od ujęcia są to błoniaste struktury występujące u bakterii fotosyntetyzujących o kształcie pęcherzyków lub warstwowo ułożonych błon, albo jedynie pęcherzykowate tylakoidy występujące u bakterii purpurowych. Struktury spełniają funkcję aparatu fotosyntetycznego. Powstają przez wpuklenie błony komórkowej i mają zbliżony do niej skład. U bakterii purpurowych chromatofory są prymitywnymi organellami (pseudoorganellami), inwaginacją błony cytoplazmatycznej, w której obrębie zlokalizowane są wszystkie elementy niezbędne do przeprowadzania fotosyntezy. Struktura taka u Rhodobacter (Rba.) sphaeroides zawiera 10 dimerycznych superkompleksów składających się z centrum reakcji (RC) oraz kompleksu zbierającego światło I (LH I), 100 kompleksów zbierających świa†ło II (LH II), 5 kompleksów cytochromowych bc1 i 1-4 syntaz ATP.
5) Faza jasna fotosyntezy:
6) Cykl Calvina - Bensona - Basshama (CBB), redukcyjny cykl węgla - jest to biochemiczny cykl, który zachodzi w stromie chloroplastów oraz cytoplazmie niektórych bakterii, jest to drugi etap fotosyntezy określany jako faza bezpośrednio niezależna od światła lub faza ciemna fotosyntezy. W cyklu Calvina zostają zużyte produkty reakcji świetlnych fotosyntezy, ATP i NADPH, określane jako siła asymilacyjna, jednocześnie z dwutlenku węgla zostają wytworzone cukry proste w postaci heksoz. Sumaryczne równanie reakcji zachodzących w cyklu Calvina jest następujące:
6CO2 + 18ATP + 12NADPH -> C6H12O6 + 18ADP + 18Pi + 12NADP+ + 6H20.
W Cyklu Calvina-Bensona wyróżnia się trzy fazy:
a) Faza karboksylacyjna, w której CO2 wiązany jest do rybulozo-1,5-bisfosforanu. W efekcie powstają dwie cząsteczki 3-fosfoglicerynianu.
b) Faza redukcyjna, w której 3-fosfoglicerynian ulega przekształceniu do aldehydu 3-fosfoglicerynowego. Związek ten może zostać przekształcony do heksoz.
c) Faza regeneracyjna, w której z cząsteczek aldehydu 3-fosfoglicerynowego zostaje odtworzony akceptor CO2 - rybulozo-1,5-bisfosforan.
 |
| Źródło: Wikipedia. Przebieg cyklu Calvina. Czerwone liczby oznaczają liczbę cząsteczek biorących udział w reakcji. |
Cykl został odkryty przez Melvina Calvina i Andrew Bensona z Uniwersytetu Kalifornijskiego w Berkeley, znaczący wkład miał również James Bassham. Za prace nad cyklem Melvin Calvin otrzymał Nagrodę Nobla w dziedzinie chemii w 1961 roku.
PRZEBIEG:
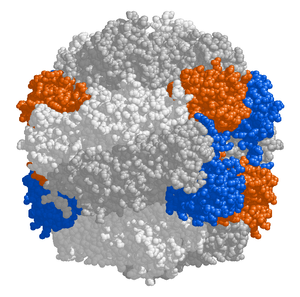 |
Źródło: Wikipedia. Struktura RuBisCO. Podjednostki duże (L)
w kolorze szarym, podjednostki małe (S) w kolorach niebieskim i
pomarańczowym.
|
B) FAZA REDUKCYJNA (redukcji) - faza redukcji składa się z dwóch reakcji w wyniku których zostaje wytworzony prosty cukier - fosfotrioza - aldehyd 3-fosfoglicerynowy. Powstały w fazie karboksylacyjnej 3-fosfoglicerynian (PGA) przy udziale ATP ulega fosforylacji do 1,3-bisfosfoglicerynianu. Reakcję katalizuje kinaza fosfoglicerynowa. Produkt reakcji jest następnie redukowany, przy zużyciu NADPH, do aldehydu 3-fosfoglicerynowego. Część powstałego aldehydu 3-fosfoglicerynowego przekształcana jest przez izomerazę fosfotriozową do fosfodihydrokcyacetonu (DHAP). Oba, PGAL i DHAP, ulegają kondensacji w reakcji katalizowanej przez aldolazę. W efekcie zostaje wytworzona heksoza - 1,6 - bisfosfofruktoza. Może ona być łatwo przekształcona w glukozę. Większość powstałych w fazie redukcji fosfotrioz nie jest przekształcana w glukozę lecz przechodzi do kolejnego etapu cyklu Calvina.
B) FAZA REGENERACYJNA (regeneracji) - w tej fazie z aldehydu 3-fosfoglicerynowego i jego izomeru fosfodihydroksyacetonu odtwarzana jest w wyniku wielu reakcji chemicznych 1,5-bisfosforybuloza. Kluczowymi enzymami biorącymi udział w przekształcaniu węglowodanów są aldolaza i transketolaza. Aldolaza katalizuje reakcję kondensacji aldolowej fosfodihydroksyacetonu z aldehydem. Po połączeniu obu cząsteczek powstaje fruktozo-1,6-bisfosforan. Po odłączeniu jednej z reszt fosforanowych powstaje fruktozo-6-fosforan. Związek ten łatwo może zostać przekształcony w glukozo-6-fosforan lub glukozo-1-fosforan i posłużyć do syntezy skrobi. Jednak aby cykl Calvina mógł zachodzić konieczne jest wykorzystanie części fruktozo-6-fosforanu do odtworzenia rybulozo-1,5-bisfosforanu. Transketolaza jest enzymem zdolnym do przeniesienia jednostki dwuwęglowej z ketozy na aldozę. Jednostka ta jest pobierana z fruktozo-6-fosforanu i przyłączana do cząsteczki aldehydu 3-fosfoglicerynowego. W efekcie odłączenie jednostki dwuwęglowej powstaje erytrozo-4-fosforan, a z aldehydu powstaje pięciowęglowy cukier - ksylulozo-5-fosforan. Związek ten przekształcany jest do rybulozo-5-fosforanu przez epimerazę fosfopentozową. Erytrozo-4-fosforan zostaje połączony z fosfodihydroksyacetonem w kolejnej reakcji katalizowanej przez aldolazę. Produktem reakcji jest cukier siedmiowęglowy - sedoheptulozo-1,7-bisfosforan. Jest on dawcą kolejnej jednostki dwuwęglowej przenoszonej przez transketolazę na aldehyd 3-fosfoglicerynowy. Jednak przed przeniesieniem od sedoheptulozo-1,7-bisfosforanu odłączana jest reszta fosforanowa w pozycji 1. Reakcję hydrolizy katalizuje fosfataza sedoheptulozo-1,7-bisfosforanowa. Produktami reakcji katalizowanej przez transketolazę są dwa cukry pięciowęglowe, rybozo-5-fosforan będący pozostałością siedmiowęglowego węglowodanu i ksylulozo-5-fosforan. Ten ostatni przekształcany jest przez izomerazę fosfopentozową do rybulozo-5-fosforanu. Ostatecznym produktem wymienionych reakcji jest więc zawsze pięciowęglowy rybulozo-5-fosforan. W celu odtworzenia związku będącego akceptorem CO2 cukier zostaje ufosforylowany w pozycji 1 przez kinazę fosforybulozy. Podczas fosforylacji zostaje zużyta cząsteczka ATP, a produktem jest pierwszy związek cyklu - rybulozo-1,5-bisfosforan.
Pierwszy z kluczowych enzymów, aldolaza, przenosi jednostki trójwęglowe fosforanu dihydroksyacetonu dzięki wiązaniu grupy karbonylowej ketozy do epsilon-aminowej reszty lizyny, w centrum aktywnym enzymu. Połączenie z grupą aminową ma charakter zasady Schiffa. Do związanej ketozy przyłączany jest substrat aldozowy.
Reakcje katalizowane przez aldolazę i transketolazę są reakcjami odwracalnymi i mogą być wykorzystywane w rozkładzie heksoz, co ma miejsce w cytozolu gdzie zachodzi szereg reakcji odwrotnych w stosunku do fazy regeneracji nazywanych szlakiem pentozofosforanowym.
 |
| Źródło: Wikipedia. Reakcje cyklu Calvina. Kolorem czerwonym podano nazwy enzymów katalizujących reakcje, kolorem niebieskim podano liczbę cząsteczek biorących udział w poszczególnych reakcjach. |
W wyniku cyklu Calvina-Bensona zużywane są wytworzone w fazie jasnej ATP i NADPH, a ich energia magazynowana jest w postaci wiązań cukrów wytwarzanych w cyklu.
REAKCJE FOTOODDYCHANIA:
Endiolowy produkt pośredni uczestniczący w reakcji katalizowanej przez RuBisCO może łączyć się nie tylko z CO2, lecz również z O2. W tym przypadku enzym wykazuje właściwości oksygenazy. Po przyłączeniu cząsteczki tlenu powstaje wodoronatlenkowy produkt pośredni przekształcany w jedną cząsteczkę fosfoglikolanu i jedną 3-fosfoglicerynianu. Powstały 3-fosfoglicerynian może posłużyć do odtworzenia RuBP. Fosfoglikolan jest nieprzydatny w reakcjach cyklu Calvina jednak w szlaku metabolicznym określanym jako fotooddychanie jest częściowo odzyskiwany. W wyniku przekształcania w peroksysomach i mitochondriach na dwie cząsteczki fosfoglikolanu na cztery atomy węgla odzyskiwane jest trzy w postaci 3-fosfoglicerynianu powracającego do chloroplastów, jeden atom węgla jest tracony poprzez wydzielanie CO2 w mitochondriach. Przy atmosferycznych stężeniach tlenu i dwutlenku węgla i temperaturze 25 stopni Celsjusza stężenie obydwu związków biorących udział w reakcji wynosi odpowiednio 250 μM i 10 μM, dzięki czemu reakcja karboksylacji zachodzi czterokrotnie szybciej niż oksygenacja.
REGULACJA CYKLU CALVINA:
Zachodzenie cyklu umożliwiającego wytworzenie związków organicznych z CO2. W celu precyzyjnej koordynacji fazy świetlnej z reakcjami cyklu Calvina organizmy fotosyntetyzujące posiadają mechanizmy kontrolne. Enzymy cyklu są aktywowane w wyniku wzrostu pH stromy, wzrostu stężenia jonów Mg2+, NADPH oraz zredukowanej ferredoksyny.
ZMIANY STĘŻENIA JONÓW I AKTYWAZA RuBisCO: W wyniku zachodzenia fazy świetlnej fotosyntezy jony wodorowe ze stromy przenoszone są do wnętrza tylakoidów. Podniesienie pH stromy chloroplastów ułatwia powstawanie karbaminianu, który przyłączany jest do RuBisCO powodując aktywację enzymu. Przenoszenie protonów przez błony tylakoidów wiąże się z powstawaniem różnicy potencjałów poprzek błony. Jest ona częściowo kompensowana przez przepływ jonów Mg2+ z wnętrza tylakoidów do stromy. Jony magnezu sąd rugim składnikiem niezbędnym do przeprowadzenia reakcji przez karboksylazę RuBP.
Białko, aktywaza RuBisCO, odrywa od karboksylazy RuBP cząsteczkę w-1,5-bisfosforanu umożliwiając dostęp jonów Mg2+ oraz CO2 do centrum aktywnego RuBisCO. Aktywacja jednej cząsteczki RuBisCO przez aktywazę wiże się z hydrolizą 50 cząsteczek ATP. U roślin zostały odnalezione dwie izoformy aktywazy RuBisCO o masach 42 i 46 kDa. Obie izoformy zdolne są do aktywowania karboksylazy RuBP i hydrolizy ATP, jednak większa z nich wykazuje niższą wydajność. Regulacja aktywności karboksylazy RuBP przez światło związana jest ze zmianami aktywności dużej izoformy aktywazy RuBisCO.
Aktywacja RuBisCO wymaga wzjamenego dopasowania obu enzymów. Aktywaza RuBisCO nie jest w stanie aktywować karboksylazy w szpinaku lub Chlamydomonas, a aktywaza z tych gatunków nie wpływa na aktywność karboksylazy RuBP tytoniu.
TIOREDOKSYNA: Tioredoksyna to niewielkie białko o masie 12 kDa obecne w stromie chloroplastów. Białko zawiera sąsiadujące ze sobą reszty cysteiny, które mogą znajdować się w formie utlenionej tworząc mostek dwusiarczkowy lub w formie zredukowanej, tiolowe. Chociąż sama tioredoksyna nie jest enzymem cyklu Calvina może ona służyć jako reduktor dla enzymó∑ cyklu. Jedynie zredukowane formy enzymów wykazują aktywność. Aktywacja, następuja na świetle, na skutek przeniesienia elektronów z ferredoksyny na tioredoksynę w reakcji katalizowanej przez reduktazę ferredoksyna - tioredoksyna co prowadzi do zerwania mostku dwusiarczkowego, i następnie na enzymy katalizujące reakcje asymilacji CO2.
TWORZENIE KOMPLEKSÓW ENZYMÓW: W ciemności enzymy cyklu ulegają dezaktywacji. Odbywa się to poprzez połączenie kinazy fosforybulozy i dehydrogenazy aldehydu 3-fosfoglicerynowego za pośrednictwem niewielkiego białka określanego jak CP12. Kompleks złożony z dwóch enzymów i białka CP12 nie wykazuje aktywności. Rozpad kompleksu następuje po zredukowaniu kinazy fosforybulozy przez tioredoksynę i przyłączenie NADPH do nieaktywnego kompleksu. Do rozdzielenia enzymów dochodzi na świetle gdy stężenie NADPH w stromie wzrasta na skutek zachodzenia reakcji fazy świetlnej.
MAGAZYNOWANIE PRODUKTÓW CYKLU: Węglowodany gromadzone są w organizmach roślin głównie w postaci skrobi i sacharozy. Cząsteczki skrobi mogą być syntetyzowane bezpośrednio w chloroplastach z glukozy, która ulega aktywacji poprzez przyłączenie cząsteczki ATP, co prowadzi do powstania ADP-glukozy. Sacharoza wytwarzana jest w cytozolu. Do syntezy cząsteczki sacharozy wykorzystywany jest fruktozo-6-fosforan i UDP-glukoza. Reakcję przeprowadza syntaza sacharozo-6-fosforanowa. Pomimo możliwości wytworzenia heksoz w chloroplastach, zarówno fruktozo-6-fosforan, jak i glukozo muszą być syntetyzowane w cytozolu, ponieważ w błonach chloroplastów nie ma przenośników dla fosforanów heksoz. Z chloroplastów do cytozolu dostarczane są trizofosforany, służące następnie do syntezy obu niezbędnych heksoz. Zaletą wykorzystania sacharazy jako cukru zapasowego jest jego dobra rozpuszczalność i związana z tym łatwość przenoszenia pomiędzy organami rośliny.
EWOLUCJA: Cykl Calvina zachodzi w chloroplastach, jednak tylko jeden z enzymów kodowany jest przez genom chloroplastowy. Pozostałe enzymy cyklu kodowane są przez genom jądrowy.Może być to wynikiem ewolucji genomu jądrowego. Istnieją jednak dowody, że geny chloroplastowe mogły zostać przeniesione do genomu jądrowego.
HISTORIA BADAŃ: Badania mechanizmów fotosyntetycznej asymilacji CO2 rozpoczął Samuel Ruben w roku 1939, stosując początkowo izotop węgla C11. Badania ułatwiło odkrycie przez Rubena i Martina Kamena izotopu węgla C14. Jednak nagła śmierć Samuela Rubena spowodowała przerwanie badań w roku 1943. Zostały one wznowione w roku 1945 przez Earnesta O. Lawrence'a kierującego University of California Radiation Laboratory, który powierzył Melvinowi Calvinowi zadanie stworzenie grupy zajmującej się badaniami chemicznymi i biochemicznymi przy użyciu radioizotopów. Do kierowania podgrupą badającą fotosyntezę został wyznaczony Andrew Benson. Po zakończeniu II wojny światowej do grupy badającej przebieg fotosyntezy dołączył James A. Bassham. Badania nad asymilacją węgla prowadzono przy użyciu znakowanego 14CO2, który podawano kulturom roślin lub glonom. Następnie związki powstające podczas fotosyntezy rozdzielano przy pomocy dwukierunkowej chromatografii bibułowej i identyfikowano powstające związki pośrednie. Początkowo pojawienie się znakowanego izotpu węgla obserwowano głównie w czterowęglowych kwasach dwukarboksylowych, jabłczanie i bursztynianie. Pierwsza próba wyjaśnienia fotosyntetycznej asymilacji węgla zakładała dwie reakcje karboksylacji prowadzące do wytworzenia kwasów dwukarboksylowych. Rozpad tych kwasów na komponenty dwuwęglowe miał dostarczać substratów do pierwszej reakcji karboksylacji. Dalsze badania wykazały, że pierwszym produktem fotosyntezy jest związek trzywęglowy, fosfoglicerynian, a do jego powstania konieczny jest pięciowęglowy akceptor CO2 w postaci RuBP. Udział enzymów w karboksylacji RuBP wykazano po raz pierwszy w roku 1954, określając enzym uczestniczący w reakcji jako karboksydysmutazę. Zestaw enzymów biorących udział w redukcyjnym cyklu węgla został opublikowany przez zespół Calvina w roku 1962. W roku 1961 Melvin Calvin za badania nad asymilacją dwutlenku węgla u roślin otrzymał Nagrodę Nobla. Dalsze badania doprowadziły do poznania mechanizmów regulacji cyklu Calvina. W roku 1985 został opisany uniwersalny regulator aktywności enzymu RuBisCO - aktywaza RuBisCO.
7) Odwrotny Cykl Krebsa (Reduktywny cykl kwasów karboksylowych) - jest to zespół reakcji biochemicznych podczas których CO2 włączany jest w związki organiczne przy udziale ferredoksyny i ATP. Cykl ten jest sposobem asymilacji dwutlenku węgla u części fotosyntetyzujących purpurowych bakterii siarkowych i bakterii zielonych. Zasadniczo reakcje reduktywnego cyklu kwasów karboksyowych są odwróceniem reakcji zachodzących w cyklu kwasu cytrynowego zachodzącego w mitochondriach. W reduktywnym cyklu CO2 jest przyłączany do bursztynylo-CoA, kwasu alfa-ketoglutaranowego i acetylo-CoA. Do redukcji powstających związków organicznych używana jest ferredoksyna. Reakcje wymagają także dostarczenia energii w postaci ATP. Jako donory elektronów służyć mogą także wodór i siarczany. Redukcyjny cykl kwasu cytrynowego jest alternatywnym sposobem asymilacji CO2, przebiegającej w cyklu Calvina. Wykazano, że kilka z reakcji cyklu redukcyjnego może być katalizowanych przez związki nieorganiczne.
8) Cykl hydroksypropionowy, droga hydroksypropionowa, cykl 3-hydroksypropionowy - jest to droga autotroficznego wiązania CO2, przez termofilne, fototroficzne bakterie typu Chloroflexus. Warianet tego szlaku metabolicznego występuje także u autotroficznych przedstawicieli Sulfolobales (Crenarchaeota).
Cykl hydroksypropionowy rozpoczyna przyłączenie cząsteczki CO2 do acetylo-CoA przez karboksylazę acetylo-CoA. Reakcja wymaga dostarczenia energii w postaci ATP. Powstały malonylo-CoA redukowany jest do hydroksypropionylo-CoA i w kolejnej reakcji do propionylo-CoA. Karboksylaza priopionylo-CoA przyłącza kolejną cząsteczkę CO2. Reakcja ta podobnie jak pierwsza karboksylacja wymaga dostarczenia energii w postaci ATP. Po przyłączeniu drugiej cząsteczki CO2 zostaje wytworzony metylomalonylo-CoA rozkładany na acetylo-CoA i cząsteczkę kwasu glioksalanowego. W efekcie jednego obrotu cyklu dwie cząsteczki CO2 zostają włączane do związku organicznego - powstaje jedna cząsteczka kwasu glioksalanowego. Zużyte zostają także 3 cząsteczki ATP i dwie cząsteczki równoważników redukcyjnych.
9) Cykl ksantofilowy - zachodzi on w błonach tylakoidów i jest jednym z mechanizmów chroniącym rośliny przed fotoinhibicją. Podczas oświetlania roślin silnym światłem barwniki fotosyntetyczne absorbują więcej energii świetlnej niż jest konieczne do przeprowadzania fotosyntezy. W przypadku gdy energia wzbudzenia chlorofilu nie może być przekazana do centrum reakcji chlorofil ze stanu singletowego przechodzi do stanu trypletowego, co prowadzi do wytwarzania reaktywnych form tlenu - tlenu singletowego. W silnym świetle jeden z barwników wchodzących w skład kompleksów antenowych - wiolaksantyna przekształcany jest w zeaksantynę. Reakcja ta katalizowana jest przez deepoksydazę wiolaksantyny, a produktem pośrednim reakcji jest anteraksantyna. Reakcja ta rozoczyna się, gdy na skutek działania fotosyntetycznego łańcucha transportu elektronów do wnętrza tylakoidu (lumen) zostanie przeniesiona znaczna ilość jonów wodorowych - następuje zakwaszenie wnętrza tylakoidu. Powstała zeaksantyna posiada zdolność do przejmowania energii z wzbudzonego chlorofilu w stanie trypletowym i rozpraszania jej w postaci ciepła. Chroni to fotoukłady przed uszkodzeniem podczas nadmiernego oświetlania. W ciemności lub przy niskim natężeniu światła zeaksantyna przekształcana jest w wiolaksantynę przez enzym - epoksydazę zeaksantynową, także w tej reakcji produktem pośrednim jest anteraksantyna. Wiolaksantyna może absorbować światło o długości fali nie absorbowanej przez chlorofil. Energia wzbudzenia wiolaksantyny przekazywana jest na cząsteczkę chlorofilu, a następnie do centrum reakcji fotoukładu. Dzięki temu mechanizmowi długości fali, nie absorbowane przez chlorofil stają się także użyteczne w procesie fotosyntezy.
10) Cykl Q - jest to seria reakcji biochemicznych, których przebieg jako pierwszy opisał Peter D. Mitchell w 1977 roku. Kolejne reakcje utleniania i redukcji przenośnika elektronów znajdującego się w błonach białkowo-lipidowych, ubichinonu (zwanego również jako koenzym Q) prowadzą do przenoszenie protonów przez dwuwarstwę lipidową. Zmodyfikowana wersja schematu zaproponowanego przez Mitchella tłumaczy w jaki sposób kompleks III obecny w błonie mitochondrialnej przenosi protony z macierzy mitochondrialnej (matrix) do przestrzeni międzybłonowej (perymitochondrialnej) (powstały w poprzek błony gradient elektrochemiczny umożliwia syntezę ATP kompleksowi syntazy ATP obecnej w błonach mitochondriów i chloroplastów). Działanie cyklu Q polega na zredukowaniu cytochromu c (mitochondria) lub plastocyjaniny (chloroplasty) z jednoczesnym utlenieniem ubichinonu (mitochondria) lub plastochinonu (chloroplasty).
PRZEBIEG CYKLU Q W MITOCHONDRIACH: Cykl Q w mitochondriach zachodzi na kompleksie III określanym jako reduktaza ubichinol-cytochrom c.
Zredukowana forma ubichinonu-ubichinolu QH2 przyłączana jest do histydyny 182 białka zawierającego żelazo i siarkę - tzw. białko Rieskiego oraz do glutaminianu 272 cytochromu b. Jeden z elektronów z cząsteczki ubichinonu przekazywany jest na białko Rieskiego, redukując znajdujące się w białku żelazo z +3 na +2 stopień utlenienia, a następnie na cytochrom c1, redukując żelazo w układzie hemowym. Elektron ten trafia kolejno na cząsteczkę cytochromu c niezwiązaną z kompleksem III mitochondriów. Pozbawiony elektronu wodór z histydyny 181 uwalniany jest do przestrzeni międzybłonowej. Drugi elektron z ubichinonu przenoszony jest na żelazo hemowe niskopotencjałowej formy cytochromu bL, po czym trafia na wysokopotencjałową formę cytochromu bH. Następnie elektron redukuje cząsteczkę ubichinonu przyłączoną w specyficznym miejscu na kompleksie bc1. Cząsteczka ubichinonu przyłącza za pośrednictwem glutaminianu 272 proton pobrany z macierzy mitochondrialnej. Ubichinon po przyłączeniu protonu staje się semichinonem, a po dostarczeniu drugiego elektronu przechodzi w ubichinol i odrywa się z miejsca redukcji ubichinonu. Powstały ubichinol może przekazać swoje elektrony w miejscu utlenienia ubichinonu na kompleksie III.
W efekcie utlenienia dwóch cząsteczek ubichinonu dwa elektrony przekazywane są na cytochrom c, cztery protony uwalniane do przestrzeni międzybłonowej, dwa protony pobrane są z macierzy mitochondrialnej oraz powstaje jedna cząsteczka ubichinolu mogąca brać udział w cyklu Q.
PRZEBIEG CYKLU Q W CHLOROPLASTACH: Niemal identyczny mechanizm przenoszenia protonów występuje u roślin w chloroplastach podczas wytwarzania gradientu protonowego w poprzek błony tylakoidów. W chloroplastach za katalizowanie reakcji utleniania plastochinolu i redukcję plastocyjaniny odpowiedzialny jest kompleks cytochromowy b6f - reduktaza plastochinol-plastocyjanina obecny w błonie tylakoidów. Podobnie jak w mitochondriach, w efekcie utlenienia dwóch cząsteczek plastochinolu dwa elektrony przekazywane są na plastocyjaninę, cztery protony uwalniane do wnętrza tylakoidu, dwa protony zostają pobrane ze stromy oraz powstaje jedna cząsteczka plastochinolu mogąca brać udział w kolejnym Q cyklu.
 11) Dinukleotyd nikotynoamidoadeninowy (NADH - forma zredukowana, NAD+ - forma utleniona) - jest to organiczny związek chemiczny, nukleotyd pełniący istotną rolę w procesach oddychania komórkowego. Różne pochodne tego związku są akceptorami elektronów i protonów w procesach utleniania komórkowego. Pełnią też rolę koenzymów oksydoreduktaz. Dinukleotyd nikotynoamidoadeninowy występuje w organizmach żywych w postaci jonów (NAD+ i NADP+) oraz w formie zredukowanej (NADH i NADPH).
11) Dinukleotyd nikotynoamidoadeninowy (NADH - forma zredukowana, NAD+ - forma utleniona) - jest to organiczny związek chemiczny, nukleotyd pełniący istotną rolę w procesach oddychania komórkowego. Różne pochodne tego związku są akceptorami elektronów i protonów w procesach utleniania komórkowego. Pełnią też rolę koenzymów oksydoreduktaz. Dinukleotyd nikotynoamidoadeninowy występuje w organizmach żywych w postaci jonów (NAD+ i NADP+) oraz w formie zredukowanej (NADH i NADPH).
NAD+/NADH - cząsteczka NAD jest dinukleotydem składającym się z adenozyno-5'-monofosforanu i nukleotydu nikotynoamidowego połączonych ze sobą wiązaniem bezwodnikowym. Cząsteczka NAD+ wiąże jeden proton i dwa elektrony, w wyniku czego reszta amidu kwasu nikotynowego ulega redukcji:

Z kolei forma zredukowana, NADH, jest utleniana na kompleksie I łańcucha oddechowego. W wyniku przenoszenia elektronów przez kolejne elementy łańcucha oddechowego zostaje wytworzony gradient elektrochemiczny zamieniany przez syntazę ATP na energię zamgazynowaną w ATP.
NADP+ / NADPH - NADP+/NADPH różni się od NAD+/NADH obecnością reszty fosforanowej przy węglu 2' rybozy nukleotydu adeninowego. NADP+ jest także akceptorem protonu i elektronów w reakcjach redukcji, w ten sposób powstaje NADPH, wytwarzany przez reduktazę ferredoksyna-NADP+ w fazie jasnej fotosyntezy. Powstały NADPH wykorzystywany jest do syntezy cukrów w cyklu Calvina. NADPH wytwarzany jest także w szlaku metabolicznym określanym jako szlak pentozofosforanowy. Jest on następnie zużytkowany w różnych reakcjach redukcji głównie w przebiegu biosyntezy kwasów tłuszczowych i cholesterolu.
12) Efekt Emersona - jest to gwałtowny wzrost efektywności fotosyntezy na skutek naświetlania komórek zdolnych do prowadzenia tego procesu jednocześnie dwoma źródłami światła monochromatycznego (barwy monochromatyczne to barwy proste, widmowe, otrzymane przez rozszczepienie światła białego) o długości fali 700 i 671 nanometra, w stosunku do efektywności tego procesu, gdy prowadzi się naświetlanie tylko jednym z tych źródeł. Z badań Emersona wysnuto wniosek, że dla efektywnego zachodzenia fotosyntezy konieczne jest współdziałanie dwóch układów barwników. Te układy barwników okazały się fotoukładami biorącymi udział w fotosyntetycznym transporcie elektronów.
13) Efekt Warburga - jest to zjawisko inhibicji fotosyntezy netto przez tlen. Efekt może być mierzony zarówno ilością asymilowanego przez komórkę CO2, jak i ilością pobieranego tlenu. Zjawisko zostało zaobserwowane przez Otto Heinricha Warburga w roku 1920 i od nazwiska odkrywcy bierze swoją nazwę.
PRZYCZYNY ZJAWISKA: Swoje badania Warburg prowadził na glonach z rodzaju Chlorella. W stężeniu tlenu 21% glony wykazywały jedynie 65% maksymalnej wydajności fotosyntezy, zaś w stężeniu tlenu bliskiemu 100% natężenie fotosyntezy spadało do 55% maksymalnej wartości. W kolejnych badaniach Warburg wykazał istnienie zjawiska u roślin wyższych. Efekt zahamowania fotosyntezy jest odwracalny. Po obniżeniu stężenia tlenu, natężenie fotosyntezy netto powtórnie wzrasta. Hamujące działanie tlenu może zostać odwrócone przez podniesienie stężenia CO2. Obserwuje się także wzrost stężenia glikolanu wraz z podnoszeniem stężenia tlenu. Wszystkie te obserwacje wskazują, że efekt Warburga jest związany ze wzrostem fotooddychania. Enzym Rubisco może przeprowadzać zarówno reakcję karboksylacji rybulozo-1,5-bisfosforanu, jak i reakcję utlenienia tego związku. Podniesienie stężenia tlenu prowadzi do zwiększenia udziału reakcji utleniania wraz ze zmniejszeniem szybkości karboksylacji. Pojawiający się w zwiększonych ilościach glikolan jest produktem reakcji utleniania. U większości roślin fotosynteza zachodzi z maksymalną wydajnością w stężeniu tlenu 2%. W tych warunkach fotooddychanie jest zahamowane przez niedobó® tlenu. W atmosferycznym stężeniu tlenu (21%) u większości roślin natężenie fotosyntezy netto jest mniejsze od maksymalnego. Spadek wydajności asymilacji CO2 następuje także w warunkach podwyższonej temperatury. Jednakże znane są rośliny, u których podniesienie stężenia tlenu z 2% do 21% nie powoduje spadku natężenia fotosyntezy netto. Są to rośliny o fotosyntezie C4, charakteryzujące się punktem kompensacyjnym CO2 bliskim zeru. W wyniku przystosowań fizjologicznych i anatomicznych te rośliny nie wykazują fotooddychania.
W pewnym stopniu na efekt Warburga mogą także odpowiadać reakcje określane jako pseudocykliczny transport elektronów. Elektrony z ferredoksyny zwykle służące do redukcji NADP mogą zostać przeniesione na tlen. W wyniku tej reakcji część energii pochłoniętej przez chlorofil jest tracona. Efekt Warburga jest sumą fotooddychania oraz pseudocyklicznego transportu elektronów. Istnieje również inne zjawisko nazywane efektem Warburga, także zaobserwowane po raz pierwszy przez Otto Heinricha Warburga. Zjawisko to polega na zwiększonej fermentacji w komórkach nowotworowych.
14) Fosforylacja fotosyntetyczna, fotofosforylacja - jest to proces zachodzący w fazie jasnej fotosyntezy w chloroplastach. Polega na wytworzeniu ATP z ADP i fosforanu nieorganicznego przy użyciu energii światła: ADP + Pi + hv (energia świetlna) -> ATP.
Proces zachodzi w chloroplastach eukariontów oraz w komórkach bakterii fotosyntetyzujących. Energia światła wykorzystywana jest przez kompleksy przeprowadzające reakcję fotochemiczną - fotoukłady. W efekcie zachodzenie reakcji katalizowanych przez fotoukłady oraz kompleks cytochromów b6f przez błonę białkowo-lipidową przenoszone są protony. Wytworzona w wyniku zachodzenia szeregu reakcji redoks różnica stężeń protonów w poprzek błony określana jest jako siła protonomotoryczna. Energia zgromadzona w postaci różnicy stężeń protonów służy do syntezy ATP przeprowadzanej przez enzym którego elementy obracają się w wyniku przepływania przez kanał jonowy jonów H+ - syntazę ATP.
Gradient protonowy może być wytworzony poprzez przekazywanie elektronów w szeregu reakcji z H2O na NADP. W tym przypadku proces określa się jako fosforylację niecykliczną, podczas której wytwarzane jest nie tylko ATP, lecz także NADPH. Elektrony mogą również zostać oderwane od barwnika obecnego w centrum reakcji, uczestniczyć w reakcjach redoks prowadzonych do wytworzenia siły protonomotorycznej i powracać do centrum aktywnego. Cykliczne zachodzenie reakcji określa się jako fosforylacja cykliczna, w której wytwarzane jest tylko ATP. Fosforylacja cykliczna może zachodzić w chloroplastach eukariontów oraz komórkach sinic. Organizmy te posiadają dwa fotoukłady i mogą przeprowadzać również fosforylację niecykliczną. Pozostałe organizmy fotosyntetyzujące posiadają tylko jedno centrum reakcji i przeprowadzają jedynie fosforylację cykliczną. Do organizmów tych zalicza się: bakterie zielone, bakterie purpurowe i heliobakterie.
FOSFORYLACJA NIECYKLICZNA: Wytworzenie ATP w chloroplastach jest możliwe dzięki szeregowi reakcji zachodzących na kompleksach obecnych w błonie tylakoidu. W organizmach wytwarzających tlen głównym sposobem wytwarzania siły protonomotorycznej jest estaw reakcji określanych jako fosforylacja niecykliczna. W efekcie tych reakcji elektrony z wody przenoszone są na NADP, który ulega redukcji do NADPH oraz protony przenoszone są do wnętrza tylakoidu ze stromy. Powstająca różnica stężeń protonów służy następnie do wytworzenia ATP. W roślinach oraz sinicach w reakcjach prowadzących wytworzenie siły protonomotorycznej odbywa się przy udziale trzech dużych kompleksów. Dwa z nich określane jako fotoukłąd I i fotoukład II to elementy wrażliwe na światło, w których dochodzi do fotoindukcyjnego rozdziału ładunków. Na trzecim - kompleksie cytochromów b6f - zachodzą reakcje dzięki którymdodatkowe protony przenoszone są przez błony tylakoidów. Wszystkie trzy kompleksy rozmieszczone są w błonie tylakoidów. W łańcuchu reakcji biorą również udział dwie małe cząsteczki. Plastochinon będący związkiem o charakterze hydrofobowym, jednak bardzo dobrze rozpuszczalnym w lipidach, dzięki czemu łatwo przemieszcza się w błonie tylakoidów ulegając redukcji na fotoukładzie II i utlenieniu na kompleksie cytochromów b6f. Druga ruchliwa cząsteczka to niewielkie białko, zawierające jon miedzi, rozpuszczalne w wodzie, ulegające redukcji na kompleksie cytochromów b6f i oddające elektrony na fotoukład I.
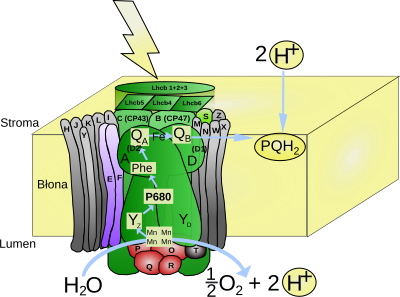
FOTOUKŁAD II: Jest to u roślin kompleks PS II składa się z czterech transbłonowych podjednostek dużych i kilkunastu małych oraz trzech podjednostek zewnątrzbłonowych. Szereg reakcji rozpoczyna się od absorpcji światła przez dimer chlorofilu a, określany jako para specjalna, ze względu na kluczową rolę w reakcjach fotofosforylacji lub P680. Absorbuje ona światło o maksymalnej długości fali 680 nm. Cząsteczki chlorofilu związane są z dimerem białek określanych jako D1 (PsbA) i D2 (PsbD). Z każdą z tych podjednostek związana jest dodatkowa cząsteczka chlorofilu (ChlD1 i ChlD2). Stan wzbudzenia zdelokalizowany jest w obrębie wszystkich czterech cząsteczek chlorofilu tworzących wraz z dimerem białek D1 i D2 centrum reakcji fotoukładu II. Wzbudzenie pary specjalnej powoduje uwolnienie elektronu, który z ChlD1, w czasie krótszym niż 10-11 s, przenoszony jest na cząsteczkę feofityny (Phe) [Feofityna to organiczny związek chemiczny o oliwkowo-brunatnej barwie, będący cząsteczką chlorofilu, w którym atom magnezu został zastąpiony przez dwa atomy wodoru. Związek ten można uzyskać poprzez działanie kwasem na chlorofil. Feofityna jest naturalnie obecna w częściach zielonych roślin, gdzie bierze udział w przenoszeniu elektronów w fazie jasnej fotosyntezy], połączonej z białkiem D1. Elektron z jonu feofityny (Ph-) może powrócić na dimer chlorofilu - P680, wykazujący maksimum absorpcji przy długości fali 680 nm. Rekombinacji ładunków zapobiega struktura fotoukładu. Kolejny akceptor elektronów, cząsteczka plastochinonu silnie związana z białkiem D2 określana jako plastochinon A (PQA), znajduje się w odległości mniejszej niż 1nm od feofityny. Jest to znaczna odległość utrudniająca powrót elektronu. Z PQA elektron przekazywany jest na cząsteczkę plastochinonu (PQB) związaną z D1. Po przyjęciu dwóch elektronów PQB i przyłączeniu dwóch protonów z stromy, ulega zredukowaniu do plastochinolu i uwalniany jest do błony tylakoidów, w której może swobodnie się przemieszczać w błonie tylakoidów. W przenoszeniu elektronów pomiędzy PQA i PQB bierze udział jon żelaza związany czterema resztami histydynowymi, po dwie z białka D1 i białka D2. Atom Fe połączony jest również z cząsteczką CO2 pełniącą jedynie rolę regulatorową w łańcuchu transportu elektronów.
25) Syntaza ATP - jest to enzym z grupy syntaz katalizujący reakcję wytwarzania ATP z ADP i fosforanu nieorganicznego Pi. Energia niezbędna do syntezy pochodzi z gradientu elektrochemicznego i przekształcana jest w energię wiązań chemicznych podczas transportu protonów przez syntazę ATP. Enzym katalizuje reakcję: ADP + Pi -> ATP.
Syntaza ATP znajduje się w wewnętrznej błonie mitochondriów, w błonach tylakoidów wewnątrz chloroplastów oraz w błonach komórkowych organizmów prokariotycznych. Enzym bierze udział w kluczowych procesach uzyskiwania energii przez organizmy żywe fosforylacji oksydacyjnej będącej głównym źródłem ATP wytwarzanego podczas oddychania komórkowego oraz fosforylacji fotosyntetycznej będącej źródłem ATP powstającego w fazie jasnej fotosyntezy. Inhibitorem syntazy ATP wykorzystywanym w badaniach biologicznych jest antybiotyk - oligomycyna.
ROLA FIZJOLOGICZNA:
BUDOWA ENZYMU: Ze względu na miejsce występowania wyróżnia się trzy podstawowe kompleksy syntazy ATP. Są to:
REAKCJE FOTOODDYCHANIA:
Endiolowy produkt pośredni uczestniczący w reakcji katalizowanej przez RuBisCO może łączyć się nie tylko z CO2, lecz również z O2. W tym przypadku enzym wykazuje właściwości oksygenazy. Po przyłączeniu cząsteczki tlenu powstaje wodoronatlenkowy produkt pośredni przekształcany w jedną cząsteczkę fosfoglikolanu i jedną 3-fosfoglicerynianu. Powstały 3-fosfoglicerynian może posłużyć do odtworzenia RuBP. Fosfoglikolan jest nieprzydatny w reakcjach cyklu Calvina jednak w szlaku metabolicznym określanym jako fotooddychanie jest częściowo odzyskiwany. W wyniku przekształcania w peroksysomach i mitochondriach na dwie cząsteczki fosfoglikolanu na cztery atomy węgla odzyskiwane jest trzy w postaci 3-fosfoglicerynianu powracającego do chloroplastów, jeden atom węgla jest tracony poprzez wydzielanie CO2 w mitochondriach. Przy atmosferycznych stężeniach tlenu i dwutlenku węgla i temperaturze 25 stopni Celsjusza stężenie obydwu związków biorących udział w reakcji wynosi odpowiednio 250 μM i 10 μM, dzięki czemu reakcja karboksylacji zachodzi czterokrotnie szybciej niż oksygenacja.
- Fotooddychanie (Fotorespiracja) - jest to biochemiczny proces zachodzący na świetle w komórkach roślinnych, objawiający się pobieraniem tlenu i wydzielaniem dwutlenku węgla na drodze innej niż oddychanie komórkowe. Biochemicznie proces fotooddychania związany jest z dwufunkcyjnością enzymu karboksylazy/oksygenazy rybulozo-1-5-bisfosforanu (RuBisCO), odpowiedzialnego zarówno za przyłączenie do rybulozo-1,5-bisfosforanu (RuBP) cząsteczki CO2, jak i cząsteczki O2 w chloroplastach pdocxzas oświetlania. CO2 i O2 konkurują o miejsce katalityczne Rubisco. W wyniku przyłączenia tlenu do rybulozo1-5-bisfosforanu powstaje jedna cząsteczka kwasu fosfoglicerynowego (jak w fazie ciemnej fotosyntezy) oraz jedna cząsteczka fosfoglikolanu, pierwszego (Dwuwęglowego; C2) produktu fotooddychania. Stąd pochodzi inna nazwa fotooddychania - cykl C2. Dalsze reakcje zachodzą w peroksysomach i mitochondriach, a następnie ponownie w chloroplastach. Powstający w chloroplastach fosfoglikolan ulega defosforylacji i przenoszony jest do peroksysomów. Tam przy udziale oksydazy glikolanowej przekształcany jest do glioksalanu. Glioksalan ulega transaminacji w dwóch reakcjach przeprowadzanych przez aminotransferazę glutaminianową i aminotransferazę serynową, w wyniku których powstaje glicyna. Glicyna transportowana jest do mitochondriów i przy udziale kompleksu enzymatycznego dekarboksylazy glicyny (GDC) oraz hydroksymetylotransferazy seryny (SHMT) przekształcana do seryny z wydzieleniem cząsteczki CO2, NH3 oraz NADH. Powstała w mitochondriach seryna transportowana jest do peroksysomów i przekształćana przy udziale aminotransferazy serynowej do kwasu hydroksypirogronowego. Kwas ten ulega redukcji do kwasu glicerynowego przy udziale reduktazy hydroksypirogronianowej. Produkt reakcji przenoszony jest do chloroplastów i może służyć do odtworzenia cząsteczki rybulozo-1,5-bisfosforanu. NADH produkowany przy dekarboksylacji glicyny może być transportowany do cytozolu lub utleniany w mitochondriach. Utrzymanie cyklu fotooddechowego wymaga takiej samej ilości NADH, do redukcji kwasu hydroksypirogronowego w peroksysomach, jaka powstaje przy utlenieniu produkowanego przez dekarboksylację glicyny utleniana jest w peroksysomach, jednak zapotrzebowanie peroksysomów na NADH może być częściowo zaspokajane przez glikolizę i chloroplasty, a utlenianie glicyny zasilać syntezę ATP mitochondrialnego.
REGULACJA CYKLU CALVINA:
Zachodzenie cyklu umożliwiającego wytworzenie związków organicznych z CO2. W celu precyzyjnej koordynacji fazy świetlnej z reakcjami cyklu Calvina organizmy fotosyntetyzujące posiadają mechanizmy kontrolne. Enzymy cyklu są aktywowane w wyniku wzrostu pH stromy, wzrostu stężenia jonów Mg2+, NADPH oraz zredukowanej ferredoksyny.
ZMIANY STĘŻENIA JONÓW I AKTYWAZA RuBisCO: W wyniku zachodzenia fazy świetlnej fotosyntezy jony wodorowe ze stromy przenoszone są do wnętrza tylakoidów. Podniesienie pH stromy chloroplastów ułatwia powstawanie karbaminianu, który przyłączany jest do RuBisCO powodując aktywację enzymu. Przenoszenie protonów przez błony tylakoidów wiąże się z powstawaniem różnicy potencjałów poprzek błony. Jest ona częściowo kompensowana przez przepływ jonów Mg2+ z wnętrza tylakoidów do stromy. Jony magnezu sąd rugim składnikiem niezbędnym do przeprowadzenia reakcji przez karboksylazę RuBP.
Białko, aktywaza RuBisCO, odrywa od karboksylazy RuBP cząsteczkę w-1,5-bisfosforanu umożliwiając dostęp jonów Mg2+ oraz CO2 do centrum aktywnego RuBisCO. Aktywacja jednej cząsteczki RuBisCO przez aktywazę wiże się z hydrolizą 50 cząsteczek ATP. U roślin zostały odnalezione dwie izoformy aktywazy RuBisCO o masach 42 i 46 kDa. Obie izoformy zdolne są do aktywowania karboksylazy RuBP i hydrolizy ATP, jednak większa z nich wykazuje niższą wydajność. Regulacja aktywności karboksylazy RuBP przez światło związana jest ze zmianami aktywności dużej izoformy aktywazy RuBisCO.
Aktywacja RuBisCO wymaga wzjamenego dopasowania obu enzymów. Aktywaza RuBisCO nie jest w stanie aktywować karboksylazy w szpinaku lub Chlamydomonas, a aktywaza z tych gatunków nie wpływa na aktywność karboksylazy RuBP tytoniu.
 |
| Źródło: Wikipedia. Struktura tioredoksyny. |
TWORZENIE KOMPLEKSÓW ENZYMÓW: W ciemności enzymy cyklu ulegają dezaktywacji. Odbywa się to poprzez połączenie kinazy fosforybulozy i dehydrogenazy aldehydu 3-fosfoglicerynowego za pośrednictwem niewielkiego białka określanego jak CP12. Kompleks złożony z dwóch enzymów i białka CP12 nie wykazuje aktywności. Rozpad kompleksu następuje po zredukowaniu kinazy fosforybulozy przez tioredoksynę i przyłączenie NADPH do nieaktywnego kompleksu. Do rozdzielenia enzymów dochodzi na świetle gdy stężenie NADPH w stromie wzrasta na skutek zachodzenia reakcji fazy świetlnej.
MAGAZYNOWANIE PRODUKTÓW CYKLU: Węglowodany gromadzone są w organizmach roślin głównie w postaci skrobi i sacharozy. Cząsteczki skrobi mogą być syntetyzowane bezpośrednio w chloroplastach z glukozy, która ulega aktywacji poprzez przyłączenie cząsteczki ATP, co prowadzi do powstania ADP-glukozy. Sacharoza wytwarzana jest w cytozolu. Do syntezy cząsteczki sacharozy wykorzystywany jest fruktozo-6-fosforan i UDP-glukoza. Reakcję przeprowadza syntaza sacharozo-6-fosforanowa. Pomimo możliwości wytworzenia heksoz w chloroplastach, zarówno fruktozo-6-fosforan, jak i glukozo muszą być syntetyzowane w cytozolu, ponieważ w błonach chloroplastów nie ma przenośników dla fosforanów heksoz. Z chloroplastów do cytozolu dostarczane są trizofosforany, służące następnie do syntezy obu niezbędnych heksoz. Zaletą wykorzystania sacharazy jako cukru zapasowego jest jego dobra rozpuszczalność i związana z tym łatwość przenoszenia pomiędzy organami rośliny.
EWOLUCJA: Cykl Calvina zachodzi w chloroplastach, jednak tylko jeden z enzymów kodowany jest przez genom chloroplastowy. Pozostałe enzymy cyklu kodowane są przez genom jądrowy.Może być to wynikiem ewolucji genomu jądrowego. Istnieją jednak dowody, że geny chloroplastowe mogły zostać przeniesione do genomu jądrowego.
HISTORIA BADAŃ: Badania mechanizmów fotosyntetycznej asymilacji CO2 rozpoczął Samuel Ruben w roku 1939, stosując początkowo izotop węgla C11. Badania ułatwiło odkrycie przez Rubena i Martina Kamena izotopu węgla C14. Jednak nagła śmierć Samuela Rubena spowodowała przerwanie badań w roku 1943. Zostały one wznowione w roku 1945 przez Earnesta O. Lawrence'a kierującego University of California Radiation Laboratory, który powierzył Melvinowi Calvinowi zadanie stworzenie grupy zajmującej się badaniami chemicznymi i biochemicznymi przy użyciu radioizotopów. Do kierowania podgrupą badającą fotosyntezę został wyznaczony Andrew Benson. Po zakończeniu II wojny światowej do grupy badającej przebieg fotosyntezy dołączył James A. Bassham. Badania nad asymilacją węgla prowadzono przy użyciu znakowanego 14CO2, który podawano kulturom roślin lub glonom. Następnie związki powstające podczas fotosyntezy rozdzielano przy pomocy dwukierunkowej chromatografii bibułowej i identyfikowano powstające związki pośrednie. Początkowo pojawienie się znakowanego izotpu węgla obserwowano głównie w czterowęglowych kwasach dwukarboksylowych, jabłczanie i bursztynianie. Pierwsza próba wyjaśnienia fotosyntetycznej asymilacji węgla zakładała dwie reakcje karboksylacji prowadzące do wytworzenia kwasów dwukarboksylowych. Rozpad tych kwasów na komponenty dwuwęglowe miał dostarczać substratów do pierwszej reakcji karboksylacji. Dalsze badania wykazały, że pierwszym produktem fotosyntezy jest związek trzywęglowy, fosfoglicerynian, a do jego powstania konieczny jest pięciowęglowy akceptor CO2 w postaci RuBP. Udział enzymów w karboksylacji RuBP wykazano po raz pierwszy w roku 1954, określając enzym uczestniczący w reakcji jako karboksydysmutazę. Zestaw enzymów biorących udział w redukcyjnym cyklu węgla został opublikowany przez zespół Calvina w roku 1962. W roku 1961 Melvin Calvin za badania nad asymilacją dwutlenku węgla u roślin otrzymał Nagrodę Nobla. Dalsze badania doprowadziły do poznania mechanizmów regulacji cyklu Calvina. W roku 1985 został opisany uniwersalny regulator aktywności enzymu RuBisCO - aktywaza RuBisCO.
 |
| Źródło: Wikipedia. Przebieg reduktywnego cyklu kwasu cytrynowego: 1 - liaza ATP- cytrynian, 2 - reduktaza fumaranowa, 3 - syntaza alfa-ketoglutaranowa, Fd- ferredoksyna. |
7) Odwrotny Cykl Krebsa (Reduktywny cykl kwasów karboksylowych) - jest to zespół reakcji biochemicznych podczas których CO2 włączany jest w związki organiczne przy udziale ferredoksyny i ATP. Cykl ten jest sposobem asymilacji dwutlenku węgla u części fotosyntetyzujących purpurowych bakterii siarkowych i bakterii zielonych. Zasadniczo reakcje reduktywnego cyklu kwasów karboksyowych są odwróceniem reakcji zachodzących w cyklu kwasu cytrynowego zachodzącego w mitochondriach. W reduktywnym cyklu CO2 jest przyłączany do bursztynylo-CoA, kwasu alfa-ketoglutaranowego i acetylo-CoA. Do redukcji powstających związków organicznych używana jest ferredoksyna. Reakcje wymagają także dostarczenia energii w postaci ATP. Jako donory elektronów służyć mogą także wodór i siarczany. Redukcyjny cykl kwasu cytrynowego jest alternatywnym sposobem asymilacji CO2, przebiegającej w cyklu Calvina. Wykazano, że kilka z reakcji cyklu redukcyjnego może być katalizowanych przez związki nieorganiczne.
 |
| Źródło: Schemat cyklu hydroksypropionowego. |
Cykl hydroksypropionowy rozpoczyna przyłączenie cząsteczki CO2 do acetylo-CoA przez karboksylazę acetylo-CoA. Reakcja wymaga dostarczenia energii w postaci ATP. Powstały malonylo-CoA redukowany jest do hydroksypropionylo-CoA i w kolejnej reakcji do propionylo-CoA. Karboksylaza priopionylo-CoA przyłącza kolejną cząsteczkę CO2. Reakcja ta podobnie jak pierwsza karboksylacja wymaga dostarczenia energii w postaci ATP. Po przyłączeniu drugiej cząsteczki CO2 zostaje wytworzony metylomalonylo-CoA rozkładany na acetylo-CoA i cząsteczkę kwasu glioksalanowego. W efekcie jednego obrotu cyklu dwie cząsteczki CO2 zostają włączane do związku organicznego - powstaje jedna cząsteczka kwasu glioksalanowego. Zużyte zostają także 3 cząsteczki ATP i dwie cząsteczki równoważników redukcyjnych.
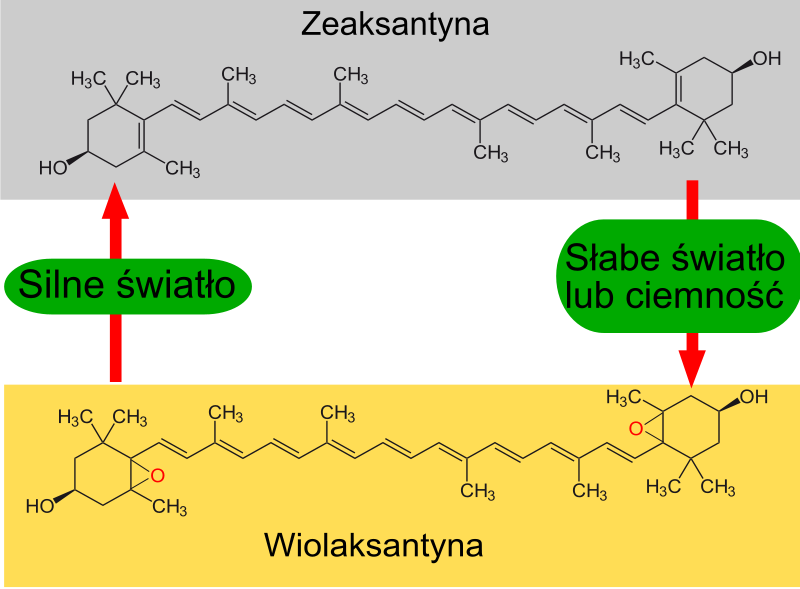 |
| Źródło: Wikipedia. Przekształcenie zeaksantyny w wiolaksantynę w cyklu ksantofilowym. |
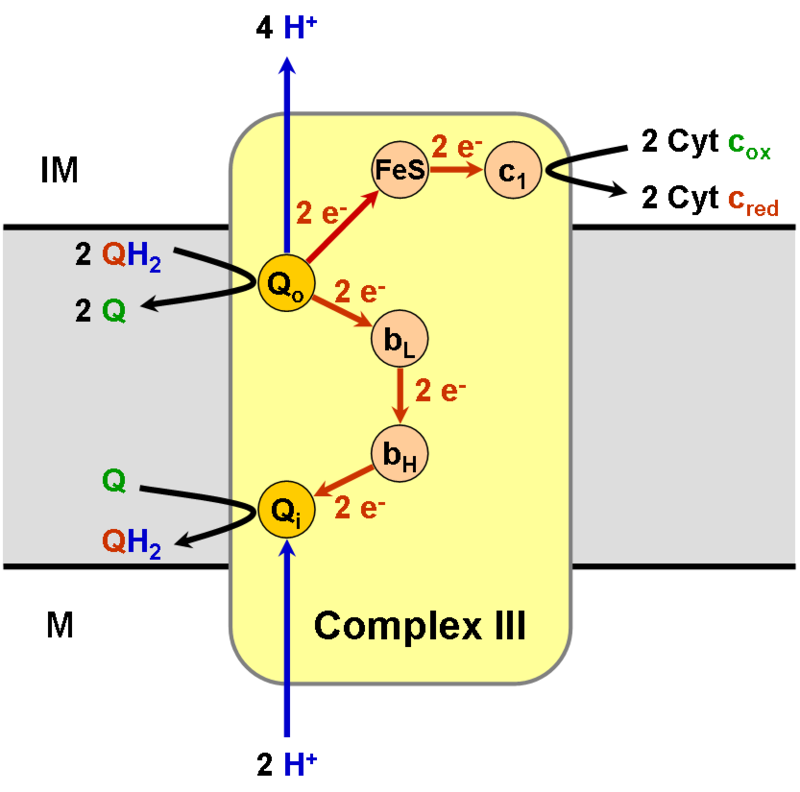 |
| Źródło: Wikipedia. Schematyczne przedstawienie łańcucha transportu elektronów kompleksu III. |
PRZEBIEG CYKLU Q W MITOCHONDRIACH: Cykl Q w mitochondriach zachodzi na kompleksie III określanym jako reduktaza ubichinol-cytochrom c.
Zredukowana forma ubichinonu-ubichinolu QH2 przyłączana jest do histydyny 182 białka zawierającego żelazo i siarkę - tzw. białko Rieskiego oraz do glutaminianu 272 cytochromu b. Jeden z elektronów z cząsteczki ubichinonu przekazywany jest na białko Rieskiego, redukując znajdujące się w białku żelazo z +3 na +2 stopień utlenienia, a następnie na cytochrom c1, redukując żelazo w układzie hemowym. Elektron ten trafia kolejno na cząsteczkę cytochromu c niezwiązaną z kompleksem III mitochondriów. Pozbawiony elektronu wodór z histydyny 181 uwalniany jest do przestrzeni międzybłonowej. Drugi elektron z ubichinonu przenoszony jest na żelazo hemowe niskopotencjałowej formy cytochromu bL, po czym trafia na wysokopotencjałową formę cytochromu bH. Następnie elektron redukuje cząsteczkę ubichinonu przyłączoną w specyficznym miejscu na kompleksie bc1. Cząsteczka ubichinonu przyłącza za pośrednictwem glutaminianu 272 proton pobrany z macierzy mitochondrialnej. Ubichinon po przyłączeniu protonu staje się semichinonem, a po dostarczeniu drugiego elektronu przechodzi w ubichinol i odrywa się z miejsca redukcji ubichinonu. Powstały ubichinol może przekazać swoje elektrony w miejscu utlenienia ubichinonu na kompleksie III.
W efekcie utlenienia dwóch cząsteczek ubichinonu dwa elektrony przekazywane są na cytochrom c, cztery protony uwalniane do przestrzeni międzybłonowej, dwa protony pobrane są z macierzy mitochondrialnej oraz powstaje jedna cząsteczka ubichinolu mogąca brać udział w cyklu Q.
PRZEBIEG CYKLU Q W CHLOROPLASTACH: Niemal identyczny mechanizm przenoszenia protonów występuje u roślin w chloroplastach podczas wytwarzania gradientu protonowego w poprzek błony tylakoidów. W chloroplastach za katalizowanie reakcji utleniania plastochinolu i redukcję plastocyjaniny odpowiedzialny jest kompleks cytochromowy b6f - reduktaza plastochinol-plastocyjanina obecny w błonie tylakoidów. Podobnie jak w mitochondriach, w efekcie utlenienia dwóch cząsteczek plastochinolu dwa elektrony przekazywane są na plastocyjaninę, cztery protony uwalniane do wnętrza tylakoidu, dwa protony zostają pobrane ze stromy oraz powstaje jedna cząsteczka plastochinolu mogąca brać udział w kolejnym Q cyklu.
 11) Dinukleotyd nikotynoamidoadeninowy (NADH - forma zredukowana, NAD+ - forma utleniona) - jest to organiczny związek chemiczny, nukleotyd pełniący istotną rolę w procesach oddychania komórkowego. Różne pochodne tego związku są akceptorami elektronów i protonów w procesach utleniania komórkowego. Pełnią też rolę koenzymów oksydoreduktaz. Dinukleotyd nikotynoamidoadeninowy występuje w organizmach żywych w postaci jonów (NAD+ i NADP+) oraz w formie zredukowanej (NADH i NADPH).
11) Dinukleotyd nikotynoamidoadeninowy (NADH - forma zredukowana, NAD+ - forma utleniona) - jest to organiczny związek chemiczny, nukleotyd pełniący istotną rolę w procesach oddychania komórkowego. Różne pochodne tego związku są akceptorami elektronów i protonów w procesach utleniania komórkowego. Pełnią też rolę koenzymów oksydoreduktaz. Dinukleotyd nikotynoamidoadeninowy występuje w organizmach żywych w postaci jonów (NAD+ i NADP+) oraz w formie zredukowanej (NADH i NADPH).
NAD + - forma utleniona dinukleotydu
NADP+ - ester fosforanowy dinukleotydu
NADH - forma zredukowana NAD+
NADPH - forma zredukowana NADP+
NAD+/NADH - cząsteczka NAD jest dinukleotydem składającym się z adenozyno-5'-monofosforanu i nukleotydu nikotynoamidowego połączonych ze sobą wiązaniem bezwodnikowym. Cząsteczka NAD+ wiąże jeden proton i dwa elektrony, w wyniku czego reszta amidu kwasu nikotynowego ulega redukcji:

Z kolei forma zredukowana, NADH, jest utleniana na kompleksie I łańcucha oddechowego. W wyniku przenoszenia elektronów przez kolejne elementy łańcucha oddechowego zostaje wytworzony gradient elektrochemiczny zamieniany przez syntazę ATP na energię zamgazynowaną w ATP.
NADP+ / NADPH - NADP+/NADPH różni się od NAD+/NADH obecnością reszty fosforanowej przy węglu 2' rybozy nukleotydu adeninowego. NADP+ jest także akceptorem protonu i elektronów w reakcjach redukcji, w ten sposób powstaje NADPH, wytwarzany przez reduktazę ferredoksyna-NADP+ w fazie jasnej fotosyntezy. Powstały NADPH wykorzystywany jest do syntezy cukrów w cyklu Calvina. NADPH wytwarzany jest także w szlaku metabolicznym określanym jako szlak pentozofosforanowy. Jest on następnie zużytkowany w różnych reakcjach redukcji głównie w przebiegu biosyntezy kwasów tłuszczowych i cholesterolu.
 |
| Źródło: Wikipedia. Struktura NADPH (tetraanion). |
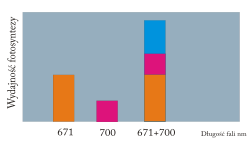 |
| Źródło: Wikipedia. Efekt Emersona. Natężenie fotosyntezy mierzone w monochrmatycznym świetle o długości fali 671 nm i 700 nm oraz po zasto- -sowaniu obu długości fal jednocześnie. |
 |
| Źródło: Wikipedia. Otto Heinrich Warburg. |
PRZYCZYNY ZJAWISKA: Swoje badania Warburg prowadził na glonach z rodzaju Chlorella. W stężeniu tlenu 21% glony wykazywały jedynie 65% maksymalnej wydajności fotosyntezy, zaś w stężeniu tlenu bliskiemu 100% natężenie fotosyntezy spadało do 55% maksymalnej wartości. W kolejnych badaniach Warburg wykazał istnienie zjawiska u roślin wyższych. Efekt zahamowania fotosyntezy jest odwracalny. Po obniżeniu stężenia tlenu, natężenie fotosyntezy netto powtórnie wzrasta. Hamujące działanie tlenu może zostać odwrócone przez podniesienie stężenia CO2. Obserwuje się także wzrost stężenia glikolanu wraz z podnoszeniem stężenia tlenu. Wszystkie te obserwacje wskazują, że efekt Warburga jest związany ze wzrostem fotooddychania. Enzym Rubisco może przeprowadzać zarówno reakcję karboksylacji rybulozo-1,5-bisfosforanu, jak i reakcję utlenienia tego związku. Podniesienie stężenia tlenu prowadzi do zwiększenia udziału reakcji utleniania wraz ze zmniejszeniem szybkości karboksylacji. Pojawiający się w zwiększonych ilościach glikolan jest produktem reakcji utleniania. U większości roślin fotosynteza zachodzi z maksymalną wydajnością w stężeniu tlenu 2%. W tych warunkach fotooddychanie jest zahamowane przez niedobó® tlenu. W atmosferycznym stężeniu tlenu (21%) u większości roślin natężenie fotosyntezy netto jest mniejsze od maksymalnego. Spadek wydajności asymilacji CO2 następuje także w warunkach podwyższonej temperatury. Jednakże znane są rośliny, u których podniesienie stężenia tlenu z 2% do 21% nie powoduje spadku natężenia fotosyntezy netto. Są to rośliny o fotosyntezie C4, charakteryzujące się punktem kompensacyjnym CO2 bliskim zeru. W wyniku przystosowań fizjologicznych i anatomicznych te rośliny nie wykazują fotooddychania.
W pewnym stopniu na efekt Warburga mogą także odpowiadać reakcje określane jako pseudocykliczny transport elektronów. Elektrony z ferredoksyny zwykle służące do redukcji NADP mogą zostać przeniesione na tlen. W wyniku tej reakcji część energii pochłoniętej przez chlorofil jest tracona. Efekt Warburga jest sumą fotooddychania oraz pseudocyklicznego transportu elektronów. Istnieje również inne zjawisko nazywane efektem Warburga, także zaobserwowane po raz pierwszy przez Otto Heinricha Warburga. Zjawisko to polega na zwiększonej fermentacji w komórkach nowotworowych.
14) Fosforylacja fotosyntetyczna, fotofosforylacja - jest to proces zachodzący w fazie jasnej fotosyntezy w chloroplastach. Polega na wytworzeniu ATP z ADP i fosforanu nieorganicznego przy użyciu energii światła: ADP + Pi + hv (energia świetlna) -> ATP.
Proces zachodzi w chloroplastach eukariontów oraz w komórkach bakterii fotosyntetyzujących. Energia światła wykorzystywana jest przez kompleksy przeprowadzające reakcję fotochemiczną - fotoukłady. W efekcie zachodzenie reakcji katalizowanych przez fotoukłady oraz kompleks cytochromów b6f przez błonę białkowo-lipidową przenoszone są protony. Wytworzona w wyniku zachodzenia szeregu reakcji redoks różnica stężeń protonów w poprzek błony określana jest jako siła protonomotoryczna. Energia zgromadzona w postaci różnicy stężeń protonów służy do syntezy ATP przeprowadzanej przez enzym którego elementy obracają się w wyniku przepływania przez kanał jonowy jonów H+ - syntazę ATP.
Gradient protonowy może być wytworzony poprzez przekazywanie elektronów w szeregu reakcji z H2O na NADP. W tym przypadku proces określa się jako fosforylację niecykliczną, podczas której wytwarzane jest nie tylko ATP, lecz także NADPH. Elektrony mogą również zostać oderwane od barwnika obecnego w centrum reakcji, uczestniczyć w reakcjach redoks prowadzonych do wytworzenia siły protonomotorycznej i powracać do centrum aktywnego. Cykliczne zachodzenie reakcji określa się jako fosforylacja cykliczna, w której wytwarzane jest tylko ATP. Fosforylacja cykliczna może zachodzić w chloroplastach eukariontów oraz komórkach sinic. Organizmy te posiadają dwa fotoukłady i mogą przeprowadzać również fosforylację niecykliczną. Pozostałe organizmy fotosyntetyzujące posiadają tylko jedno centrum reakcji i przeprowadzają jedynie fosforylację cykliczną. Do organizmów tych zalicza się: bakterie zielone, bakterie purpurowe i heliobakterie.
FOSFORYLACJA NIECYKLICZNA: Wytworzenie ATP w chloroplastach jest możliwe dzięki szeregowi reakcji zachodzących na kompleksach obecnych w błonie tylakoidu. W organizmach wytwarzających tlen głównym sposobem wytwarzania siły protonomotorycznej jest estaw reakcji określanych jako fosforylacja niecykliczna. W efekcie tych reakcji elektrony z wody przenoszone są na NADP, który ulega redukcji do NADPH oraz protony przenoszone są do wnętrza tylakoidu ze stromy. Powstająca różnica stężeń protonów służy następnie do wytworzenia ATP. W roślinach oraz sinicach w reakcjach prowadzących wytworzenie siły protonomotorycznej odbywa się przy udziale trzech dużych kompleksów. Dwa z nich określane jako fotoukłąd I i fotoukład II to elementy wrażliwe na światło, w których dochodzi do fotoindukcyjnego rozdziału ładunków. Na trzecim - kompleksie cytochromów b6f - zachodzą reakcje dzięki którymdodatkowe protony przenoszone są przez błony tylakoidów. Wszystkie trzy kompleksy rozmieszczone są w błonie tylakoidów. W łańcuchu reakcji biorą również udział dwie małe cząsteczki. Plastochinon będący związkiem o charakterze hydrofobowym, jednak bardzo dobrze rozpuszczalnym w lipidach, dzięki czemu łatwo przemieszcza się w błonie tylakoidów ulegając redukcji na fotoukładzie II i utlenieniu na kompleksie cytochromów b6f. Druga ruchliwa cząsteczka to niewielkie białko, zawierające jon miedzi, rozpuszczalne w wodzie, ulegające redukcji na kompleksie cytochromów b6f i oddające elektrony na fotoukład I.
 |
| Źródło: Wikipedia. Budowa fotoukładu II. |
Powstały w wyniku oderwania elektronu jon P680+ posiada potencjał oksydoredukcyjny 1,3-1,4. Tak silny utleniacz służy do odebrania elektronu z cząsteczki wody. P680+ utlenia resztę 161 tyrozyny w białku D1, a powstały w reakcji rodnik Tyrz służy jako utleniacz w reakcji rozszczepienia wody. Reakcja ta katalizowana jest przez kompleks rozkładający wodę (OEC) będący częścią fotoukładu II zlokalizowaną po wewnętrznej stronie błony tylakoidu. Struktura przestrzenna oraz mechanizm działania kompleksu nie zostały dokładnie poznane. W przyjmowanym modelu zakłada się, że z kompleksem pozostają jednocześnie połączone dwie cząsteczki wody. Jedna z nich pozostaje połączona z jonem Mn, a druga z jonem Ca2+ również obecnym w kompleksie. W wyniku odrywania elektronów od OEC zmieniają się jego stany redoks określane jako S0, S1, S2, S3, S4. Przejście przez pełny cykl prowadzi do oderwania czterech elektronów od dwóch cząsteczek wody. W efekcie wytworzona zostaje cząsteczka O2, a wewnątrz tylakoidu powstają cztery protony zwiększające różnicę stężeń pomiędzy stromą i przestrzenią lumenarną.
REAKCJĘ KATALIZOWANĄ PRZEZ FOTOUKŁAD II MOŻNA PRZEDSTAWIĆ NASTĘPUJĄCO: 2PQ + 2H20 --> O2 + 2PQH2
- KOMPLEKS ROZKŁADAJĄCY WODĘ (kompleks wydzielający tlen, OEC, z ang. oxygen evolving complex) - jest to kompleks enzymatyczny przeprowadzający rozszczepienie cząsteczki wody podczas zachodzenia fazy jasnej fotosyntezy. Przestrzenna struktura kompleksu nie została ustalona. W skład kompleksu wchodzą cztery jony manganu i wapnia. Działanie kompleksu opisuje teoria Bessela Koka (1918-1979) z 1970. Naukowiec, oświetlając błony fotosyntetyczne impulsami światła o czasie trwania poniżej 5 μs zaobserwował, że wydzielenie cząsteczki tlenu zachodzi dopiero po trzecim błysku, a następnie powtarza się co czwarty błysk. Cykliczność wydzielania O2 związana ejst ze zmianami stopnia utleniania atomów manganu obecnych w kompleksie. Reakcja fotochemiczna zachodząca w centrum reakcji fotoukładu II (PSII) powoduje wybicie elektronu. W celu uzupełnienia elektronu wybitego z centrum reakcji, pobierany jest on z kompleksu OEC przy udziale rodnika tyrozyny. Pobieranie kolejnych elektronów z kompleksu powoduje jego przejście od stanu S0 do S4. Powrót do stanu S0 następuje po oderwaniu czterech elektronów z cząsteczki wody i wydzieleniu cząsteczki O2. Przy dłuższym okresie bez światła kompleks OEC ulega dezaktywacji do stanu S1, co tłumaczy uwolnienie pierwszej cząsteczki O2 po trzecim błysku.
Do PS II przyłączone są zewnętrzne kompleksy antenowe LHC II absorbujące energię światła i przekazujące ją na fotoukład II. Główny kompleks LHC II składa się z trzech białek - LHCb1, LHCb2, LHCb3 i wiąże 70% cząsteczek chlorofilu związanego w PSII. Poszczególne monomery wchodzące w skład kompleksu zbudowane są z łańcucha 232 aminokwasów wiążącego 8 cząsteczek chlorofilu a, 6 cząsteczek chlorofilu b, 2 cząsteczki luteiny, jedną neoksantyny i jedną zeaksantyny lub wiolaksantyny. Białka antenowe Lhcb4, Lhcb5 oraz Lhcb6 związane z PS II występują jako monomery. Poszczególne monomery mają podobną budowę, zawierają trzy transbłonowe helisy, a masa mieści się w przedziale 20-25 kDa. Wydajność wykorzystania absorbowanej energii świetlnej jest wyższa dla formy trimerycznej LHCII3. Energia wzbudzenia z chlorofilu b położonego w lumenarnej części kompleksu przenoszona jest na końcowy chlorofil a jednego z monomerów położony w stromalnej części kompleksu przez szereg cząsteczek chlorofilu a i b w czasie femtosekundy (jedna biliardowa części sekundy; biliard = 1015).
Fotoukład II tworzy superkompleks składający się z dimeru PS II połączonego ze zmienną liczbą anten zewnętrznych. Najczęściej superkompleks zbudowany jest z dimeru PSII, dwóch trimerycznych kompleksów LHC II oraz dwóch białek Lhcb4 i dwóch Lhcb5. W jednym superkompleksie LHCII-PSII na centrum reakcji przypada około 125 cząsteczek chlorofilu, a cały kompleks ma masę 1100 kDa. Kompleks LHCII-PSII może wiązać dodatkowo do sześciu kompleksów LHC II3. Dodatkowe formy trimeryczne zawierają białka Lhcb1, Lhcb2 i Lhcb3. Powstające superkompleksy mogą łączyć się ze sobą w jeszcze bardziej złożone struktury określane jako megakompleksy. Wolne kompleksy LHC II3 mogą łączyć się w oligomery o zróżnicowanym układzie przestrzennym. Powstałe oligomery biorą udział w niefotochemicznym rozpraszaniu energii wzbudzenia.
 |
| Źródło: Wikipedia. Budowa kompleksu cytochromów b6f. |
KOMPLEKS CYTOCHROMÓW B6F: Plastochinol (PQH2) wytworzony na fotoukłądzie II dyfunduje w błonie tylakoidów do kompleksu cytochromów b6f. Kompleks enzymatyczny katalizuje reakcję: PQH2 + 2Pc(Cu2+) ---> PQ + 2Pc(Cu+) + 2H+ .
Kompleks jest homodimerem o masie 220 kDa, w którym każdy z monomerów składa się z czterech podjednostek. Pierwsza z nich to cytochrom b6, będący integralnym białkiem błonowym o masie 24 kDa, zawierającym dwie cząsteczki hemu. Jedna z cząsteczek hemu b określana jako bH znajduje się po wewnętrznej stronie błony tylakoidu, a druga określana jako bL bliżej stromy. Druga podjednostka to cytochrom f o masie 19 kDa, zawierająca hem typu c i będąca miejscem przyłączania plastocyjaniny. Kolejną podjednostką jest białko Rieskiego zawierające Centrum żelazowo-siarkowe [2FE-2S] (17,5 kDa). Ostatnia podjednostka IV (17 kDa) nie bierze bezpośredniego udziału w reakcjach zachodzących na kompleksie. Umożliwia ona przyłączenie do każdego z monomerów po jednej cząsteczce chlorofilu i beta-karotenu, co prawdopodobnie zwiększa stabilność całego kompleksu lub reguluje aktywność kinazy LHC.
Kompleks cyt. b6f katalizuje dwuetapową reakcję utleniania PQH2 określaną jako cykl Q. Cząsteczka plastochinolu obecnego w błonach tylakoidów przyłączana jest do kompleksu po stronie lumenalnej. Pierwszy elektron pobierany z PQH2 przekazywany jest przez cytbh, białko Rieskiego i cyt. f na plastocyjaninę. Drugi elektron przenoszony jest za pośrednictwem cyt. bL na cząsteczkę plastochinonu przyłączoną do kompleksu po stronie stromy.W efekcie utlenienia przyłączonej po wewnętrznej stronie tylakoidu redukowana jest jedna cząsteczka Pc oraz powstaje anion plastosemichinonowy przyłączający proton ze stromy. Po zredukowaniu dwóch cząsteczek PQH2 po stronie lumenalnej redukcji ulegają dwie cząsteczki Pc i powstaje jedna cząsteczka PQH2. Protony uwalniane podczas redukcji PQH2 uwalniane są do wnętrza tylakoidu a pobierane podczas utleniania PQ pobieranego ze stromy. W ten sposób reakcje zachodzące na kompleksie cytohromów b6f umożliwiają zwiększenie gradientu stężeń protonów w poprzek błony.
FOTOUKŁAD I: Trzeci duży kompleks katalizujący reakcje fotofosforylacji odpowiedzialny jest za przeprowadzenie reakcji utlenienia plastocyjaniny przy jednoczesnej redukcji ferredoksyny: 2Pc(Cu+) + Fd utl. ---> 2Pc(Cu2+) + Fd zred.
 |
| Źródło: Wikipedia. Budowa fotoukładu I. |
Potencjał oksydoredukcyjny wynosi +0,37 V dla plastocyjaniny i -0,45 V dla ferredoksyny. Przeniesienie elektronów ze związku o dodatnim redoks potencjale do związku o ujemnym redoks potencjale możliwe jest dzięki absorpcji kwantów światła. Cały kompleks PS I składa się z 15 podjednostek białkowych oznaczanych jako PsaA do PsaP. Podobnie jak w fotoukładzie II centrum reakcji zawiera dimer chlorofilu a, w tym kompleksie maksimum absorpcji przypada jednak na 700 nm stąd określenie pary specjalnej - P700. W skład centrum reakcji wchodzą również dwie kolejne pary chlorofilu a, dwie cząsteczki filochinonu oraz heterodimer składający się z podjednostek PsaA i PsaB o masach odpowiednio 83,2 kDa i 82,5 kDa. Reszty cysteinowe obu podjednostek koordynują centrum żelazowo-siarkowe [4Fe-4S]. Elektron oderwany od P700 przekazywany jest na jedną lub obie cząsteczki chlorofilu trzeciej pary, która znajduje się w odległości 2,2 nm od pary specjalnej. Kolejnym akceptorem elektronów jest jedna lub obie cząsteczki filochinonu. Dotychczasowe badania wskazują na symetryczny transport elektronu podczas tunelowania, jednak możliwe, że transport może zachodizć symetrycznie. Z filochinonu elektron poprzez centrum [4Fe-4S] przekazywany jest na podjednostkę PsC również zawierającą centra żelazowo-siarkowe. Ferredoksyna wiązana jest z fotoukładem I przy udziale podjednostek PsaC, PsaD, PsaE. Powstały jon P700+ zobojętniany jest elektronem pochodzącym z Pc, która przyłącza się do PS I po stronie lumenalnej przy udziale podjednostek PsaN, PsaF, PsaG i PsaJ. Podjednostka PsaF odbiera elektron od plastocyjaniny i przekazuje go do centrum reakcji fotoukładu. Ferredoksyna ulega utlenieniu przy udziale reduktazy ferredoksyna-NADP+ (FNR) przy jednoczesnym wytworzeniu NADPH + H+. U roślin wyższych FNR oddziałuje z podjednostką PsaE, przebieg reakcji redoks polega prawdopodobnie na oddziaływaniu jedynie centrów aktywnych obu białek. Reakcja ta odbywa się po stronie stromy, a pobieranie protonów przyczynia się do zwiększania gradientu elektrochemicznego w poprzek błony.
FOSFORYLACJA CYKLICZNA: Wytworzenie gradientu protonowego możliwe jest także bez udziału fotoukładu II. Przenoszenie protonów przez błonę tylakoidów bez rozkładu wody określane jest jako fosforylacja cykliczna. Podczas niej elektron wybity z centrum reakcji fotoukładu I (P700) przekazywany jest przez szereg przenośników na ferredoksynę. Z ferredoksyny jednak nie trafia na NADP+, lecz jest przenoszony na kompleks cytochromów b6f. W efekcie reakcji zachodzących na kompleksie następuje przeniesienie protonów w poprzek błony tylakoidów i wytworzenie gradientu protonowego. Z kompleksu cytochromów b6f elektron służy do redukcji plastocyjaniny utlenianej przez P700+. Powstała w wyniku cyklu reakcji różnica stężeń protonó∑ wewnątrz i na zewnątrz tylakoidu dostarcza energii do syntezy ATP odbywającej się na kompleksie syntazy ATP. Kluczowym elementem biorącym udział w cyklicznym transporcie elektronów jest enzym przenoszący elektrony z ferredoksyny na kompleks cytochromów b6f. Przeniesienie to może odbyć się na kilka sposobów. Elektrony z ferredoksyny może pobierać oksydoreduktaza ferredoksyna-plastochinon (FQR). W efekcie wytwarzana jest zredukowana forma plastochinonu biorąca udział w cyklu Q. Przeniesienie elektronów na plastochinon może również zachodzić dzięki dehydrogenazie plastochinon-NAD(P)H (Ndh). Trzecia możliwością jest bezpośrednie przeniesienie elektronów przez reduktazę ferredoksyny (FNR) na kompleks cytochromów b6f, gdzie posłużą do redukcji plastochinonu.
SYNTAZA ATP: Za chloroplastową syntezę ATP bezpośrednio odpowiedzialna jest syntaza ATP. Enzym ten określany za pomocą skrótu CF0F1 podobnie jak mitochondrialna syntaza ATP określanej za pomocą skrótu MF0F1 zbudowany jest z dwóch domen F0 będącej białkiem wewnątrzbłonowym i przyłączonej do niej po stronie stromy domeny F1. Obie domeny połączone są białkami tworzącymi trzon (ang. central stalk) oraz zewnętrznym łącznikiem (ang. peripheral stalk). CF0 składa się z czterech różnych łańcuchów polipeptydowych, określanych jako I (17 kDa), II (16,6 kDa), III (8 kDa), IV (27 kDa). Podjednostki I, II i III są odpowiednikami podjednostek a, b, c budującymi mitochondrialną syntazę ATP, podjednostka IV jest jedynie zbliżona budową do podjednostki a. Szacunkowa zawartość poszczególnych podjednostek wynosi 1:2:12(14):1. Podjednostki III tworzą w błonie pierścień składający się z 14 polipeptydów. Podjednostka a tworzy dwa nie przechodzące przez błonę kanały jonowe. Gdy reszta Asp61 i polipeptydu III posiada ładunek ujemny zostaje związana z podjednostką I, uprotonowanie, przy udziale kanału jonowego, umożliwia odłączenie podjednostki III od polipeptydu I i przemieszczenie w błonie. Kolejne reakcje protonacji i deprotonacji prowadzą do obrotu pierścienia podjednostek III oraz jednoczesne przenoszenia protonów przez błonę.
CF1 składa się z podjednostek α3β3γδε. Podjednostki alfaBeta ułożone są naprzemiennie wokół rdzenia kompleksu tworząc właściwą syntazę ATP zawierającą trzy centra aktywne. Polipeptydy γδε tworzą rdzeń kompleksu obracany przez pierścień podjednostek III. Obroty fragmentu łańcucha gamma znajdującego się w pobliżu podjednostek alfa3beta3 wywołują zmiany konformacyjne centrów aktywnych polegające kolejno na jego otwarciu i przyłączeniu ADP i Pi, utworzenie stanu przejściowego i syntezę ATP, otwarcie centrum aktywnego i uwolnienie ATP. Do otwartego centrum aktywnego mogą powtórnie przyłączyć się kolejne substraty. Ze względu na obecność trzech miejsc katalitycznych na pierścieniu alfa3beta3 podczas pełnego obrotu polipeptydy gamma zostają wytworzone 3 cząsteczki ATP. Domena F1 i F0 połączone są również zewnętrznym łącznikiem, który łączy się z podjednostką I F1 przy pomocy białka b oraz d, F6 i OSCP. Zewnętrzny łącznik kotwiczy w błonie zarówno podjednostkę I, jak i zapobiega rotacji pierścienia alfa3beta3 podczas ruchu rdzenia kompleksu. Zestaw tych polipeptydów tworzy stojan [stojan=staor - zespół nieruchomych elementów otaczających wirujący wokół stałej osi wirnik - rotor - element, który w czasie pracy mechanizmu wiruje wokół stałej osi], a centralny rdzeń i pierścień podjednostek III spełnia rolę wirnika (ang. rotor) razem tworząc molekularny silnik odpowiedzialny za wytwarzanie ATP.
Szczególną cechą chloroplastowej syntazy ATP jest możliwość regulacji przez światło polegający na odwracalnej redukcji mostka cysteinowego w podjednostce gamma, a także obustronne oddziaływania polipeptydów gamma i epsilon tworzących rdzeń kompleksu. Niektóre badania sugerują, że syntaza ATP obecna w chloroplastach podobnie jak enzym mitochondrialny może tworzyć dimery.
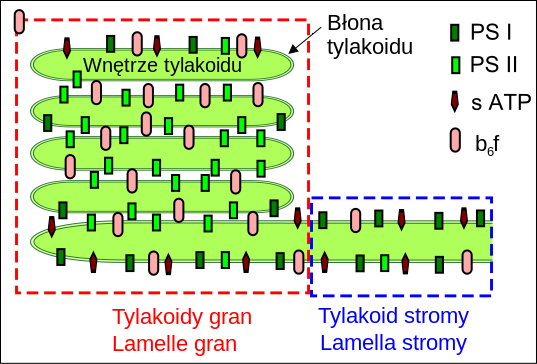 |
| Źródło: Wikipedia. Kompleksy fotosyntetyczne w błonie tylakoidów: PS I - fotoukład I, PS II - fotoukłąd II, b6f - kompleks cytochromowy b6f, s ATP - syntaza ATP. |
PRZESTRZENNY ROZKŁAD KOMPLEKSÓW BIAŁKOWYCH: W chloroplastach błony tylakoidów, w których znajdują się kompleksy biorące udział w fotosyntetycznym łańcuchu transportu elektronów oraz syntaza ATP, tworzą obszary błon ściśle ułożonych - tylakoidy gran oraz obszary gdzie błony leżą w dość dużych odstępach - tylakoidy stromy. Kompleksy biorące udział w fosforylacji fotosyntetycznej nie są równomiernie rozłożone w poszczególnych obszarach. O ile stosunek PSI do PSII dla całości tylakoidów wynosi 1, 13, to wewnętrznej część tylakoidów gran stosunek ten wynosi 1:4. W zewnętrznej części tylakoidów gran przeważa już PSI (PSI/PSII=1,28), a w tylakoidach stromy proporcja wynosi już 3, 1. W części tylakoidów stromy odległych od tylakoidów gran przewaga PSI nad PSII jest już trzynastokrotna. Szacuje się, że 80% PS II znajduje się w obszarach tworzących grana. Wyniki badań wskazują, że dimery cytochromów b6f rozłożone są równomiernie w błonach tylakoidów. Prawdopodobnie rozmieszczenie kompleksu cyt. b6f może zmieniać się zależnie od warunków. W określonych warunkach kompleks cyt. b6f może być wypierany z wewnętrznej części tylakoidów gran. Badania kinetyki przepływu elektronów podcxzas fosforylacji niecyklicznej stały się podstaawą do stworzenia modelu, w którym w tylakoidach gran PSII wraz z antenami zewnętrznymi tworzy mikrodomeny z kompleksem cytochromów b6f, co ułatwia dyfuzję plastochinolu pomiędzy kompleksami. Takie mikrodomeny nie charakteryzowały by się ścisłą stechiometrią i uporządkowaną strukturą.
Kompleks syntazy ATP podobnie jak PS I rozmieszczony jest w tylakoidach stromy. Przyczyną takiego rozmieszczenia syntazy ATP i PSI jest masywna budowa części stromowej. Heterogenność błon tylakoidów zapewnia równowagę między optymalnym wykorzystaniem energii absorbowanych fotonów, a koniecznością jej rozproszenia w sytuacji nadmiaru światła.
FOSFORYLACJA FOTOSYNTETYCZNA U BAKTERII: Wśród prokariontów zdolność do wytwarzania ATP przy użyciu energii świetlnej posiadają cztery grupy bakterii: sinice, bakterie zielone, bakterie purpurowe i heliobakterie. U sinic przebieg fotofosforylacji nie różni się zasadniczo od procesu zachodzącego u eukariontów. U pozostałych grup bakterii w łańcuchu transportu elektronów bierze udział tylko jedno centrum reakcji o różnych maksimach absorpcji. W centrach reakcji bakterii innych niż sinice znajdują się dimery bakteriochlorofilu.
Wiele badań wykazało duże podobieństwo centrów reakcji (RC1) nitkowatych bakterii zielonych oraz heliobakterii do fotoukładu I eukariontów i sinic oraz centrów reakcji bakterii purpurowych i zielonych bakterii siarkowych (RC2) do fotoukładu II. Dlatego pomimo istnienia różnic pomiędzy poszczególnymi grupami bakterii można wydzielić dwie grupy posiadające tylko jedno centrum reakcji i takie same przenośniki elektronów. Jedna z nich to grupa bakterii purpurowych, u których w transporcie elektronów bierze udział RC2, chinon, kompleks cytochromowy bc i cytochrom c. Druga grupa to zielone bakterie siarkowe i heliobakterie, u których elektron z RC1 może być przekazany na ferredoksynę i posłużyć do wytworzenia NADH lub na menachinon i poprzez kompleks bc i cytochrom c powrócić do centrum reakcji.
INHIBITORY: Wiele związków, które zaburzają działanie łańcucha transportu elektronów znalazło zastosowanie w rolnictwie jako herbicydy. Jedne z nich zastępują plastochinon w miejscu QB, inne uniemożliwiają przekazanie elektronu z fotoukładu I na NADP. Działanie inhibitorów blokujących łańcuch transportu elektronów widoczne jest także u bakterii fotosyntetyzujących.
EWOLUCJA: Wykorzystanie światła do przeprowadzania reakcji chemicznych stało się możliwe dzięki powstaniu centrów reakcji fotochemicznych. Część naukowców uważa, że jednostki fotosyntetyczne pojawiły się jeszcze w fazie prebiotycznej. Inni uważają, że centra reakcji i zdolność do przeprowadzania reakcji fotochemicznych pojawiła się znacznie później już po rozdzieleniu eubakterii i archeobakterii u oddychających beztlenowo przedstawicieli pierwszej z grup.
Przy założeniu wykształcenia centrów reakcji w fazie prebiotycznej prototyp fotoukładu mógł zawierać protoporfirynę IX związaną z kilkoma niewielkimi polipeptydami i wykazywać zdolność do przenoszenia elektronów lub protonów przez prymitywną błonę komórkową. W wyniku jego rozwoju powstał prekursor obecnych RC zawierający chlorofil a i współdziałając z centrum Fe-S jako kolejnym akceptorem elektronów oraz chinonem i cytochromami. Był już w stanie zapewnić prymitywny cykliczny transport elektronów. Zbudowane w ten sposób centrum reakcji dało początek centrum reakcji I. Z RC1 między 3,5-2,5 mld lat temu wykształcił się RC2 zwiększający możliwość wytwarzania siły redukcyjnej niezbędnej do asymilacji CO2.
Według zwolenników drugiej hipotezy centra reakcji powstały w wyniku przekształcenia kompleksu cytochromów bc1 uczestniczącego w oddychaniu komórkowym. W efekcie przekształceń powstałby kompleks cytochromów b6f, który zawiera jedną cząsteczkę chlorofilu a na cząsteczkę cytochromu f. Badania porównawcze sekwencji i struktury podjednostki cytochromu b kompleksu bc1 i polipeptydów rdzenia centrum reakcji typu drugiego wykazały podobieństwo regionów zawierających ligandy w postaci hemów i chinonów w cytochromie b i regionów polipeptydów RC przyłączających ligandy w postaci chlorofilu, feofityny i niehemowego żelaza. Rozpatrywane są dwie drogi wykształcenia bakterii o różnej ilości RC. Według części badaczy organizmy posiadające jedno centrum reakcji powstały z jednego przodka zawierającego oba centra z bakteriochlorofilem a, organizmy zawierające centra reakcji z chlorofilem a dały początek sinicom i wraz z wykształceniem kompleksu rozkładającego wodę stała się możliwa fosforylacja niecykliczna z wytworzeniem tlenu. Centra reakcji zielonych bakterii siarkowych oraz heliobakterii mogły powstać z pierwotnego centrum reakcji jeszcze przed powstaniem RC2. Centra reakcji zielonych bakterii nitkowych oraz bakterii purpurowych mogły powstać w wyniku utraty RC1 przez wspólnego przodka.
HISTORIA BADAŃ FOSFORYLACJI FOTOSYNTETYCZNEJ: Historia badań nad fosforylacją fotosyntetyczną jest częścią badań nad całym procesem fotosyntezy. Teoretyczne podstawy do badań procesów zachodzących podczas magazynowania energii światła przez organizmy fotosyntetyzujące stworzył Julius Rober Mayer, który w roku 1845 stwierdził: "rośliny zmieniają energię słońca w energię chemiczną". Dowody na syntezę ATP napędzaną przez światło opublikowali jako pierwsi Daniel Arnon, Mary Belle i F.R. Whatley w roku 1954, a trzy lata później wprowadzili określenie fosforylacja niecykliczna oraz cykliczna. Również w roku 1954 Albert Frenkel jako pierwszy zaobserwował syntezę ATP przez fragmenty błon fotosyntetyzujących bakterii. W roku 1956 Bessel Kok stwierdził występowanie u licznych organizmów fotosyntetyzujących barwnika o absorpcji maksymalnej 700 nm (centrum reakcji PSI). Doświadczenia Roberta Emersona z lat 1957-1958 opisujące efekt zwiększenia natężenia fotosyntezy przy oświetlaniu zawiesiny glonów Chlorella pyrenoidosa, powtórzone następnie na krasnorostach, okrzemkach i sinicach wskazywały na istnienie dwóch układów zaangażowanych w absorpcję światła. Doświadczenie jest znane jako efekt Emersona. Dowody na sprężenie produkcji ATP z łańcuchem transportu elektronów w oświetlanych chloroplastach zostały przedstawione w 1959 przez Dave Krogmannn, Modhay Avron i Andre Jagendorf. Poszczególne ogniwa łańcucha transportu elektronów były poznawane w kolejnych latach. W roku 1957 Lynch i French odkryli w chloroplastach niepolarny związek lipidowy, który był niezbędny do przeprowadzenia reakcji Hilla. Dwa lata później związek ten został zidentyfikowany przez Crane'a oraz Bishopa jako plastochinon.
W 1960 Robin Hill i Fay Bendall opisali schemat Z, zawierający dwa fotoukłady oraz kompleks cytochromów b6f pośredniczący w przekazywaniu elektronów pomiędzy nimi. W tym samym roku Sanjay Govindjee i Eugene Rabinowitch zaproponowali model, w którym w obu fotoukładach reakcję fotochemiczną przeprowadzał chlorofil a, a Katoh wykazał istnienie drugiego ruchliwego przenośnika uczestniczącego w łańcuchu transportu elektronów - plastocyjaniny zawierającej miedź. W 1961 roku Peter Mitchell opublikował założenia teorii chemiosmotycznej, która wyjaśniała mechanizm syntezy ATP zarówno w mitochondriach, jak i chloroplastach. Avron w roku 1964 odkrył czynnik sprzęgający fotosforylację - chloroplastową syntazę ATP. W 1975 Peter Mitchell przedstawił model obiegu elektronów pomiędzy dwoma miejscami wiązania chinonu na kompleksie cytochromów bc1 i b6f. W tym samym roku C. Bengis i N. Nelson przedstawili szczegółowy opis białek budujących centrum reakcji fotoukładu I. W roku 1975 Phil Thornber wykazał przy zastosowaniu elektroforezy niedenaturującej, że chlorofil tworzy kompleksy w połączeniu z białkami. W latach 1976-1978 Hans-Erik Akerlund, Per-Ake Albertsson i Bertil Andersson prowadząc badania nad izolacją i rozmieszczeniem polimerów fotoukładu II wykazała heterogenność błon tylakoidów. Fotoukład II zlokalizowany był niemal wyłącznie w wewnętrznej części tylakoidów gran, a fotoukład I w zewnętrznych częściach tylakoidów graniczących ze stromą. W roku 1977 Vyacheslav Klimov, Alexander Klevanik, Vladimir Shuvalov i Alexander Krasnovsky udowodnili, że feofityna jest pierwotnym akceptorem elektronów w fotoukładzie II. W tym samym roku John Bennett okdrył, że kompleksy zbierające światło LHC II mogą ulegać odwracalnej fosforylacji. Rok później Peter Colman, Hans Freeman, J.M. Guss, M. Murata, V.A. Noriss, J.A.M. Ramshaw i M.P. Verikatappa opisali trójwymiarową strukturę plastocyjaniny. W latach 1978-1982 zespół badawczy pod kierownictwem Lawrence Bogorad zsekwencjonował gen odpowiedzialny za syntezę białka D1. Colin Wraight i Bruno Velthuys niezależnie w roku 1981 wyjaśnili działanie niektórych herbicydów jako blokowanie miejsca przyłączenia PQ na fotoukładzie II. W tym samym roku Tsukihara opisał trójwymiarową strukturę ferredoksyny z Spirulina platensis. Berthold, Babcock i Yocum wyizolowali aktywny kompleks rozkładający wodę z fotoukładu II w roku 1981. W 1984 J. Deisenhofer, O. Epp,, K. Miki, R. Huber i Hartmut Michel opisali trójwymiarową strukturę centrum reakcji z chromatoforów Rhodopseudomonas viridis, za co w roku 1988 otrzymali Nagrodę Nobla w dziedzinie chemii. Rok później Lawrence Bogorad ze współpracownikami zsekwencjonowali geny kodujące centrum reakcji fotoukładu I. W 1986 O. Nanba i Kimiyuki Satoh wyizolowali i oczyścili kompleks zawierający białka D1, D2 i cytochrom b559 oraz wykazali, że posiada on właściwości centrum reakcji fotoukładu II. N. Tamura i George Cheniae wykazali w 1987 fotoaktywację manganu w fotoukładzie II. W 1987 I. Witt jako pierwszy wyizolował w postaci krystalicznej fotoukład I sinic. John Biggins i Paul Mathis w 1988 doświadczalnie potwierdzili udział filochinonu (witaminy K) w transporcie elektronów w fotoukładzie I. Rick Debus, Bridgette Barry, Jerry Babcock i Lee McIntosh przedstawili dowody, potiwerdzające, że tyrozyna-161 białka D1 jest donorem elektronów dla centrum reakcji PSII W 1988. W 1989 Wasielewski, Sibert, Govindjee wraz ze współpracownikami jako pierwsi opublikowali wyniki pomiarów szybkości przenoszenia elektronów pomiędzy elementami fotoukładu II. Rok później Kevin C. Parrett, Tetemke Mehari i John H. Golbeck wykazali, że przyłączenie wcześniej oderwanych centrów FeS przywraca transport elektronów indukowany światłem W 1992 Rudolph Marcus otrzymał Nagrodę Nobla w dziedzinie chemii za swoją teorię tłumacczącą przenoszenie elektronów między innymi podczas fotosyntetycznego transportu elektronów. W latach 1992-2001 Petra Fromme, Patrick Jordan, Norbert Krauss, Horst Witt, Olaf Klukas i Wolfgang Saenger opisali trójwymiarową strukturę fotoukładu i termofilnej sinicy. W roku 1994 Werner Kuhlbrandt i współpracowniwcy przedstawili trójwymiarową strukturę roślinnych kompleksów antenowych - LHC II. S. E. Martinez, D. Huang, A. Szczepaniak, W.A. Cramer i J.L. Smith w 1994 opisali trójwymiarową strukturę lumenarnej części domeny cytochromu f. W 1997 Paul Boyer i John E. Walker otrzymali Nagrodę Nobla za wyjaśnienie struktury mitochondrialnej podjednostki F1 syntazy ATP oraz opis mechanizmu syntezy ATP. Christopher Bruns i P. Andrew Karplus opisali trójwymiarową strukturę oksydoreduktazy ferredoksyna-NADP w roku 1995. W latach 1996-1997 Cramer i współpracownicy opisali trójwymiarową strukturę białka Rieske. Zouni, Fromme, Witt, Sanger w 2001 opisali w rozdzielczości 3.8 Å trówymiarową strukturę centrum reakcji fotoukładu II termofilnej bakterii, abadania Kamiya i Shen oraz Ferreira dostarczyły kolejnych szczegółów budowy kompleksu rozkładającego wodę. W roku 2003 Depège wykazał istnienie jednej z kinaz odpowiedzialnych za fosforylację LHC II. W tym samym roku została opisana struktura kompleksu cytochromów b6f. Dokonały tego dwa pracujace niezależnie zespoły. William Cramer, Genji Kurisu, Janet L. Smith i Huamin Zhang ze Stanów Zjednoczonych opisali strukturę kompleksu z Mastigocladus, a Daniel Picot, Jean-Luc Popot i David Stroebel z Francji strukturę kompleksu pochodzącego z Chlamydomonas reinhardtii.
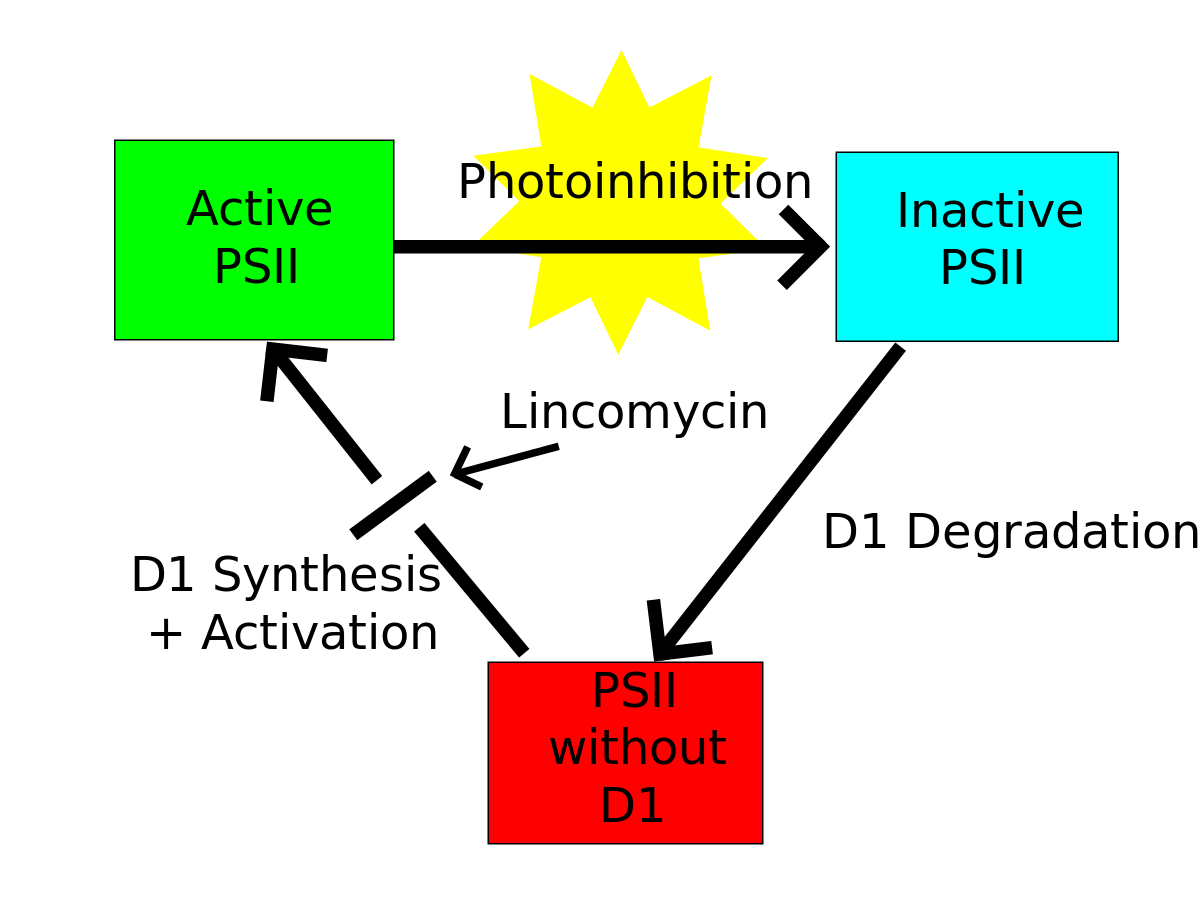 |
| Źródło: Wikimedia. |
15) Fotoinhibicja - jest to zjawisko hamowania fotosyntezy przy dużych natężeniach światła. Jeśli organizmy fotosyntetyzujące absorbują więcej światła niż może być wykorzystane w procesach fotosyntezy dochodzi do uszkodzenia aparatu fotosyntetycznego. Zjawisko fotoinhibicji zależne jest nie tylko od natężenia światła, lecz także od warunków w jakich rośnie roślina. Do fotoinhibicji dochodzi często gdy przy niskich temperaturach ograniczających reakcje enzymatyczne roślina zostanie wystawiiona na działanie silnego światła (np. w wiosenne poranki gdy natężenie światła jest duże a temperatura jest bliska zeru, przy przeniesieniu rośliny rosnącej w cieniu na miejsce w pełnym świetle), suszy, zasoleniu gleby. Rośliny posiadają mechanizmy pozwalające na adaptację do zmieniających się warunków świetlnych. Gdy jednak adaptacja do warunków świetlnych okaże się niewystarczająca dochodzi do obniżenia natężenia fotosyntezy mierzonej jako wydzielanie tlenu lub pobieranie CO2. Główną przyczyną obniżenia natężenia fotosyntezy jest uszkodzenie fotoukładu II. Akceptory elektronów, plastochinon A i B, przejmujące elektron wybity z centrum reakcji pzostają trwale w stanie zredukowanym, a centrum reakcji nie jest w stanie odbierać energii od anten fotosyntetycznych. Dochodzi do uszkodzenia białka D1 obecnego w fotoukładzie II, będącego miejscem przyłączenia plastochinonu B. Uszkodzone fotoukłady zostają wyłączone z fotosyntetycznego łańcucha transportu elektronów, aż do czasu degradacji uszkodzonego białka D1 i jego odtworzenia. Brak możliwości przekazania energii do centrum reakcji prowadzi do wytwarzania reaktywnych form tlenu co także może stać się przyczyną uszkodzenia fotoukładu II. Podczas fotoinhibicji dochodzi również do uszkodzenia kompleksu rozszczepiającego wodę z którego odłączane są jony manganu oraz polipeptydy peryferyjne. Zjawisko fotoinhibicji jest odwracalne i po naprawie aparatu fotosyntetycznego roślina może powrócić do pierwotneo natężenia fotosyntezy a nawet natężenie to może wzrosnąć przy utrzymujących się podwyższonych natężeniach światła.
 |
| Źródło: Wikipedia. |
16) Fotooddychanie, fotorespiracja - jest to proces biochemiczny zachodzący na świetle w komórkach roślinnych, objawiający się pobieraniem tlenu i wydzielaniem dwutlnku węgla na drodze innej niż oddychanie komórkowe. Biochemicznie proces fotooddychania związany jest z dwufunkcyjnością enzymu karboksylazy/oksygenazy rybulozo-1-5-bisfosforanu (RuBisCO), odpowiedzialnego zarówno za przyłączenie do rybulozo-1,5-bisfosforanu (RuBP) cząsteczki CO2, jak i cząsteczki O2 w chloroplastach podczas oświetlania. CO2 i O2 konkurują o miejsce katalityczne Rubisco. W wyniku przyłączenia tlenu do rybulozo-1-5-bisfosforanu powstaje jedna cząsteczka kwasu fosfoglicerynowego (jak w fazie ciemnej fotosyntezy) oraz jedna cząsteczka fosfoglikolanu, pierwszego (dwuwęglowego; C2) produktu fotooddychania. Stąd pochodzi inna nazwa fotooddychania - cykl C2. Dalsze reakcje zachodzą w peroksysomach i mitochondriach, a następnie ponownie w chloroplastach. Powstający w chloroplastach gosfoglikolan ulega defosforylacji i przenoszony jest do peroksysomów. Tam przy udziale oksydazy glikolanowej przekształcany jest do glioksalanu. Glioksalan ulega transaminacji w dwóch reakcjach przeprowadzanych przez aminotransferazę glutaminianową i aminotransferazę serynową, w wyniku których powstaje glicyna. Glicyna transportowana jest do mitochondriów i przy udziale kompleksu enzymatycznego dekarboksylazy glicyny (GDC) oraz hydroksymetylotransferazy seryny (SHMT) przekształcana do seryny z wydzieleniem cząsteczki CO2, NH3, oraz NADH.
Powstała w mitochondriach seryna transportowana jest do peroksysomów i przekształcana przy udziale aminotransferazy serynowej do kwasu hydroksypirogronowego. Kwas ten ulega redukcji do kwasu glicerynowego przy udziale reduktazy hydroksypirogronianowej. Produkt reakcji przenoszony jest do chloroplastów i może służyć do odtworzenia cząsteczki rybulozo-1-5-bisfosforanu. NADH produkowany przy dekarboksylacji glicyny może być transportowany do cytozolu lub utleniany w mitochondriach.
Utrzymanie cyklu fotooddechowego wymaga takiej samej ilości NADH, do redukcji kwasu hydroksypirogronowego w peroksysomach, jaka powstaje przy utlenieniu glicyny do seryny w mitochondrium. In vivo, przynajmniej część NADH produkowanego przez dekarboksylację glicyny utleniana jest w peroksysomach, jednak zapotrzebowanie peroksysomów na NADH może być częściowo zaspokajane przez glikolizę i chloroplasty, a utlenianie glicyny zasilać syntezę ATP mitochondrialnego.
17) FOTOSYNTEZA C4
18) FOTOSYNTEZA CAM
19) Fotoukład - jest to kompleks barwnikowo-lipidowo-białkowy abasorbujący kwanty światła. Fotoukład tworzą centrum reakcji fotoukładu oraz towarzyszące mu układy antenowe absorbujące kwanty światła (fotony) i przekazujące energię do centrum reakcji. W centrum reakcji z dimera chlorofilu a wybijany jest elektron i przekazywane na kolejne przenośniki elektronów. W błonach tylakoidów można wyróżnić dwa rodzaje fotoukładów:
- FOTOUKŁAD I - składający się z centrum reakcji PS I oraz układu antenowego określanego jako LHC I. W centrum reakcji znajduje się para cząsteczek chlorofilu a. PS I działa z maksymalną wydajnością przy długości fali 700 nm stąd stosowane oznaczenie - P 700. Fotoukład PS I występuje głównie w lamelach - tylakoidach stromy. Charakterystyczne dla fotoukładu I są układy antenowe określane nazwą - LHC I (ang. Light Harvesting Complex), w których stosunek chlorofilu a do chlorofilu b wynosi a:b=4:1.
- FOTOUKŁAD II - składający się z centrum reakcji PS II oraz układu antenowego określanego jako LHC II. W centrum reakcji znajduje się para cząsteczek chlorofilu a. PS II działa z maksymalną wydajnością przy długości fali 680 nm stąd stosowane oznaczenie - P 680. Fotoukład PS II występuje głównie w tylakoidach gran. Charakterystyczne dla fotoukładu II są układy antenowe określane nazwą - LHC II, w których stosunek chlorofilu a do chlorofilu b wynosi a:b = 1:1.
 |
| Źródło: Wikipedia. Schemat fotoukładu I i II. |
FOTOUKŁAD II jest pierwszym kompleksem białek w reakcji fotochemicznej fotosyntezy tlenowej. Zlokalizowany jest w tylakoidach roślin, glonów i sinic. W czasie fotosyntezy, enzymy zbierają fotony światła by wzbudzić elektrony, które są następnie przesyłane przez rozmaite koenzymy i kofaktory by zredukować plastochinon do plastochinolu. Wzbudzone elektrony w efekcie rozkładu wody wymieniane są na jony wodorowe i tlen cząsteczkowy. Prze zastąpienie elktronów, tymi jakie pochodzą z fotodysocjacji wody, fotoukład II otrzymuje elektrony potrzebne do wszystkich fotosyntez. jony wodorowe (protony) powstałe przez utlenianie wody pomagają przy powstaniu gradientu protonowego potrzebnego podczas syntezy ATP której produktej jest ATP. Wzbudzone elektrony przesłane do plastochinonu ostatecznie użyte są do redukcji NADP+ do NADPH lub biorą udział w cyklicznej fosforylacji fotosyntetycznej.
STRUKTURA: Rdzeń fotoukładu II składa się z pseudo-symetrycznego heterodimeru tworzonego przez dwa homologiczne białka D1 oraz D2. Inaczej niż centra reakcji wszystkich innych fotoukładów, u których występują specjalne dwójki umiejscowionych blisko siebie cząstek chlorofilu, pigment ulegający wstępnej separacji ładunku fotoindukcyjnego w fotoukładzie jest monomerem chlorofilu. Ponieważ dodatni ładunek nie jest dzielony pomiędzy dwie cząsteczki, zjonizowany pigment jest wysoce utleniony i może brać udział w fotolizie wody.
 |
| Źródło: Wikipedia. Fotoukład II sinic, Monomer, PDB (Protein Data Base) kod: 2AXT. |
Fotoukład II (sinic oraz roślin zielonych) składa się z około 20 podjednostek (zależnie od organizmu) tak samo jak współpracujące z nim białka zbierające światło. Każdy fotoukład II zawiera co najmniej 99 kofaktorów: 35 chlorofili a, 12 beta-karotenów, 2 feofityny, 2 plastochinony, 2 żelazoporyfiny, 1 wodorowęglan, 20 lipidów, klaster Mn4CaO5 (włączając dwa jony chlorowe), jeden nie-hemowy kation żelaza Fe2+ oraz prawdopodobnie dwa kationy wapnia Ca2+ na każdy monomer. Występują różne struktury krystaliczne fotoukładu II.
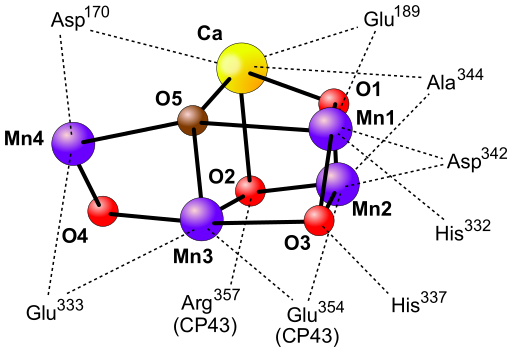 |
| Źródło: Zaproponowana struktura centrum manganowego. |
KOMPLEKS ROZKŁADAJĄCY WODĘ (OEC): Kompleks rozkładający wodę stanowi miejsce rozkładu wody. Jest to klaster utworzony z utlenionych metali na którego budowę składają się cztery jony manganowe (na +3 i +4 stopniu utlenienia) i jeden dwuwartościowy jon wapnia. W trakcie rozkładu wody, produkuje on tlen gazowy oraz protony, sekwencyjnie przenosi cztery elektrony pochodzące z wody do bocznego łańcucha tyrozyny (D1-Y161), a następnie do samego P680 (dimer chlorofilu). Struktura kompleksu rozkładającego wodę wciąż nie jest do końca zbadana. Struktury uzyskane dzięki rentgenografii strukturalnej są szczególnie dyskusyjne, od momentu uzyskania danych o redukcji atomów manganu przez silne promieniowanie rentgenowskie użyte podczas przeprowadzenia badań, zmieniające strukturę OEC. Wszelako krystalografia jako połączenie innych mniej inwazyjnych metod spektroskopowych jak np. EXAFSH i spektroskopia EPR daje dosyć przejrzysty obraz struktury klastra. Jedną z możliwości jest struktura zbliżona do kubanu. W 2011 roku, po przeprowadzeniu badań na poziomie 1,9 angstrema odkryto pięć atomów tlenu służących jako mostki tlenowe łączące pięć atomów metlau i cztery cząsteczki wody przyłączane do klastra Mn4CaO5; w każdym pojedynczym monomerze fotoukładu II odnaleziono ponad 1300 cząsteczek wody, niektóre z nich tworzą rozległe sieci dzięki wykorzystaniu wiązań wodorowych, mogą one służyć jako kanały przesyłu protonów, wody lub cząsteczek tlenu.
ROZKŁAD WODY: Fotosyntetyczny rozkład wody (lub uwalnianie tlenu) jest jedną z najważniejszych reakcji na naszej planecie, gdyż stanowi źródło niemal całego tlenu atmosferycznego. Co więcej, fotosyntetyczny rozkład wody będący efektem działań człowieka, może wpłynąć na efektywność wykorzystania światła słonecznego jako alternatywnego źródła energii. Mechanizm rozkładu wody nie jest w pełni wyjaśniony, znane są jednak liczne jego szczegóły. Rozkład wody do tlenu cząsteczkowego wymaga oderwania czterech elektronów i czterech protonów z dwóch cząsteczek wody. Dane doświadczalne uzyskane przez Pierre Joliot wraz z innymi autorami pokazują, że tlen jest uwalniany w trakcie cyklicznej reakcji kompleksu rozkładu wody (OEC) wewnątrz fotoukładu II. Wykazali oni, że materiał fotosyntetyczny przystosowany do ciemności (rosliny wyższe, glony, sinice) a wystawiony na serie pojedynczych impulsów światła, uwalnia tlen w typowych, cztero-okresowych wahaniach z maksimum przypadającym na trzecie i siódme naświetlanie i minimum przypadającym na pierwsze i piąte naświetlanie. Bazując na tym eksperymencie, Bessel Kok wraz ze współpracownikami wprowadził cykl pięciu przejściowych naświetleń zwanych stanami S, opisującymi cztery stany utlenienia (redox) kompleksu rozkładającego wodę. Kiedy zgromadzone są cztery równoważniki utleniaczy (w stanie S4) OEC powraca do stnau początkowego S- jaki zachowuje podczas nieprzerywanej ciemności. Ostatecznie Jablonsky i Lazar zaproponowali wprowadzenie średnio-zaawansowanych stanów S będących mechanizmem regulacyjnym i łączącym stany S i tyrozynę Z.
20)
21) Punkt kompensacyjny stężenia dwutlenku węgla - jest to stężenie CO2, przy którym równoważą się procesy pobierania (fotosynteza) i wydzielania dwutlenku węgla (oddychanie komórkowe, fotooddychanie) przez rośliny. Roślina nie wydziela ani nie pobiera CO2. Punkt kompensacyjny u roślin o typie fotosyntezy C4 jest niższy niż u roślin o typie C3. Na przykład dla cibory papirusowej czy spartiny to poniżej 10 ppm CO2 podczas gdy u trzciny pospolitej czy mozgi trzcinowej to 40-60 ppm CO2.
22) Punkt kompensacyjny świetlny (punkt zrównoważenia fotosyntezy i oddychania) - jest to natężenie światła, przy którym równoważą się procesy pobierania (fotosynteza) i wydzielania dwutlenku węgla (oddychanie komórkowe, fotooddychanie) przez rośliny. Roślina nie wydziela ani nie pobiera CO2.
23)
24)
 |
| Źródło: Wikipedia. Model budowy syntazy ATP. |
Syntaza ATP znajduje się w wewnętrznej błonie mitochondriów, w błonach tylakoidów wewnątrz chloroplastów oraz w błonach komórkowych organizmów prokariotycznych. Enzym bierze udział w kluczowych procesach uzyskiwania energii przez organizmy żywe fosforylacji oksydacyjnej będącej głównym źródłem ATP wytwarzanego podczas oddychania komórkowego oraz fosforylacji fotosyntetycznej będącej źródłem ATP powstającego w fazie jasnej fotosyntezy. Inhibitorem syntazy ATP wykorzystywanym w badaniach biologicznych jest antybiotyk - oligomycyna.
ROLA FIZJOLOGICZNA:
 |
| Źródło: Wikipedia. Mechanizm syntezy ATP. ATP - kolor czerwony, ADP i ortofosforan - kolor różowy, obracająca się podjednostka gamma - kolor czarny. |
BUDOWA ENZYMU: Ze względu na miejsce występowania wyróżnia się trzy podstawowe kompleksy syntazy ATP. Są to:
- Syntaza ATP mitochondrialna określana jako F0F1 lub MF0F1,
- Syntaza ATP chloroplastowa określana jako CF0F1
- Syntaza ATP prokariotyczna
Wszystkie trzy syntazy ATP zaliczane są do grupy F-ATPaz i mają zbliżoną budowę. Każda z nich składa się z dwóch domen Pierwsza z nich - F0 - jest białkiem wewnątrzbłonowym tworzącym kanał jonowy dla jonów H+. Druga domena jest właściwą syntazą składającą się z kilkunastu polipeptydów tworzących kulistą strukturę o średnicy ok. 100 Å.
EWOLUCJA: Uważa się, że ewolucja syntazy ATP zachodziła modułowo. Obie domeny wraz ze swoimi wartościowościami połączyły się zyskując nową funkcję. Domena F1 wykazuje znaczne podobieństwo do heksamerycznej helikazy DNA, a domena F0 jest podobna do kompleksów tworzących motor molekularny napędzający wici komórek. Heksamer alfa3beta3 tworzący domenę F1 podobnie jak helikaza DNA składa się z obracającego się pierścienia z otworem pośrodku. U obu enzymów obroty pierścienia umożliwiają pełnienie funkcji. Helikaza DNA porusza się po helisie DNA przy jednoczesnej hydrolizie nukleotydów. Domena F1 wykorzystuje zmiany konformacyjne podcxzas obrotu podjednostki gamma do przeprowadzenia reakcji enzymatycznej.
Jony H+ przepływające przez domenę F0 w bardzo podobny sposób jak przy napędzaniu motoru molekularnego poruszającego wicią. Ich wspólną cechą jest pierścień składający się z wielu alfa-helikalnych białek, które obracają się w stosunku do innych białek zużywając jednocześnie gradient protonowy jako źródło energii. Jest to jednakże dość wątły związek, ogólna struktura motorów molekularnych jest zdecydowanie większa, zawierają 30 polipeptydów, w porównaniu do 10, 11, lub 14 znanych polipeptydów domeny F0.
Modułowa teoria pochodzenia syntazy ATP sugeruje, że dwie domeny o niezależnych funkcjach, helikaza DNA posiadająca właściwości ATPazy i motor molekularny napędzany siłą protonomotoryczną, mogły się połączyć i doprowadzić do odwrócenia właściwości ATPazy powstałej z helikazy DNA. Dalszy rozwój prowadziłby do powstania kompleksu syntazy ATP znanej dzisiaj. Alternatywnie kompleks helikazy DNA i motoru molekularnego mógł wykazywać początkowo aktywność ATPazy, która przenosiła jony H+ zużywając ATP. Dalsza ewolucja kompleksu mogłąby doprowadzić do odwrócenia przeprowadzanej reakcji i powstania funkcji spełnianej przez syntazę ATP.
26) SZTUCZNA FOTOSYNTEZA - jest to pojęcie, które ogólnie obejmuje "skopiowanie" naturalnego procesu fotosyntezy, a także związane z tym badania, w celu otrzymania wysokoenergetycznych związków chemicznych z dwutlenku węgla i wody przy udziale energii słonecznej, czasami także pod pojęciem tym rozumiany jest rozkład wody na wodór i tlen za pomocą energii słonecznej. Termin dotyczy także starań naukowców, aby otrzymać z dwutlenku węgla i wody w reakcji sztucznej fotosyntezy płynne paliwo.
Sztuczna fotosynteza jest wzorowana na zjawisku fotosyntezy zachodzącej w komórkach roślin, gdzie z wody i CO2 za sprawą energii światła słonecznego powstają użyteczne biologicznie węglowodany (na przykład glukoza), służące jako źródło energii lub materiał do syntezy innych związków organicznych (białek i tłuszczów), a jako produkt uboczny zostaje wydzielony do atmosfery O2. Kluczową rolę w fotosyntezie odgrywają fotoukłady - połączenie białek i absorbujących światło barwników, dzięki którym możliwa jest zamiana energii światła słonecznego na energię chemiczną. Fotosynteza umożliwiła życie na Ziemi zwierzętom, któ®e oddychają tlenem i odżywiają się pożywieniem opartym na organicznych związkach węgla. Wizję odtworzenia fotosyntezy, czyli największej tajemnicy roślin, zastąpienia kominów szeregami czystych probówek i roślin jako niewyczerpalnego źródła trwałej energii przedstawił w 1912 roku na łamach czasopisma naukowego "Science" włoski chemik Giacomo Ciamician. Od lat 70. XX wieku zaczęło wzrastać zainteresowanie sztuczną fotosyntezą. W dzisiejszych czasach naukowcy uważają, że odtworzenie fotosyntezy w warunkach laboratoryjnych i wypracowanie ekonomicznych metod na skalę przemysłową rozwiązałoby kryzys energetyczny i zaspokoiło zapotrzebowanie na energię. Opracowanie konceptu sztucznej fotosyntezy dawałoby bowiem możliwość produkowania elektryczności, wodoru lub innego paliwa (metan, etanol), które mogłoby być wykorzystywane jako napęd do samochodów, a ponadto pozwalałoby na utylizowanie nadmiaru CO2 z atmosfery, do którego doszło wskutek spalania paliw kopalnych jako źródła energii. Naukowcy mają też nadzieję, że sztuczna fotosynteza okaże się bardziej ekonomiczna i zastąpi inną, alternatywną metodę produkcji wodoru opartą na elektrolizie wody przy użyciu energii z baterii słonecznych. Układy do sztucznej fotosyntezy chociąż będą naśladować fotosyntezę, to jednakże nie będą przypominać roślin swym wyglądem. Światło słoneczne będzie najprawdopodobniej absorbowane przez metale tj. ruten i żelazo, zaś centrum reakcji będzie opierało się na manganie.
WODÓR JAKO PALIWO: W celu wyprodukowania wodoru (paliwo przyjazne dla środowiska naturalnego, przy jego spalaniu lub stosowaniu w ogniwie paliwowym powstaje wyłącznie woda) z wody i energii światła słonecznego (Tanie, ławo dostępne, odnawialne i niewyczerpywane źródła), w warunkach sztucznie stworzonych przez człowieka, bada się dwie metody:
- metodę biologiczną, w której dąży się do otrzymania efektywnie fotosyntetyzujących organizmów, które byłyby wykorzystywane w bioreaktorach, np. Chlamydomonas reinhardtii posiada zdolność produkowania wodoru przez enzym hydrogenazę umieszczona po zewnętrznej stronie błony fotosyntetyzującej, której wydajność determinowana jest przez dostępność elektronów i protonów pochodzących z rozkładu wody przez fotoukład II.
- metodę sztuczną, która polega na biomimetycznym "skopiowaniu" naturalnych enzymów (np. tyrozyna-Z w fotosystemie II) i zsyntetyzowaniu manganowych, rutenowych lub żelazowych katalizatoró∑ dla reakcji otrzymywania wodoru z wody przy udziale światła słonecznego.
U organizmów fotoautotroficznych enzym katalizujący reakcję rozdziału wody zawiera chlorofil, a jego struktura i zachodzące procesy są wciąż odkrywane i opisywane. Szwedzkim naukowcom udało się stworzyć nieorganiczny kompleks rutenu i manganu, który zastąpił chlorofil i prowadził do otrzymania 4 wolnych elektronów, jak to ma miejsce w naturze.
Naukowcy badają proces fotosyntezy glonów, aby otrzymane rezultaty wykorzystać do opracowania procesu sztucznej fotosyntezy. Biotechnolodzy usiłują tak zmodyfikować DNA glonów, aby te oddawały więcej wodoru. Wydajność "kopiowania" fotosyntezy i uzysku energii za pośrednictwem glonów w fotobioreaktorach jest znacznie wyższa niż z roślin naczyniowych. W ogólnej kalkulacji kosztów będzie ona jednak bardzo niska w stosunku do organicznych, polimerowych ogniw fotowoltaicznych. Pomimo tego naukowcy idą w kierunku wykorzystania glonów do produkcji i magazynowania przez nie tłuszczy, a także skrobi i celulozy aby je wykorzystać do produkcji biopaliw. Jest to działanie najlepiej ekonomicznie uzasadnione, koniecznością szybkiej utylizacji toksycznych i długo zalegających w środowisku odpadów biologicznych i spalin kotłowych. Ich ogromne objętości i zasoby energetyczne mogą być racjonalniej zagospodarowane z udziałem fotosyntetyzujących mikro-glonów.
SZTUCZNA BŁONA KOMÓRKOWA: Trwają także eksperymenty nad wytworzeniem sztucznej błony, przez którą przechodzące cząsteczki wody ulegałyby pod wpływem światła słonecznego rozkładowi do tlenu i wodoru. Poszukuje się nie tylko katalizatora, który inicjowałby oraz przyspieszał reakcję rozdziału wody pod wpływem fotonów, ale także receptora, który byłby w stanie wychwytywać i zatrzymywać uwolnione elektrony.
ELEKTRYCZNOŚĆ Z PROMIENIOWANIA SŁONECZNEGO: Przedmiotem badań jest również możliwość przetworzenia promieniowania słonecznego w energię elektryczną. Pracującym nad tym zagadnieniem chińskim naukowcom udao się opracować nano-rurki węglowe, dzięki któ®ym możliwe stało się odtwarzanie systemu reakcji, w któ®ej bierze udział jednocześnie wiele elektronów, do którego zalicza się fotosynteza, albowiem tylko ukłądy wieloelektronowe są w stanie dostarczyć wystarczającą ilość energii do produkcji węglowodanów. Dotychczasowe systemy były w stanie wytworzyć i zaabsorbować tylko 1 elektron w tym samym czasie. Krótkie nano-rurki węglowe o pojedynczej ścianie, które zaweirają 32 atomy węgla, stanowią układ wieloelektronowy, będący w stanie zaabsorbować 32 elektrony (1 elektron przez 1 atom) i mogą pełnić funkcję absorbowania i magazynowania wolnych elektronów w procesie sztucznej fotosyntezy. Sztuczny układ naśladujący fotosyntezę musi składać się z donora elektronów (cząsteczki, która po pochłonięciu światła widzialnego jest zdolna do uwalniania elektronów) oraz akceptora elektronów (cząsteczki, która jest w stanie przyjąć elektrony od innych cząsteczek i zmagazynować je), np. nano-rurki węglowe.
Nie są znane małę cząsteczki, które uwalniałyby dużą liczbę elektronów po zaabsorbowaniu światła widzialnego, cząsteczki ftalocyjanin uwalniają jedynie pojedynczy elektron. Doświadczalny układ wieloelektronowy złożony z jednej nano-rurki węglowej o długości 1 mikrometr (akceptor) i 120 cząsteczek ftalocyjanin osadzonych kowalencyjnie (donor), byłby w stanie zmagazynować około 25% uwolnionych elektronów. Te elektrony mogły teoretycznie także posłużyć do przemiany chloroplastowego NADP w NADPH, który służy do redukowania CO2 i syntezy węglowodanów.
ZŁOTY LIŚĆ: Zespół inżynierów chemicznych Kanne Jenningsa i Petera Ciesielskiego z Vanderbilt University w Nashville skonstruował tzw. złoty liść (Gold leaf lub Cyborg leaf), opierając się na wcześniejszym eksperymencie Eliasa Greenbauma, który dowiódł, że kompleks białkowy wyizolowany z liści szpinaku (nazwany PS I) pozostawał aktywny po unieruchomieniu na płytce złota. Wyizolowane kompleksy z roślin umieszczono na cienkich złotych płytkach. Przy dostępie światła słonecznego kompleksy PS I generowały wolne elektrony, które przechodziły do złotej płytki i następnie mogły zostać pobrane jako prąd elektryczny. Proces nie jest ekonomiczny, nie dorównuje wydajnością krzemowym bakteriom słonecznym, ale naukowcy pracują nad dalszym udoskonaleniem możliwości przemiany energii promieniowania słonecznego za pomocą substancji roślinnych.
METODA NAZIMKA: W 2009 roku w mediach w Polsce pojawił się szereg artykułów informujących o opracowaniu przez Dobiesława Nazimka nowej metody sztucznej fotosyntezy opartej na fotokatalitycznej reakcji tworzenia metanolu z dwutlenku węgla i wody. Opisywana była m.in. jako metoda mogąca "odmienić cały polski przemysł i przynieść ogromne zyski". Sprawą zainteresował się również ówczesny wicepremier Waldemar Pawlak. Projekt pod kierownictwem Nazimka rozpoczął się na Uniwersytecie Marii Curie Skłodowskiej w Lublinie w 2006 roku. W 2009 roku zespołowi Nazimka udało się uzyskać patent na fotokatalizator stosowany w tej metodzie. Metoda ta opiera się na wykorzystaniu fotokatalizatora opartego na tlenku tytanu (IV) do konwersji rozpuszczonego w wodzie dwutlenku węgla poprzez naświetlanie promieniowaniem nadfioletowym Otrzymany w ten sposób metanol poddaje się następnie procesowi MTG w celu uzyskania paliwa. Jednocześnie zespół Nazimka pracował nad podobną metodą, w któ®ej produktem byłby etanol.
Wyniki uzyskane przez Nazimka spotkały się jednak z krytyką. Wskazano, że ilość energii jaką trzeba dostarczyć, aby wytworzyć określoną ilość metanolu tą metodą jest w rzeczywistości ponad trzy razy większa niż zakładana przez Nazimka, a koszt uzyskanego w ten sposób paliwa - ponad dziesięciokrotnie większy od zakładanego. Dodatkowo, w metodzie tej wykorzystano czysty dwutlenek węgla, stosunkowo rzadko stosowany w przemyśle chemicznym, a nie dwutlenek węgla zmieszany z powietrzem. Ernest Aleksy Bartnik z Wydziału Fizyki Uniwersytetu Warszawskiego wskazał, że energia otrzymana ze spalania takiego paliwa byłaby mniejsza niż potrzebna do jego uzyskania,a produkcja tego paliwa w Polsce wiązałaby się z emisją większej ilości dwutlenku węgla niż byłaby wykorzystywana do produkcji metanolu. Janusz Płocharski z Wydziału Chemicznego Politechniki Warszawskiej zauważył, że rzeczywisty koszt takiego paliwa musiałby wynosić kilkadziesiąt złotych za litr, a reklamowanie tej metody w mediach przez Nazimka może być manipulacją ukierunkowaną na zdobycie dotacji na badania. Lucjan Pawłowski z Wydziału Inżynierii Środowiska Politechniki Lubelskiej porównał tę metodę do perpetuum mobile, a reklamowanie tej metody w mediach przez Nazimka jako "propagandę".

















Brak komentarzy:
Prześlij komentarz