HISTORIA GIBERELIN:
Początki badań nad giberelinami można prześledzić od badań japońskich patologów roślin, którzy badali przyczyna "bakanae" - choroby, która poważnie obniżała wydajność upraw ryżu w Japonii, na Tajwanie i na całym kontynencie Azjatyckim. Bakanae to choroba, które infekuje ryż roślin - dziś wiemy, że spowodowana jest obecnością grzyba Gibberella fujikuroi, których metabolizm wytwarza nadmiar kwasu giberelinowego. Działa on jak hormon wzrostu i powoduje przerost roślin. Rośliny stają się bezpłodne, nie wytwarzają jadalnych ziaren i nie potrafią utrzymać własnego ciężaru - przewracają się zatem i umierają. Bakanae można obecnie łatwo zapobieg poprzez traktowanie nasion przed wysiewem fungicydami.
1898 r. - Shotaro Hori publikuje pierwszy dokument o prawdopodobnej przyczynie Bakanae. Uważa, że objawy wywołane były przez zakażenie grzybem należącym do rodzaju Fusarium, prawdopodobnie Fusarium heterosporium Nees.
1912 - Sawa publikuje pracę pt. "The Diseases of Crops in Taiwan", gdzie sugeruje, że nadmierna elongacja sadzonek ryżu zainfekowanych grzybem powodującym bakanae, może być związana z czynnikiem wydzielanym ze strzępek grzyba.
1926 r. - Elichi Kurosawa swierdził, że grzyb bakanae wydziela substancję chemiczną, która stymuluje wydłużanie pędów, hamuje powstawanie chlorofilu i hamuje wzrost korzeni.
1930 r. - zmiana nomenklatury grzyba Fusarium moniliforme -> Sheldon -> Gibberella fujikuroi (nazwa nadana przez H.W. Wollenwebera.
1934 r. - Tijiro Yabuta podejmuje prace na wyodrębnianie aktywnego składnika przy użyciu szczepów grzybiczych dostarczonych przez Kurosawa. W 1934 roku Yabuta izoluje krystaliczny związek z przesączu hodowli grzyba, który hamuje wzrost siewek ryżu we wszystkich badanych stężeniach. Inhibitorem tym okazał się kwas fusarowy. Z kolei związek powodujący elongację sadzonek ryżu nazwany został Gibereliną (pierwsze użycie terminu "Gibereliny" w literaturze naukowej).
1938 r. - Yabuta i jego współpracownik Yusuke Sumiki wykrystalizowali w postaci jasnożółtego ciała stałego GIBERELINĘ A i GIBERELINĘ B (nazwy były następnie zamienione miejscami w 1931 roku; gibereliny A okazały się ponadto nieaktywne). Nie można było określić struktury gibereliny, ponieważ próbka nie była czysta i stanowiła mieszankę strukturalnie pokrewnych giberelin.
1950 r. - po zakończeniu II Wojny Światowej rozpoczynają się badania nad Giberelinami w Stanach Zjednoczonych, prowadzone przez jednostkę badawczą na Camp Dietrick, Maryland. W 1950 roku John E. Mitchell podał procedury optymalnej fermentacji dla grzybów, jak również działanie ekstraktów z grzybów na wzrost fasoli (Vicia faba) - (Mitchell i angel 1951). Prace rozpoczęły się rownież w Regionalnych Laboratoriach Badawczych w Peoria, Illnois w USA przy użyciu szczepu dostarczonego przez Mitchella. Fermentacje w skali masowej przeprowadzono w celu otrzymania czystej gibereliny A do zastosowań rolniczych, lecz nie były one aktywne (Gibereliny to produkt uboczny metabolizmu grzybów Gibberella fujikuroi; fermentacja = proces metaboliczny).
1950 r. - Pierwsze przypuszczenia co do tego, że gibereliny mogą występować u roślin wyższych.
1951 r. - Sumiki odwiedził Stany Zjednoczone i spotkał Franka H. Stodola. Po powrocie do Japonii wysłał nowe kultury do USA, ale one również okazały się nieaktywne. Problem ten wywodzi się z braku magnezu w pożywce hodowlanej. Uzupełniono ją siarczanem magnezu. Właściwości fizyczne giberelin pochodzących z tych fermentacji były zaskakująco różne od tych pochodzących z fermentacji przeprowadzanych przez Japończyków i w związku z tym nazwano je gibereliny-x (Stodoli i wsp. 1955).
1954 r. - Wielka Brytania: Philip Curtis, Brian Cross, John Grove, Jake Macmilian, Paddy Mulholland - Akers Research Laboratories (ICI) - izolacja nowej gibereliny - "kwasu giberelinowego" o nowych właściwościach. Okazało się, że ma identyczne właściwości chemiczne i fizyczne, co giberelina-x, więc nazwa kwas giberelinowy została przyjęta jako wspólna dla obu grup.
1956 r. - Ustalenie struktury kwasu giberelinowego, później ulegającej zmianom.
1955 r. - członkom grupy Sumuki (Takahashi i in.) udało się rozdzielić ester metylowy gibereliny A do trzech części, z których uzyskano wolne kwasy i gibereliny A1, A2, A3. Giberelina A3 okazała się identyczna z kwasem giberelinowym.
1957 r. - Takahashi i wsp. wyizolowali nową giberelinę A4 jako drugorzędny składnik z przesączu hodowli.
1958, 1959, 1960, 1962 - Margaret Radley w ICL w Wielkiej Brytanii wykazała obecność giberelin u roślin wyższych przy użyciu technik, które zostały użyte do izolowania gibereliny z grzyba.
Phinney Bernard: wykorzystanie karłowatych mutantów kukurydzy w celu zbadania aktywności gibereliny na roślinach.
Izolacja krystalicznej gibereliny A1, A5, A6, A8 z fasoli (Phaseolus multiforus) (MacMillan i in.)
1960 r. - Gwałtowny wzrost liczby zgłaszanych giberelin w literaturze wyizolowanych z grzybów i roślin.
1968 r. J. MacMillan i N. Takahashi osiągnęły porozumienie, że wszystkie gibereliny powinny być przypisane numery jak gibereliny A1-X, niezależnie od ich pochodzenia. W ciągu ostatnich 20 lat z wykorzystaniem nowoczesnych technik analitycznych wiele giberelin został dodatkowo zmodyfikowanych. Obecnie jest ich 126.
Gibereliny from kaleksander
Wszystkie GA oznaczone są numerami ("giberelina A numer"), które zostały im nadane w porządku chronologicznym w zależności od czasu identyfikacji. W chwili obecnej znanych jest 136 w pełni scharakteryzowanych cząsteczek GA1-GA136). 128 z nich zostało zidentyfikowany u różnych gatunków roślin naczyniowych, natomiast osiem pozostałych u bakterii i grzybów.
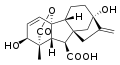
GA to tetracykliczne, diterpenoidowe [terpenoidy to grupa związków organicznych, będących pochodnymi terpenów zawierające dodatkowe grupy funkcyjne, np. grupę hydroksylową, karbonylową czy też karboksylową. Terpeny (izoprenoidy) zaś to organiczne związki chemiczne o wzorze ogólnym (C5H8)n, których główny szkielet powstał w wyniku połączenia pięciowęglowych jednostek izoprenowych, dlatego liczba atomów węgla w cząsteczce terpenów jest podzielna przez pięć] kwasy karboksylowe, których struktura bazuje na szkielecie węglowym ent-giberelanu. Wyróżniamy GA o rdzeniu zbudowanym z dziewiętnastu (C19-GA) i dwudziestu (C20-GA) atomów węgla. C20-GA posiadają przy czwartym atomie węgla grupę karboksylową, natomiast w przypadku C19-GA pomiędzy czwartym i dziesiątym atomem węgla zawsze powstaje wiązanie laktonowe, a czasami pomiędzy dziewiątym i piętnastym atomem węgla tworzy się również dodatkowy pierścień cyklopropanowy. Zarówno pozycja, jak i stereochemia wszystkich wymienionych podstawników jest niezwykle istotna ponieważ wpływa na aktywność biologiczną poszczególnych cząsteczek hormonu.
Pomimo dużej liczby cząsteczek GA, tylko kilka, GA1, GA3, GA4 i GA7, wykazuje aktywność biologiczną i bierze czynny udział w regulacji procesów fizjologicznych. Pozostałe występują w tkankach jako ich prekursory lub dezaktywowane metabolity. Aktywne cząsteczki C19-GA charakteryzują się tym, że posiadają grupę 3beta-hydroksylową przy trzecim atomie węgla, grupę karboksylową przy szóstym atomie węgla oraz wspomniany wcześniej lakton pomiędzy czwartym i dziesiątym atomem węgla. Grupa 3beta-hydroksylowa może być w niektórych przypadkach przesunięta pomiędzy drugi i trzeci atom węgla tworząc podwójne wiązanie, tak jak ma to miejsce w cząsteczkach GA5 i GA6. W zwiazku z tym wymienione GA mogą również funkcjonować jako bioaktywne cząsteczki.
Obecnie wiadomo, że u modelowej rośliny dnia długiego rzodkiewnika (Arabidopsis thaliana), oraz wielu roślin z rodziny dyniowatych (Cucurbitaceae) istotną rolę odgrywa również GA4. Różnica w budowie pomiędzy tymi dwiema GA polega na obecności (GA1) lub braku (GA4) grupy hydroksylowej przy trzynastym atomie węgla dołączanej przy udziale domniemanej 13-oksydazy giberelinowej (GA13ox), której identyfikacja umożliwiłaby wyjaśnienie potencjalnej różnicy w ich funkcjonowaniu. Zidentyfikowanie u ryżu rozpuszczalnego receptora giberelin GID1 (ang. gibberellun insensitive dwarf) oraz jego homologów u rzodkiewnika uzmysłowiło wielu badaczom, że różnice występujące pomiędz wyżej wymienionymi aktywnymi GA wynikać mogą z ich odmiennego powinowactwa do receptora, jak i zdolności do tworzenia kompleksu pomiędzy GA, GID1 i białkami DELLA, będącymi głównymi represorami w szlaku przekazywania sygnału giberelinowego. Inna aktywna giberelina A3, zwana kwasem giberelowym, została zidentyfikowana u 45 gatunków roślin, ale uważana jest za główną GA występują u grzybów (m.in. u Gibberella fujukuroi), skąd jest pozyskiwana w celach komercyjnych.
MONOTERPENY - C10
DITERPENY - C20 (TETRAMERY IZOPRENU C5*4=C20)
 |
| Źródło: Wikipedia. Kwas giberelinowy to przykład diterpenu. |
TETRATERPENY - C40
TŁO:
Sadzonki ryżu, zbyt wysoki wzrost
1930 r. - Hiperelogancję powodują gibberelliny
1950 r. - Rośliny produkują własne gibberelliny.
EFEKTY DZIAŁANIA GIBERELIN:
Wpływ na elongację pędu:
- produkowana w młodych liściach i korzeniach,
- współpraca z auksynami,
>stymulacja wydłużania komórek i ich podziałów
- współpraca z auksynami,
- aktywacja enzymów -> stymulacja produkcji ekspansyn
PRZYKŁAD (EX.) - KUKURYDZA
- karłowata kukurydza -> aplikacja GA -> rośnie tak wysoka jak normalna
- normalnego wzrostu kukurydza -> aplikacja GA -> brak odpowiedzi
WZROST OWOCÓW:
- współpraca z auksynami,
KIEŁKOWANIE NASION:
PRZYKŁAD: NASIONA JĘCZMIENIA
IMBIBICJA (NASIONO ABSORBUJE H20, AKTYWACJA) -> zarodek wydziela GA -> sygnał do warstwy aleuronowej w endospermie -> odpowiedź warstwy aleuronowej, sekrecja enz degradujących skrobię -> produkcja alfa-amylazy -> rozciąganie endospermu -> mobilizacja dostaw glukozy do wzrostu nasion
*Ekspansyny - grupa białek o masie 29-30 kDa, obecnych w ścianie komórkowej roślin, odpowiedzialnych za wzrost komórki roślinnej związany z rozluźnieniem struktury ściany komórkowej. Wyróżniane są cztery rodziny ekspansyn: alfa-ekspansyny, beta-ekspansyny, ekspansyny typu A i ekspansyny typu B. Ekspansyny alfa i beta mają wykazaną doświadczalnie zdolność rozluźniania ścian komórkowych. Pozostałe dwie rodziny został poznane jedynie jako sekwencje genów. Zwykle cząsteczka ekspansyny składa się z 250-275 reszt aminokwasowych tworzących dwie domeny. Ekspasyny zostały zidentyfikowane jako czynnik odpowiedzialny za wzrost objętościowy komórek, tzw. wzrost kwasowy. Najwyższą aktywność biologiczną ekspansyny wykazują przy niskim pH. Wzrost kwasowy indukowany jest przez auksyny, które powodują zarówno obniżenie pH apoplastu, jak i rozluźnienie struktury ściany komórkowej. Rozciągnięcie ściany komórkowej następuje pod wpływem turgoru po jej roxluźnieniu przez ekspansyny. Rola ekspansyn we wzroście kwasowym została potwierdzona przy wykorzystaniu roślin modyfikowanych genetycznie w doświadczeniach, polegających na wprowadzeniu dodatkowego genu ekspansyny, co prowadzi do wzmożenia wzrostu lub wyciszeniu genów komórki co skutkuje zahamowaniem wzrostu rosliny. Poza wzrostem objętościowym komórki ekspansyny uczestniczą w procesie mięknięcia owoców, odccinanie liści, kiełkowania nasion, wzrostu łagiewki pyłkowej, formowania ksylemu, tworzenia połączenia korzeni z organizmem grzyba w mikoryzie, formowaniu się brodawek korzeniowych tak zwanym zmartwychwstaniu Craterostigma plantagineum po wysuszeniu tkanek wegetatywnych. Mogą one również stanowić cząstkę sygnałową dla roślin pasożytniczych.
KWAS GIBERELINOWY:
 Kwas giberelinowy (GA3) to wielofunkcyjny, wielopierścieniowy związek organiczny. Nie stwierdzono jego obecności w tkankach roślinnych, ale wykazuje działanie hormonu roślinnego. Został wyizolowany w skrystalizowanej postaci przez badaczy japońskich T. Yabutę i T. Sumiki w 1938 roku jako uboczny metabolit grzybowego patogenu roślinnego Gibberella fujikuroi powodującego nadmierny wzrost rośliny. Pierwotny produkt okazał się mieszaniną trzech związków.
Kwas giberelinowy (GA3) to wielofunkcyjny, wielopierścieniowy związek organiczny. Nie stwierdzono jego obecności w tkankach roślinnych, ale wykazuje działanie hormonu roślinnego. Został wyizolowany w skrystalizowanej postaci przez badaczy japońskich T. Yabutę i T. Sumiki w 1938 roku jako uboczny metabolit grzybowego patogenu roślinnego Gibberella fujikuroi powodującego nadmierny wzrost rośliny. Pierwotny produkt okazał się mieszaniną trzech związków.
*Gibberella fujikuroi - jest to gatunek workowców należący do rodziny gruzełkowatych (Nectriaceae). Gatunek ten jest szeroko rozprzestrzeniony na całym świecie. Występuje w glebie oraz na porażonych roślinach i nasionach. Wywołuje choroby zwane fuzariozami.
HISTORIA ODKRYCIA GIBERELIN: W latach 20. i 30. XX wieku biolog japoński - Elichi Kurosawa prowadził badania nad chorobą ryżu, którego siewki bardzo szybko rosły, stawały się wysokie i wysmukłe, przewracały się i ostatecznie zamierały. Przyczyną występowania tej choroby był grzyb (Gibberella fujikuroi), który wytwarzał związek nazwany gibereliną (GA). Wkrótce po zakończeniu II wojny światowej naukowcy z Europy i Ameryki Północnej zainteresowali się obserwacją dokonaną przez Japończyków. Badania prowadzone w latach 1950-1970 w Stanach Zjednoczonych oraz Wielkiej Brytanii wykazały, iż gibereliny wytwarzają również zdrowe rośliny, podobnie jak grzyb wywołujący chorobę siewek.
Główne znaczenie giberelin: Gibereliny stymulują wydłużanie łodyg wielu roślin. Wprowadzenie gibereliny do roślin, zwłaszcza niektórych odmian karłowatych, obrazuje to wyraźnie. Karłowate wysokowydajne odmiany pszenicy wykształcają krótkie łodygi, ponieważ słabiej reagują na giberelinę. Odmiany te zużywają zatem mniej składników odżywczych na wydłużanie łodyg i mogą przeznaczyć ich więcej na produkcję ziarniaków. Gibereliny są również zaangażowane w wystrzeliwaniu - szybkim wydłużaniu się szypułek kwiatowych, częstym u roślin w okresie kwitnienia.
DZIAŁANIE GIBERELIN (przykłady):
 Kwas giberelinowy (GA3) to wielofunkcyjny, wielopierścieniowy związek organiczny. Nie stwierdzono jego obecności w tkankach roślinnych, ale wykazuje działanie hormonu roślinnego. Został wyizolowany w skrystalizowanej postaci przez badaczy japońskich T. Yabutę i T. Sumiki w 1938 roku jako uboczny metabolit grzybowego patogenu roślinnego Gibberella fujikuroi powodującego nadmierny wzrost rośliny. Pierwotny produkt okazał się mieszaniną trzech związków.
Kwas giberelinowy (GA3) to wielofunkcyjny, wielopierścieniowy związek organiczny. Nie stwierdzono jego obecności w tkankach roślinnych, ale wykazuje działanie hormonu roślinnego. Został wyizolowany w skrystalizowanej postaci przez badaczy japońskich T. Yabutę i T. Sumiki w 1938 roku jako uboczny metabolit grzybowego patogenu roślinnego Gibberella fujikuroi powodującego nadmierny wzrost rośliny. Pierwotny produkt okazał się mieszaniną trzech związków. *Gibberella fujikuroi - jest to gatunek workowców należący do rodziny gruzełkowatych (Nectriaceae). Gatunek ten jest szeroko rozprzestrzeniony na całym świecie. Występuje w glebie oraz na porażonych roślinach i nasionach. Wywołuje choroby zwane fuzariozami.
HISTORIA ODKRYCIA GIBERELIN: W latach 20. i 30. XX wieku biolog japoński - Elichi Kurosawa prowadził badania nad chorobą ryżu, którego siewki bardzo szybko rosły, stawały się wysokie i wysmukłe, przewracały się i ostatecznie zamierały. Przyczyną występowania tej choroby był grzyb (Gibberella fujikuroi), który wytwarzał związek nazwany gibereliną (GA). Wkrótce po zakończeniu II wojny światowej naukowcy z Europy i Ameryki Północnej zainteresowali się obserwacją dokonaną przez Japończyków. Badania prowadzone w latach 1950-1970 w Stanach Zjednoczonych oraz Wielkiej Brytanii wykazały, iż gibereliny wytwarzają również zdrowe rośliny, podobnie jak grzyb wywołujący chorobę siewek.
 |
Źródło: agriskmanagementforum.org - Choroba ryżu - -"Bakanae
infection", której przyczyną jest wytwarzanie nadmiernej ilości
gibereliny przez grzyba Gibberella fujikuroi.
|
DZIAŁANIE GIBERELIN (przykłady):
- STYMULACJA TRAWIENIA BIELMA W ZIARNACH ZBÓŻ: najlepiej poznanym efektem działania giberelin jest stymulacja produkcji alfa-amylazy w nasionach zbóż. W wyjaśnieniu przyspieszania kiełkowania zbóż przez gibereliny pomocna była wiedza o tym, że z warstwy aleuronowej wydzielane są enzymy degradujące skrobię tylko w obecności zarodka. Zarodek może być zastąpiony przez podanie kwasu giberelinowego. To właśnie gibereliny wydzielane przez zarodek stymulują trawienie bielma. Dalsze badania wykazały, iż giberelina zwiększa poziom mRNA dla alfa-amylazy poprzez stymulację transkrypcji. Przypuszcza się, że w stymulacji transkrypcji przez gibereliny uczestniczą białka związane z DNA.
- WPŁYW NA WZROST WYDŁUŻENIOWY: Innym przykładem działania giberelin jest wpływ na wzrost wydłużeniowy pędu. Mechanizm działania giberelin w tym przypadku polega prawdopodobnie na zwiększaniu plastyczności ścian komórkowych. Przypuszcza się, że gibereliny poprzez hamowanie aktywności peroksydaz zapobiegają reakcjom, które powodują usztywnianie ścian komórkowych. Usztywnianie to następuje w wyniku wbudowania komponentów fenolowych w ścianę komórkową, takich jak np. kwas ferulowy. Kwas giberelinowy stymuluje poziom mRNA enzymu beta-1-3-glukanazy, hydrolizującego jeden z głównych polisacharydów ściany komórkowej bielma jęczmienia. Możliwe jest również indukowanie wzrostu przez zmanę poziomu wapnia w tkance. Jony Ca2+ hamują wzrost hipokotyli sałąty a zjawisko to może być odwrócone przez giberelinę.
- UDZIAŁ W WYCHODZENIU NASION ZE STANU SPOCZYNKU: Gibereliny biorą również udział w procesie wychodzenia nasion ze stanu spoczynku. Ustępowanie stanu głębokiego spoczynku podczas stratyfikacji w niskiej temperaturze przebiega w końcowym etapie równocześnie ze zwiększeniem się poziomu giberelin uwalnianych zarówno z form związanych, jak i pochodzących z biosyntezy. Aktywny udział giberelin w tym procesie został potwierdzony przez ich podawanie egzogennie.
- UDZIAŁ W PROCESIE ROZMNAŻANIA ROŚLIN: w kwiatach, gdzie głównym źródłem giberelin są pręciki hormon ten zapewnia żywotność pyłku, a nawet, po zapłodnieniu żywotność zygoty. Gwałtowny wzrost łagiewki pyłkowej jak również zapłodnienie jest pod kontrolą giberelin. Gibereliny wpływają również na płeć kwiatów, szczególnie roślin rozdzielnopłciowych. Wysoki poziom giberelin w tkankach lub dostarczenie ich z zewnątrz sprzyja tworzeniu się kwiatów męskich, czemu towarzyszy zwykle intensywny wzrost wegetatywny. Roślinami u których obserwowano takie działanie giberelin są: morwa, topola, klon oraz ogórek. U roślin które występują w formie juwenilnej i dojrzałej (często mają one różny kształt liści) mogą się one przekształcać jedna w drugą pod wpływem giberelin zależnie od gatunku rośliny. U Hedera helix (Bluszcz pospolity) GA3 może powodować powrót formy dojrzałej do juwenilnej, zaś wiele drzew szpilkowych przechodzi w fazę generatywną po podaniu niepolarnych giberelin takich jak GA4+GA7.
- UDZIAŁ W INDUKCJI KWITNIENIA: Gibereliny biorą również udział w indukowaniu kwitnienia roślin. Mogą one zastępować działanie światła lub niskiej temperatury u roślin wymagających dla kwitnienia długiego dnia lub chłodzenia. Podczas indukcji kwitnienia zmienia isę w roślinie zarówno ilość endogennych giberelin, jak i ich rodzaj. Retardanty (antygibereliny - grupa syntetycznych regulatorów wzrostu i rozwoju roślin o różnej budowie chemicznej, których wspólną cechą jest hamowanie wzrostu roślin wyższych, dlatego znalazły zastosowanie w rolnictwie oraz ogrodnictwie do ograniczania długości pędów bez jednoczesnego obniżania produktywności uprawy) mogą hamować indukcję kwitnienia poprzez obniżenie poziomu giberelin i ograniczenie ich metabolizmu. W warunkach niesprzyjającego fotoperiodu, nie dochodzi do biosyntezy giberelin i rośliny dnia długiego nie zakwitają, zaś rośliny dnia krótkiego pozostają w stanie rozety. W przypadku indukcji kwitnienia u poszczególnych gatunków roślin musi zadziałać określona giberelina, w określonym stężeniu. Rośliny dnia długiego wykazują istotną zależność od giberelin o szkielecie dziewiętnastowęglowym z grupą hydroksylową przy atomie węgla dwunastym, trzynastym i piętnastym. Również czas i miejsce stosowania gibereliny może mieć znaczenie dla indukcji kwitnienia. W przypadku roślin dnia krótkiego, GA1 podana przed indukcją stymuluje kwitnienie, ale zastosowana tuż po indukcji działa hamująco. Szczególną cechą giberelin indukujących kwitnienie roślin, jest ich minimalny efekt na wydłużanie się pędów. Gibereliny bardzo skuteczne w pobudzaniu wzrostu wydłużeniowego muszą być stosowane w bardzo wysokich dawkach, aby wywołać kwitnienie. Wśród wielu giberelin obecnych w roślinie jest tylko jedna, nazywana "efektorem" jest aktywna w danym procesie. Pozostałe gibereliny to najczęściej nieaktywne ogniwa w łańcuchu biosyntezy lub produkty unieczynnienia efektora. Przykładem efektora stymulacji kwitnienia u jabłoni jest GA4. Równocześnie obecne w jabłoni gibereliny GA3, GA19, GA20, GA53 są wcześniejszymi ogniwami w biosyntezie GA4, a gibereliny GA7 i GA9 są produktami degradacji aktywnej gibereliny GA4.
FORMY WYSTĘPOWANIA GIBERELIN: Znane są trzy chemicznie różne formy występowania giberelin w roślinach i są to:
a) wolne związki (ekstrahowane najczęściej alkoholem i octanem etylu);
b) kompleksy typu glikozydów lub estrów glikozydowych.
c) gibereliny związane z białkiem (rozpuszczalne w wodzie i ekstrahowane butanolem)
Rola giberelin związanych w kompleksach typu glikozydów lub estrów glikozydowych nie jest do końca wyjaśniona. Wyższa polarność giberelin połączonych z cukrami może umożliwiać magazynowanie tych związków w wakuoli. Jedną z funkcji glikozydów i estrów zawierających gibereliny jest udział tych związków w transporcie giberelin w tkankach przewodzących. Możliwe jest również, iż związane formy gibereliny ułatwiają transport między przedziałami komórki oraz przemieszczanie giberelin przez ścianę komórkową. Zapewne związane z cukrem gibereliny stanowią również formę zapasową. Kompleksy typu glikozydów mogą być rozkładane podczas kiełkowania i mogą być źródłem giberelin jeszcze przed syntezą de novo giberelin. Jednak nie wszystkie związki giberelin z cukrami są biologicznie aktywne. Związki biologicznie nieaktywne mogą brać udział w procesach katabolicznych prowadzących do rozkładu giberelin i być jednocześnie pierwszym ogniwem dezaktywacji giberelin. Łatwość powstawania kompleksów giberelina-cukier oraz łatwość jego hydrolizy może umożliwiać regulację puli wolnych giberelin. Przechodzenie form związanych w wolne gibereliny i odwrotnie obserwowano np. u siewek kukurydzy. Wykazano występowanie giberelin w połączeniu z białkami cytozolu hypokotyla ogórka i grochu. Wyizolowano także z jądra komórkowego siewek fasoli białka o masie 80-100 kDa. Dodanie tych białek do preparatu jądrowego zwiększało około dwukrotnie aktywność transkrypcyjną. Białka łączące się z gibereliną w tych przypadkach mają prawdopodobnie charakter receptora.
Wyniki badań z zastosowaniem egzogennych giberelin wykazały, iż hormony te wpływają w różny sposóļ na kwitnienie roślin dnia długiego oraz roślin dnia krótkiego. U Arabidopsis, jak i u innych roślin dnia długiego, gibereliny pełnia rolę stymulatorów kwitnienia. U roślin rozetowych i niektórych roślin dnia długiego egzogenne gibereliny są nawet w stanie zastąpić długi, indukcyjny fotoperiod. U wielu roślin dnia krótkiego, uprawianych w nieindukcyjnych warunkach krótkiej nocy, aplikacja gibereliny opóźnia bąd hamuje kwitnienie. Jednakże u Pahbitis nil (modelowej rośliny dnia krótkiego) uprawianej w warunkach podindukcyjnych, gibereliny stymulują tworzenie pąków kwiatowych. Zatem obserwowane efekty aplikacji giberelin u roślin krótkodniowych nie są jednoznaczne, zalezą od gatunku rośliny oraz czasu i miejsca aplikacji hormonów. Ponieważ u niektórych roślin dnia długiego, jak np. u Lolium temulentum, indukcja fotoperiodyczna wpływając na geny 20-ksydazy giberelinowej, prowadzi do wzrostu poziomu giberelin w liściach, a następnie ich transportu do wierzchołka wzrostu pędu, gdzie następuje ewokacja i morfogeneza kwiatu w pewnym momencie historii badań nad tym procesem gibereliny były uważane za sygnał kwitnieniowy u LDP. Zsadniczy postęp w zrozumieniu roli giberelin wregulacji rozwoju generatywnego przyniosły badania molekularne U A. thaliana gibereliny uruchamiają jeden z czterech szlaków indukcji kwitnienia. Szlak giberelinowy aktywuje ekspresję genów związanych z tworzeniem kwiatów na drodze bezpośredniej poprzez aktywację genu LFY i FT lub pośrednio poprzez pozytywną regulację genu SOC1. Wydaje się, że efekty te leżą u pdostaw stymulującego wpływu giberelin na kwitnienie u roślin dnia długiego, a być może również u niektórych roślin dnia krótkiego. Prawidłowo funkcjonujący szlak przekazywania sygnału giberelinowego warunkuje jednocześnie wzrost elongacyjny pędu, który poprzeda kwitnienie u roślin rozetowych. Gibereliny biorą także udział w morfogenezie i dyferencjacji płci tworzących się kwiatów.
ROLA GIBERELIN W PROCESIE KWITNIENIA ROŚLIN:
Spośród licznej grupy giberelin zidentyfikowanych u roślin, grzybów oraz bakterii tylko nieliczne, m.in. GA1, GA3, GA4, GA5, GA6 i GA7, wykazują aktywność biologiczną, natomiast pozostałe gibereliny są prekursorami lub produktami ich katabolizmu. Wszystkie gibereliny pochodzą od aldehydu GA12, a kluczowym enzymami zaangażowanymi w regulację ich biosyntezy i utrzymanie homeostazy w roślinie są: 20-oksydaza giberelinowa (GA20ox), 3-oksydaza giberelinowa (GA3ox) i 2-oksydaza giberelinowa (GA2ox). Szlak sygnałowy giberelin reguluje procesy rozwojowe poprzez inicjację degradacji białek DELLA, które należą do nadrodziny roślinnych regulatorów transkrypcji GRAS. Percepcja giberelin jest możliwa dzięki zlokalizowanemu na terenie jądra komórkowego białku receptorowemu GID1 (ang. GIBBE-RELLIN INSENSITIVE DWARF1), pierwotnie zidentyfikowanemu u ryżu. Z kolei u A. thaliana zidentyfikowano trzy geny - AtGID1a, AtGID1b i AtGID1c, których białkowe produkty pełnią podobną funkcję jak GID1 u ryżu. Przyłączenie giberelin do GID1 powoduje zmianę konformacyjną receptora, pozwalającą na interakcje z N-końcową domeną białek DELLA. U A. thaliana zidentyfikowano pięć białek DELLA (ang. gainsensitive, GAI; repressor of GA1-3, RGA; RGA-like, RGL1, RGL2, RGL3), a spośród nich jedynie RGA, RGL1 i RGL2 są zaangażowane w hamowanie indukcji kwitnienia i rozwój kwiatu. Kompleks GA-GID1 wiążąc białka DELLA powoduje zmiany konfomacyjne pozwalające na łączenie z elementem F-box ligazy ubikwityny SCF E3, wyznaczając je do degradacji w proteasomie 26S. W skład kompleksu ligazy ubikwityny SCF u A. thaliana wchodzą białka zawierające domenę F-box: SLY1 (ang SLEEPY1) oraz jego homolog SNE (ang. SNE-EZY). Proteolityczna degradacja białek DELLA prowadzi do uwolnienia czynników transkrypcyjnych, które wpływają na ich geny docelowe. Należy także zaznaczyć, że białka DELLA, mimo braku wyraźnej domeny oddziałującej z DNA, mogą bezpośrednio wpływać na ekspresję genów, tak jak inne białka z nadrodziny GRAS i w tych przypadkach działają jako aktywatory transkrypcji.
KOMPETENCJA ROŚLIN DO KWITNIENIA: Gdy wierzchołek wzrostu pędu jest zdolny reagować na zewnętrzne lub wewnętrzne czynniki indukujące kwitnienie, wówczas roślina uzyskuje stan kompetencji do kwitnienia. Osiągnięciu tego stanu towarzyszą zjawiska zachodzące w wierzchołku wzrostu pędu, obejmujące przemiany o podłożu genetycznym, subkomórkowym i komórkowym. Dochodzi także do zmian hormonalnych, zwiększa się ilość giberelin, poliamin i cytokinin. Substancje te stymulują aktywność mitotyczną w strefie centralnej, regionie subapikalnym i strefie peryferycznej merystemów. Prowadzi to do przeorganizowania wierzchołka wzrostu pędu w tworzeniu tworzenia zawiązków kwiatów lub kwiatostanów. U A. thaliana merystem wegetatywny przekształca się najpierw w merystem kwiatostanowy, z którego poprzez różnicowanie komórek w peryferycznej strefie wykształcony zostaje merystem kwiatowy. Rozróżnienia pomiędzy różnymi typami merystemów istnieją nie tylko na poziomie morfologicznym, ale również molekularnym, i dotyczącą zarówno przestrzennego, jak i czasowego zróżnicowania w regulacji ekspresji genów odpowiedzialnych za tożsamość merystemu oraz genów determinujących rozwój organów kwiatowych. U A. thaliana zmiana merystemu wegetatywnego na merystem kwiatostanowy skorelowana jest z ekspresją genów SOC1 (ang. SUPPRESSOR OF OVEREXPRESSION OF CONSTANS1), SVP (ang. SHORT VEGATATIVE PHASE) i AGL24 (ang. AGAMOUS LIKE 24), a powstawanie merystemu kwiatowego jest promowane przez aktywność genów LFY (ang. LEAFY), AP1 (ang. APETALA1) i CAL (ang. CAULIFLOWER).
Jednocześnie LFY i AP1 hamują aktywność genów odpowiedzialnych za powstawanie merystemu kwiatostanowego. Podczas gdy raz wykształcony merystem kwiatostanowy daje początek nowym bocznym merystemom, działalność merystemu kwiatowego kończy się wraz z wykształceniem organów kwiatowych.
Gibereliny pełnią funkcję integratora między bodźcami środowiskowymi a indukowanymi przez nie zmianami fizjologicznymi, poprzedzającymi przechodzenie rośliny w kolejną fazę rozwoju. U roślin rozetowych kwitnienie jest konsekwencją wydłużania się pędu, a proces ten jest następstwem regulowanych przez gibereliny podziałów i wzrostu elongacyjnego komórek. U A. thaliana istotnym czynnikiem regulującym wzrost elongacyjny pędu jest występujący w łodydze paralog 20-oksydazy giberelinowej - AtGA - 20ox1. Mutanty z zaburzoną biosyntezą lub szlakiem sygnałowym giberelin, mimo zastosowania odpowiednich fotoperiodycznych warunków uprawy, charakteryzują się ograniczonym wzrostem elongacyjnym. Podczas gdy u wielu gatunków roślin dwuletnich stan kompetencji ejst bezwzględnie uwarunkowany wzrostem elongacyjnym pędu i zawsze kończy się kwitnieniem, u niektórych roślin monokarpicznych (kwitnących raz w ontogenezie) stymulacja wydłużania międzywęźli jest jedynie oznaką gotowości rośliny do przejścia w fazę rozwoju reprodukcyjnego. U niektórych LDP przeniesienie z nieindukcyjnych warunków dnia krótkiego w indukcyjne warunki dnia długiego prowadzi do wzrostu poziomu bioaktywnych giberelin w werzchołku wzrostu pędu i często jest skorelowane z ekspresją genu GA20ox. Wyniki badań prowadzonych u szpinaku wskazują, że poziom transkryptu SoGA20ox1 i kodowanego przez niego białka wzrasta w liściach i werzchołku wzrostu pędu, jednak obserwowane zmiany są zbyt powolne, by tłumaczyć nimi szybki wzrost elongacyjny. Jest więc prawdopodobne, że u tej rośliny wzrost wydłużeniowy pędu zależy raczej od szybkiego transportu aktywnegj gibereliny lub jej prekursora do części subapikalnej merystemu wierzchołkowego i nie jest bezpośrednio związane z ekspresją 20-oksydazy giberelinowej w samym wierzchołku.
INDUKCJA KWITNIENIA: Egzogenne gibereliny indukują kwitnienie u wielu rozetowych roślin dnia długiego i niektórych gatunków roślin dwuletnich, rosnących w warunkach nieindukcyjnych. Uważano zatem, że hormony te są uniwersalnym sygnałem kwitnieniowym, który po przetransportowaniu floemem do wierzchołka wzrostu pędu, uruchamia różnicowanie generatywne. Ponieważ okazało się, że u wielu gatunków roślin dnia krótkiego, a także dnia długiego i neutralneych, gibereliny nie tylko nie zwiększają liczby pąków kwiatowych wytwarzanych przez rośliny, ale nawet u niektórych hamują te proces, hipoteza ta stała się mało prawdopodobna. Wyniki badań molekularnych wykazały natomiast, że jednym z elementów fotoperiodycznego szlaku indukcji kwitnienia i jednocześnie nowym kandydatem na mobilny sygnał kwitnienia jest u A. thaliana białko FT, natomiast u rośliny dnia krótkiego (ryżu) jego homolog - Hd3a. Białko FT powstaje w komórkach towarzyszących floem liści i jest transportowane do wierzchołka wzrostu pędu, gdzie wiążąc się z czynnikiem transkrypcyjnym FD (ang. flowering locus D), powoduje aktywację genów tożsamości merystemu kwiatowego. Chociaż wykluczono rolę giberelin jako uniwersalnego sygnału i stymulatora kwitnienia, to jednak badania prowadzone zarówno na roślinach dnia długiego, jak i roślinach dnia krótkiego wskazują na udział tych hormonów w mechanizmie indukcji kwitnienia. U wielu roślin dnia krótkiego poddanych indukcji egzogenna giberelina opóźni alub całkowicie hamuj ekwitnienia. Z drugiej strony, kwas giberelowy (GA3), aplikowany na liścienie siewek Pharbitis nil (obligatoryjnej SDP), poddanych niepełnej indukcji kwitnienia (12-godzinna noc), nie tylko zwiększa liczbę pąków generatywnych wytwarzanych przez rośliny, ale także przyspiesza czas ich formowania. Zatem, obserwowany efekt wpływu giberelin na indukcję kwitnienia u SDPS nie jest jednoznaczny, zależy prawdopodobnie od gatunku rośliny oraz czasu i miejsca aplikacji hormonu. Poziom endogennych giberelin w soku floemowym, uzyskanym z indukowanych do kwitnienia P. nul, jest wyższy niż w soku floemowym, pozyskanym z roślin wegetatywnych. Nie wiadomo, czy obserwowany wzrost poziomu giberelin po indukcyjnej ciemności ma istotne znaczenie dla indukcji kwitnienia P. nil. Faktem jest, że podanie chlorku chlorocholiny (CCC), inhibitora biosyntezy giberelin, roślinom poddanym pełnej indukcji, hamuje kwitnienie, a efekt ten jest odwracany przez zastosowanie egzogennej gibereliny. Badania z użyciem znakowanych standardów giberelin wskazują, że światło jest jednym z czynników wpływających na transport tych związków z liścieni do epikotyla (części nadliścieniowej). W siewkach pozbawionych liścieni i traktowanych na wierzchołki wzrostu gibereliną obserwowano stymulację kwitnienia. Stąd postulat, że główną rolą tych hormonów jest ich udział w mechanizmie ewokacji i morfogenezy kwiatów. Potwierdzają to badania molekularna prowadzone na A. thaliana, których wyniki wskazują, że gibereliny są bezpośrendio odpowiedzialne za aktywację genów tożsamości kwiatowej.
U wielu LDP (Long-Day-Plants), jak np. Samolus parviflorus oraz Rudbekia bicolor, gibereliny całkowicie zastępują w indukcji kwitnienia fotoperiod. U Lolium tumulentum indukcyjny fotopeiod wzmaga ekspresję GA-20ox w liściach, prowadząc do akumulacji indukującej kwitnienie GA5 w tych organach oraz powoduje jej transport do wierzchołka wzrostu pędu. Zastosowanie inhibitora biosyntezy giberelin przed indukującą kwitnienie nocą (tzw. nocą indukcyjną) prowadzi do obniżenia poziomu tych hormonów, czemu towarzyszy zmniejszenie liczby pąków kwiatowych wytwarzanych przez rośliny. U rodzkiewnika pospolitego, uprawianego w nieindukcyjnych warunkach dnia krótkiego, zmian awzroca różnicowania z wegetatywnego na generatywny poprzedzona jest akumulacją GA4, w wierzchołku wzrostu pędu. Podobnie jak u Lolium temulentum, proces ten nie jest skorelowany e zmianą ekspresji genów biosyntezy giberelin bezpośrednio w wierzchołku wzrostu pędu.
W przeciwieństwie do rzodkiewnika pospolitego (A. thaliana), u którego GA4 jest aktywnym czynnikiem regulującym zarówno wzrost elongacyjny pędu, jak i tworzenie kwiatów, u Lolium temulentum giberelinami odpowiedzialnymi za indukcję kwitnienia są GA5 i GA6, które jednak w małym stopniu wpływają na wydłużenie pędu. Z kolei gibereliny GA1 i GA4, które silnie stymulują wzrost, pojawiają się w liścieniach i wierzchołku wzrostu pędu Lolium temulentum później niż GA5, która indukuje kwitnienie. Sugeruje to, że GA1 i GA4 stymulują wydłużanie pędu i różnicowanie kwiatostanu wtedy, gdy dojdzie już do indukcji kwitnienia. To zróżnicowane działanie giberelin może wynikać z odmiennego tempa inaktywacji poszczególnych giberelin. U Lolium temulentum - GA5 jest chroniona przed szybką hydroksylacją podwójnym wiązanie, a GA1 i GA4 są wolniej metabolizowane w wierzchołku pędu. Dodatkowo, 2-oksydaza giberelinowa, katalizująca inaktywację giberelin, ulega ekspresji poniżej merystemu wierzchołkowego pędu i ogranicza transport bioaktywnych giberelin do wierzchołka. Taką rolę oksydazy wykazano już wcześniej dla ryżu, u którego ekspresja GA2ox poniżej merystemu wierzchołkowego pędu, obniża ilość bioaktywnych giberelin przedostających się do wierzchołka pędu i zmniejsza jego zdolność do zmiany wzorca różnicowania. Kiedy okazało się, że wzór ekspresji GA2ox u A. thaliana jest porównywalny do tego, który występuje u ryżu, stało się wątpliwe, czy zmianę ekspresji tego genu łączyć można z indukcją kwitnienia. Jednakże utrata ekspresji AtGA2ox4 u A. thaliana przyspiesza czas kwitnienia, szczególnie u roślin uprawianych w nieindukcyjnych warunkach dnia krótkiego. Ekspresja tego paralogu jest głównie ograniczona do wierzchoka wzrostu pędu, podczas gdy większość pozostałych AtGA2ox ulega ekspresji także poza nim.
U A. thaliana gibereliny aktywują odpowiedzialne za regulację czasu kwitnienia geny integratorowe szlaków indukcji kwitnienia LFY i SOC1. Gen LFY integruje sygnały pochodzące ze szlaku giberelinowego i fotoperiodycznego, podczas gdy SOC1 integruje szlak giberelinowy, autonomiczny i wernalizacyjny. Białkowe produkty LFY i SOC1 indukują ekspresję kolejnych genów zaangażowanych bezpośrednio w rozwój kwiatu (ang. APETALA, AP1, AP2, AP3, PISTILLATA, PI, AGAMOUS, AG). U A. thaliana wywołane giberelinami wydłużanie pędu, poprzedza fotoperiodyczną indukcję kwitnienia, w której kluczową rolę odgrywa gen CO (ang. CONSTANS). Białkowy produkt CO indukuje ekspresję genu integratorowego FT. Badania prowadzone na A. thaliana wykazały, że gibereliny mogą indukować kwitnienie przez niezależną od CO aktywację genu FT. U roślin typu dzikiego oraz mutanta biosyntezy giberelin ga1-3, uprawianych w warunkach dnia długiego, egzogenna GA4 akywuje ekspresję genu FT. W warunkach dnia krótkiego, kiedy aktywność FT jest niska kwitnienie A . thaliana jest całkowicie zalężne od szlaku giberelinowego, chociaż proces ten nie musi być bezpośrednio związane z ekspresją owego genu. Wiadomo bowiem, iż u roślin uprawianych w warunkach dnia krótkiego, gibereliny tylko w niewielkim stopniu wpływają na ekspresję FT. U Lolium temulentum, bez względu na fotoperiodyczne warunki uprawy, aplkikacja egzogennej gibereliny nie zwiększa ekspresji FT. Przyczyna wykazanych rozbieżności nie jest znana. Uważa się, że gibereliny dodatkowo regulują ekspresję genu tożsamości merystemu generatywnego LFY, w zależnym od białek DELLA szlaku, w któ®ego działanie zaangażowany jest niskocząsteczkowy regulatorowy RNA miR159. Brak giberelin powoduje zmniejszenie puli miR159 regulującego ekspresję genów odpowiedzi na gibereliny (GAMYB), m.in. MYB33. Analiza fenotypowa roślin A. thaliana z nadekspresją MIR159 wykazała, że w warunkach dnia krótkiego rośliny te kwitną dużo później w porównaniu z roślinami typu dzikiego. Prawdopodobnie wiąże się to ze spadkiem poziomu transkryptu genu MYB33, który jest pozytywnym regulatorem aktywności genu LFY, bezpośrednio zaangażowanego w kontrolę kwitnienia.
ROLA GIBERELIN W PROCESIE ROZWOJU KWIATÓW:
Kwiat większości roślin okrytonasiennych złożony jest z czterech rodzajów elementów ułożonych w poszczególnych okółkach. Pierwszy okółek od zewnątrz utworzony jest przez działki, drugi przez płatki, trzeci przez pręciki, a czwarty, najbardziej wewnętrzny okółek kwiatu stanowi słupkowie. W poszczególnych okółkach kwiatu ekspresji ulegają geny odpowiedzialne za wykształcenie określonych organów kwiatowych. Do grupy pierwszej, inaczej też nazywanej klasą A, należą wykazują aktywność w okółku pierwszym i drugim, określające tożsamość działek kielicha i płatków korony, geny AP1 i 2; do grupy drugiej (B) aktywnej w okółku drugim i trzecim należą wymagane do różnicowania płatków korony i pręcików geny AP3 i PI. Aktywność genów klasy trzeciej (C) zachodzi w okółku trzecim i czwartym i jest niezbędna do różnicowania słupków oraz pręcików. Postęp badań nad molekularnymi podstawami formowania elementów kwiatowych doprowadził również do zidentyfikowania kolejnych klas genów, E i D, niezbędnych do prawidłowego rozwoju kwiatu. Szlak sygnałowy giberelin nie jest wymagany do różnicowania poszczególnych części kwiatu, ale jest podstawą do normalnego rozwoju tych organów. Podczas gdy nawet niewielki deficyt giberelin powoduje zaburzenia w rozwoju pręcików i osłabia męską płodność, mutanty skrajnego deficytu tych hormonów są żeńsko sterylne. U A. thaliana do normalnego rozwoju pręcików potrzebne są wyższe stężenia giberelin, niż do rozwoju słupków płatków i działek kielicha. Mutanty deficytu giberelin lub zaburzonego szlaku przekazywania sygnału tych hormonów charakteryzują się zahamowanym wzrostem wydłużeniowym komórek w nitce i posiadają krótkie pręciki, co uniemożliwia samozapylenie. Odpowiedni poziom giberelin jest niezbędny również do prawidłowego rozwoju pylnika. Obecność giberelin warunkuje formowanie żywotnych ziaren pyłku i otwieranie komór pyłkowych. U mutanta ga1-3, charakteryzującego się znacznym niedoborem giberelin, ziarna pyłku nie osiągają pełnej dojrzałości, a mikrosporogeneza ustaje po mejozie tuż przed mitoza. U mutantów pomidora ga-2 i gib-1 niedobór giberelin prowadzi do zahamowania mikrosporogenezy już przed mejozą. W rozwijającym się pylniku głównym miejscem syntezy giberelin jest tkanka odżywcza woreczka pyłkowego (Tapetum), którapełni ważną rolę w rozwoju pyłku. Mutanty biosyntezy i sygnałowania giberelin charakteryzują się zaburzonym rozwojem tapetum. Dochodzi u nich do przewczesnej degradacji tej tkanki i zatrzymania mikrosporogenezy. Nie jest jednak do końca jasne, czy w przypadku braku sygnałowania GA przedwczesna degradacja tapetum jest połączona z zatrzymaniem rozwoju ziaren pyłku. U A. thaliana ekspresja genów biosyntezy giberelin AtGA3ox3 i AtGA3ox4 osiąga najwyższy poziom przed poprzedzającą otwarcie komór pyłkowych degradacją tapetum i następnie spada. Wyższa zawartość giberelin pozostaje jedynie w ziarnach pyłku, aż do ich otwarcia. Ekspresja genu AtGA3ox1 zachodzi również w nitce pręcika, co wskazuje, że może być ona kolejnym miejscem biosyntezy tych hormonów. Z kolei aktywność innych paralogów 3-oksydazy giberelinowej, AtGA3ox3 i AtGA3ox4, zaobserwowano w pylniku. Jednakże we wczesnych etapach rozwoju kwiatów ekspresja genu AtCPS, którego białkowy produkt uczestniczy w początkowym etapie biosyntezy GA, zachodziła tylko w pylniku, co sugeruje, że wzros tnitki pręcikowej może wymagać pochodzącego z pylnika prekursora GA.
ROLA GIBERELIN W PROCESIE DYFERENCJACJI PŁCI KWIATÓW:
Płeć tworzących się kwiatów u roślin jedno- i dwupiennych kontrolowana jest przez interakcje hormonów. Znana jest rola endogennej równowagi auksynowo-giberelinowej w tworzeniu męskich lub żeńskich elementów kwiatów. Zastosowanie auksyn powoduje u wielu roślin niedorozwój pręcikowia ora stymulację i rzowój słupkowia, natomiast gibereliny stymulują rozwój pręcikowia.
Wpływ giberelin na dyferencjację płci tworzących się kwiatów zależy od rodzaju zastosowanej gibereliny. Traktowanie 6-letnich siewek Pseudotsuga menziesii mieszaniną GA4/7 + GA9 zwiększało tworzenie kwiatów żeńskich, natomiast dla powstawania kwiatów męskich najskuteczniejsza okazała się GA4/7.
ŹRÓDŁO: PUBLIKACJA: KOSMOS: PROBLEMY NAUK BIOLOGICZNYCH: E. Wilmowicz, K. Frankowski, P. Glazińska, M. Sidłowska, K. Marciniak ,J. Kopcewicz - "Rola giberelin w regulacji kwitnienia roślin".





Faktycznie bardzo ciekawie napisane. Czekam na więcej.
OdpowiedzUsuń