*Berylowce - są to pierwiastki chemiczne występujące w 2 (daw. IIA lub II głównej) grupie układu okresowego pierwiastków. Są to beryl (Be), magnez (Mg), wapń (Ca), stront (Sr), bar (Ba) i rad (Ra). Wszystkie są dwuwartościowe.
Położenie w układzie okresowym: Berylowce wraz z litowcami tworzą blok s. Zapisana w sposób ogólny konfiguracja elektronowa berylowców to [GS] ns2, gdzie GS to poprzedzający gaz szlachetny.
Występowanie w przyrodzie: Najbardziej rozpowszechnionym w skorupie ziemskiej berylowcem jest wapń (4,15%). W postaci węglanu CaCO3 występuje w postaci takich popularnych minerałów jak wapień, kreda czy marmur. Uwodniony siarczan wapnia CaSO4·2H2O znany jest jako gips. Hydroksyapatyt, będący solą wapnia, jest kluczowym składnikiem tkanki kostnej.
Magnez również występuje pospolicie w skorupie ziemskiej (2,33%). Tworzy liczne minerały, m.in. oliwin, serpentyn, talk, dolomit, kizeryt, kainit. Magnez jest składnikiem chlorofilu, tworząc w kompleksie z porfiryną układ światłoczuły.
Stront i bar występują rzadziej (ok. 4×10−2%), a beryl jeszcze rzadziej (2,8×10−4%). Rad występuje jedynie w śladowych ilościach (około 9×10−7 ppm) w rudach uranu.
Zwyczajowa nazwa tej grupy pierwiastków – metale ziem alkalicznych – pochodzi od ich tlenków wykazujących odczyn zasadowy (tlenki metali dawniej nazywane były ziemiami). Berylowce nie występują w przyrodzie w stanie wolnym.
Właściwości fizyczne: Wszystkie berylowce są metalami. Pierwiastki należące do tej grupy są miękkie, lekkie i łatwo topliwe. Miękkość i topliwość rośnie z kolejnymi okresami w grupie.
Właściwości chemiczne: Metale te, oprócz berylu, cechują silne własności metaliczne i zasadowe. Tlenki i wodorotlenki berylowców także mają charakter zasadowy, który zwiększa się w kolejnych okresach. Wyjątkiem jest beryl, którego związki są generalnie amfoteryczne. Berylowce są nieco mniej reaktywne od poprzedzających je w układzie okresowym metali alkalicznych. Występują na +II stopniu utlenienia i tworzą jony typu M2+. Wapń, stront, bar i rad reagują z tlenem oraz z wodą w temperaturze pokojowej. Magnez w tych warunkach pokrywa się cienką, matową warstewką tlenku lub wodorotlenku. Do rozpoczęcia reakcji z wodą wymaga podgrzania. Beryl na powietrzu pokrywa się ochronną warstewką tlenku. Ogólny zapis reakcji berylowca z wodą:
- M + 2H2O → M(OH)2 + H2↑, gdzie M to metal ziem alkalicznych.
- MgO + C → Mg + CO
- Be + 2OH− + 2H2O → [Be(OH)4]2− + H2↑
- Ze względu na stosunkowo dużą elektroujemność, beryl łączy się z innymi pierwiastkami poprzez wiązania kowalencyjne. Sole berylu są podatne na hydrolizę, w wyniku której powstają kationy tetraakwaberylowe [Be(H2O)4]2+, wchodzące w skład soli kompleksowych o charakterze jonowym, np. [Be(H2O)4]SO4 i [Be(H2O)4]Cl2[8]. Beryl może tworzyć także inne związki kompleksowe, np. [BeF4]2−.
- Z tlenem beryl tworzy tlenek berylu (BeO, krystalizuje w układzie heksagonalnym). Znane są także związki berylu z wodorem BeH2, siarką – BeS, azotem – Be3N2, węglem – Be2C.
- Wodorotlenek berylu Be(OH)2 jest trudno rozpuszczalny w wodzie i ma własności amfoteryczne, z silnymi zasadami dając berylany, np. Na2BeO2 i K2BeO2. Siarczan berylu BeSO4 jest dobrze rozpuszczalny w wodzie (41,3 g/100cm³ w 25 °C), natomiast węglan BeCO3·4H2O rozpuszcza się dużo słabiej (0,36 g/100 cm³ w 0 °C)[9].
-
- T – temperatura neutronu,
- – stała Boltzmanna.
-
- – (h kreślone) stała Plancka,
- – długość wektora falowego neutronu,
- – masa neutronu.
- MgO + C ⇌ Mg + CO↑
- 2(CaO•MgO) + Si → Ca2SiO4 + 2Mg
- zwiększenie pobudliwości nerwowo-mięśniowej oraz osłabienia i nieprawidłowości pracy serca, czego efektem są:
- drgania jednej z powiek, czy też częściowo górnych warg
- bolesne skurcze łydek
- uczucia odrętwienia i mrowienia w kończynach
- objaw Raynauda
- wzmożone wypadanie włosów
- łamanie się paznokci
- próchnica zębów
- rozdrażnienia, lęki, stan zagubienia
- zespół niespokojnych nóg
- zaburzenie depresyjne
- trudności w koncentracji
- zaburzenia snu, nocne poty
- bóle głowy, mdłości
- nagłe zawroty głowy
- kołatanie serca, arytmii
- nadciśnienie
- miażdżyca
- biegunka
- nietolerancja glukozy, cukrzyca typu II
- kamica nerkowa
- bolesne miesiączkowanie
- rzucawka okołoporodowa,
- zatrucie ciążowe
- astma oskrzelowa
- migrena
- zespół metaboliczny
- 1Skład
- 2Występowanie
- 3Struktura
- 4Przypisy
- 5Bibliografia
- 3CaO + 2Al → Al2O3 + 3Ca
- siarczan (gips – dwuwodny, anhydryt – bezwodny) – budownictwo, sztuka, usztywnianie kończyn przy urazach, nasycony roztwór wodny (woda gipsowa) służy do odróżniania wapnia od strontu i baru w toku analizy jakościowej;
- azotan – nawozy sztuczne;
- węglik (karbid) – produkcja acetylenu;
- cyjanamid – herbicyd, nawóz sztuczny;
- chlorek – mieszaniny oziębiające, odladzanie dróg, bezwodny – osuszanie substancji, dodatek do żywności;
- tlenek (wapno palone) – budownictwo (tynki, zaprawy murarskie);
- wodorotlenek (wapno gaszone) – nasycony roztwór wodny (woda wapienna) służy do wykrywania dwutlenku węgla i węglanów.
- aktywator enzymatyczny;
- przekaźnik wtórny – kinazy białkowe;
- przewodzenie impulsów bioelektrycznych;
- udział w krzepnięciu krwi;
- udział w skurczu mięśni szkieletowych, gładkich i mięśnia sercowego;
- udział w reakcjach zapalenia, regeneracji i proliferacji;
- udział w wydzielaniu hormonów zwierzęcych i neurotransmiterów oraz gruczołów zewnątrzwydzielniczych;
- obniża stopień uwodnienia koloidów komórkowych.
- ilości wapnia w pożywieniu;
- stopnia wchłaniania wapnia w przewodzie pokarmowym;
- stopnia wydalania wapnia z moczem.
- Dzieci i młodzież
- 1-6 miesięcy 210 mg;
- 6 do 12 miesięcy: 270 mg;
- od 1 do 3 lat: 500 mg;
- od 4 do 8 lat: 800 mg;
- od 9 do 18 lat: 1500 mg.
- Dorośli
- od 19 do 50 lat: 1200 mg;
- od 51 lat wzwyż: 1500 mg;
- dla dorosłych: 800 mg;
- dla osób starszych: 600 mg;
- dla kobiet ciężarnych: 1400 mg;
- dla kobiet karmiących: 2000 mg.
- łamliwość kości;
- psujące się zęby;
- nadmierna pobudliwość mięśni do skurczu (tężyczka – jawna lub utajona);
- ból mięśni;
- mrowienie i drętwienie kończyn;
- zaburzenia krzepnięcia krwi;
- zaburzenia rytmu serca;
- krwotoki z nosa;
- niedociśnienie tętnicze;
- stany depresyjne i lękowe;
- osteoporoza.
- zaparcia;
- nudności;
- brak apetytu.
- rozkład błon plazmatycznych;
- nieprawidłowy wzrost;
- martwica organów roślinnych.
- Na świecie: Niemcy, Szwajcaria, Meksyk, Kanada, Brazylia, Birma, Sri Lanka, Boliwia, Algieria, Kenia, Tanzania, Republika Południowej Afryki, Hiszpania, Finlandia, Portugalia, Rosja (Półwysep Kolski).
- W Polsce: Góry Sowie (w hornblendytach), okolice Bielska-Białej i Żywca.
- źródło otrzymywania fosforu (do produkcji nawozów sztucznych, zapałek, produkcji kwasu fosforowego)[1]
- czyste i ładnie zabarwione kryształy stosowane są w jubilerstwie (nadaje się im szlif fasetkowy i kaboszonowy)
- główny nieorganiczny składnik tkanek zębowych (szkliwa, zębiny i cementu) oraz kości.
- ze strony układu moczowego:
- hiperkalciuria
- wielomocz
- nefrokalcynoza
- kamica nerkowa
- układu sercowego:
- tachykardia
- nadciśnienie tętnicze
- niemiarowość
- W EKG wydłużenie odstępu PQ i skrócenie QT
- przewodu pokarmowego:
- nudności
- wymioty
- brak apetytu
- kamica dróg żółciowych
- zapalenie trzustki
- choroba wrzodowa żołądka i dwunastnicy
- Układu nerwowego
- splątanie
- senność
- ból głowy
- depresja
- śpiączka
- Osłabienie mięśni
- Odwodnienie
- Pierwotna nadczynność przytarczyc
- Samotny gruczolak przytarczycy
- Pierwotna hiperplazja przytarczyc
- Rak przytarczyc
- Zespoły MEN1, MEN2A, MEN4
- Stosowanie litu
- rodzinna hipokalciuria hiperkalcemiczna
- guz lity z przerzutami (np. raka piersi)
- guz lity hormonalnie wpływający na wzrost stężenia wapnia (np. rak płuc, rak nerki, feochromocytoma)
- nowotwory hematoonkologiczne (np. szpiczak mnogi, chłoniak, białaczka)
- Zatrucie witaminą D lub jej metabolitami
- Wytwarzanie 1,25(OH)2D przez ziarniniaki w sarkoidozie lub przez chłoniaki
- Hiperkalcemia z odbicia po rabdomiolizie
- Nadczynność tarczycy
- Szpiczak mnogi
- Długotrwałe unieruchomienie
- Choroba Pageta kości
- Stosowanie tiazydów
- Zatrucie witaminą A
- Nowotwory kości
- Ciężka wtórna nadczynność przytarczyc
- Nadczynność przytarczyc trzeciorzędowa
- Zatrucie glinem
- Zespół Burnetta
- Niedoczynność kory nadnerczy
- Zespół Zollingera-Ellisona
- leczenie choroby podstawowej
- zwiększenie wydalania wapnia przez nerki – intensywne nawadnianie przez podanie do 5l 0,9% NaCl, jednocześnie podając furosemid i.v. 20–40 mg po wcześniejszej ocenie czynności nerek
- zmniejszenie uwalniania wapnia z kości – można podawać kalcytoninęi.v. 100 IU 2-4 razy dziennie, pamidronian i.v. lub kwas zoledronowy i.v.
- hamowania wchłaniania wapnia z przewodu pokarmowego – hydrokortyzon 100 mg i.v. co 6h
- u chorych z niewydolnością nerek i objawową hiperkalcemia konieczna może być eliminacja wapnia poprzez dializę
- wpływ leków
- nadczynność przytarczyc
- długotrwałe unieruchomienie
- przerzuty nowotworowe do kości
- hiperkalciuria idiopatyczna - jest rozpoznawana gdy, stwierdza się hiperkalciurię u osoby stosującej dietę o standardowej ilości produktów mlecznych, z prawidłową funkcją nerek, bez zaburzeń stężenia wapnia, fosforu i magnezu w surowicy, bez rozpoznania kwasicy kanalikowej i schorzeń endokrynologicznych
- czynniki dietetyczne
- nadmierne spożycie sodu
- zwiększone spożycie białka zwierzęcego
- nadmierne spożycie alkoholu
- zwiększone spożycie cukrów prostych
- hiperkalciuria absorpcyjna
- hiperkalciuria nerkowa
- hiperkalciuria resorpcyjna
- dobowa zbiórka moczu na zawartość wapnia
- wskaźnik wapniowo-kreatyninowy (UCa/Cr)
- wpływ leków
- nadczynność przytarczyc
- długotrwałe unieruchomienie
- przerzuty nowotworowe do kości
- hiperkalciuria idiopatyczna - jest rozpoznawana gdy, stwierdza się hiperkalciurię u osoby stosującej dietę o standardowej ilości produktów mlecznych, z prawidłową funkcją nerek, bez zaburzeń stężenia wapnia, fosforu i magnezu w surowicy, bez rozpoznania kwasicy kanalikowej i schorzeń endokrynologicznych
- czynniki dietetyczne
- nadmierne spożycie sodu
- zwiększone spożycie białka zwierzęcego
- nadmierne spożycie alkoholu
- zwiększone spożycie cukrów prostych
- hiperkalciuria absorpcyjna
- hiperkalciuria nerkowa
- hiperkalciuria resorpcyjna
- dobowa zbiórka moczu na zawartość wapnia
- wskaźnik wapniowo-kreatyninowy (UCa/Cr)
- kanał wapniowy sterowany potencjałem
- kanał wapniowy sterowany neuroprzekaźnikiem
- kanał wapniowy sterowany przekaźnikiem wewnętrznym
- kanał wapniowy sterowany białkiem G.
- składnik farb elewacyjnych
- środek wzmacniający odkryte, pękające lub osypujące się stare tynki
- prosty środek odkażający (ze względu na własności żrące) stosowany do dezynfekcji i odkażania dużych powierzchni (np. piwnice, magazyny, pomieszczenia inwentarskie)
- silny środek neutralizujący kwasy i wiążący sole metali ciężkich stosowany np. w ratownictwie chemicznym
- zmiękczanie wody metodą dekarbonizacji
- przemysłowe oczyszczanie gazów spalinowych z tlenków siarki metodą zraszania lub przepłukiwania
- jako środek tani i stosunkowo łatwo usuwalny, stosowany do pobielania na wiosnę szyb w szklarniach i inspektach w celu ograniczenia dostępu do nich ostrego wiosennego słońca, nadmiernie nagrzewającego wnętrze szklarni przy niskich jeszcze temperaturach powietrza w nocy oraz niskiej temperaturze podłoża glebowego
- pobielanie na wiosnę pni drzew w sadach w celu spowolnienia procesów wegetacyjnych w górnej części rośliny przy bardzo jeszcze niskiej temperaturze w okolicach korzeni (badania statystyczne nie potwierdzają tego i innych celów uzasadniających stosowanie tego zabiegu)
- podkład pod grunt w malarstwie ściennym
- w cukrownictwie do oczyszczania soku buraczanego, powoduje reakcje wymiany w wyniku których rozpuszczalne sole (głównie fosforany) przestają być rozpuszczalne i mogą być odfiltrowane od soku
- Pleochroizm: brak
- Widmo absorpcyjne: nie diagnostyczne
- Luminescencja w bliskim ultrafiolecie wykazuje bladoróżowe, żółte lub zielone świecenie. W dalekim ultrafiolecie kryształy dają żółtawe, żółtawoczerwone lub białe świecenie.
- W Polsce: występuje w okolicach Tarnowskich Gór oraz został stwierdzony w nieistniejącej już kopalni rud cynku i ołowiu "Trzebionka" k. Trzebini.
- W jubilerstwie rzadko ze względu na miękkość, oszlifowane kryształy są zwykle bezbarwne,
- interesujący dla kolekcjonerów,
- rzadko wykorzystywany jako kamień ozdobny,
- ↑a b Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 39, ISBN 83-7183-240-0.
- ↑ Portal górniczy
- P. Gad, S. Rosenbaum, Tarnowskie Góry: Podziemia, Wyd. Wydział Kultury i Promocji Miasta, Tarnowskie Góry, 2010r. ISBN 978-83-61458-73-9, str.7
- M. Sachanbiński, Vademecum zbieracza kamieni szlachetnych i ozdobnych, Wydawnictwo Geologiczne, Warszawa, 1984r. ISBN 83-220-0199-1
- G. Tschermak, F. Becke,Podręcznik mineralogji, Wyd. Kasa im. Mianowskiego Instytut Popierania Nauki, Warszawa, 1931 r.
- wapno palone (niegaszone) – CaO, czyli tlenek wapnia. Otrzymywane przez wypalanie (prażenie) kamienia wapiennego w temperaturze 900 – 1300 °C, w wapienniku. Po wypaleniu, ma formę brył, których barwa zależy od domieszek. Do niektórych zastosowań wapno palone bywa mielone. Im mniej jest domieszek, tym bardziej białe jest wapno. Wapno palone łatwo chłonie wilgoć z powietrza i wchodzi w reakcję chemiczną, w wyniku której powstaje wodorotlenek wapnia.
- Wapno palone w bryłach jest używane: w przemyśle hutniczym jako topnik, do produkcji karbidu, jako półprodukt do zapraw murarskich, tynkarskich i sztukatorskich, do neutralizacji odpadów
- Wapno palone mielone jest używane do: do produkcji betonów komórkowych i cegły wapienno-piaskowej, w hutnictwie (głównie do odsiarczania), w przemyśle chemicznym, w przemyśle energetycznym jako sorbent do odsiarczania spalin, w ochronie środowiska, było używane jako dodatek do trocin przy wypełnianiu ścian drewnianych szkieletowych (także suchogaszone), obecnie jest używane głównie w ochronie środowiska (neutralizacja i higienizacja odpadów stałych).Zależnie od rodzaju użytego surowca, wyróżnia się wapno:
- wapniowe – z wapieni
- dolomitowe – z wapieni dolomitycznych (lub mieszaniny wapieni z dolomitami)
- hydrauliczne – z wapieni ilastych[1] (lub przy domieszkach margli)
- wapno gaszone (lasowane) – Ca(OH)2 – wodorotlenek wapnia. Gaszenie (lasowanie), to reakcja chemiczna tlenku wapnia z wodą i powstanie wodorotlenku wapnia: CaO + H2O → Ca(OH)2. Proces gaszenia może być przeprowadzony metodą:
- na mokro – dawniej metoda ta była często stosowana bezpośrednio na budowie, w wyniku daje ciasto wapienne i mleko wapienne
- na sucho – przy użyciu minimalnej ilości wody, niezbędnej dla prawidłowej reakcji chemicznej, proces przeprowadzany w warunkach przemysłowych. W wyniku otrzymywane jest wapno hydratyzowane.
-
- Proces gaszenia "na mokro" (dla wcześniej rozkruszonych brył) powinien trwać minimum 2 tygodnie dla wapna służącego przy wykonywaniu prac murarskich i minimum 2 miesiące dla wapna używanego do wykonywania prac tynkarskich. Jednak w ten sposób gaszono dawniej raczej większe bryły wapna, proces ten przeprowadzano nawet na rok przed planowanym użyciem materiału. W wyniku procesu gaszenia otrzymywany jest wodorotlenek wapnia.
- ciasto wapienne – plastyczna masa otrzymywana z wapna gaszonego. Powinna mieć kolor biały z odcieniem szarego, aż do szarego. Jeśli ma kolor brązowy, to znak, że proces gaszenia przebiegał przy użyciu za małej ilości wody. Wapno zostało "spalone" podczas procesu gaszenia i nie nadaje zaprawie lepkości. Przechowywane w dołach pod cienką warstwą piasku, który chroni wapno przed wysychaniem. Wapno gaszone można było przechowywać w ten sposób nawet wiele lat.
- wapno hydratyzowane (suchogaszone) – wapno hydratyzowane to suchy proszek, gotowy do użycia przy przygotowywaniu zapraw wapiennych i cementowo-wapiennych. Zaleca się gaszenie wapna hydratyzowanego na 24 godziny przed użyciem do murowania i tynkowania.
- mleko wapienne – zawiesina powstała przez rozcieńczenie ciasta wapiennego wodą, łatwo osiada, dlatego jest wytwarzana bezpośrednio przed użyciem. Używana jako dodatek do zapraw wapienno-cementowych, oraz do bielenia (malowania) ścian budynków i pomieszczeń gospodarczych. Ma silne własności odkażające i neutralizujące kwasy. Rozrobienie innych form wapna do mleka przed dodaniem innych składników ułatwia równomierne mieszanie zaprawy murarskiej i zapobiega powstawaniu grudek nierozrobionego wapna, które po kilku latach rozsadzają tynk.
- przez krystalizację zaprawy tracącej wodę. Utrata wody następuje poprzez parowanie wody lub wsiąkanie wody do murowanych, tynkowanych lub malowanych ścian. Utrata wody jest główny sposobem wiązania zaprawy wapiennej. W zaprawie wapiennej z rozpuszczonego w wodzie wodorotlenku wapnia wydzielają się kryształki wodzianu wapna Ca(OH)2·2H2O, lub kryształki uwodnionego wodorotlenku wapniowego. Podczas krystalizacji, kryształki wodzianu i wodorotlenku zrastają się ze sobą, z kryształkami zaprawy i ziarnami piaski, tworząc sztuczny kamień. Procesy krystalizacji są odwracalne, co wykorzystywane jest do uplastyczniania częściowo zaschniętej zaprawy, umożliwia też przechowywanie zaprawy przez długi czas.
- przez karbonatyzację, czyli łączenie się z dwutlenkiem węgla, woda w reakcji odgrywa rolę katalizatora, po wyschnięciu zaprawy proces ten zachodzi znacznie wolniej. Proces jest reakcją chemicznąCa(OH)2 + nH2O + CO2 = CaCO3 + (n+1)H2OW wyniku karbonizacji zaprawa nieodwracalnie twardnieje, proces twardnienia jest powolny i obejmuje zazwyczaj niewielką część wapna zawartego w zaprawie (w strefie powierzchniowej proces przebiega najszybciej, natomiast wiązanie CO2 z atmosfery przez głębsze strefy zaprawy może trwać nawet latami).
- przez tworzenie się krzemianów wapnia. Wapno wiąże w wyniku reakcji chemicznej z dwutlenkiem krzemu SiO2, który jest głównym składnikiem piasku. Reakcja ta może zachodzić tylko w temperaturze powyżej + 100 °C i w obecności wody. Wodorotlenek wapniowy łączy się z kwarcem: 2Ca(OH)2 + SiO2 = 2CaO·SiO2·2H2O. Ten ostatni sposób twardnienia zachodzi przy produkcji cegły wapienno-piaskowej i betonów komórkowych.
- zjonizowany – stanowi ok. 50% wapnia całkowitego;
- związany z resztami kwasowymi kwas karboksylowy karboksylanów – ok. 10% wapnia całkowitego;
- związany z białkami, głównie albuminami – ok. 40% wapnia całkowitego;
- Do laboratoryjnego wykrywania dwutlenku węgla. Rozpuszczony wodorotlenek wapnia reaguje z dwutlenkiem węgla z wytworzeniem trudnorozpuszczalnego węglanu wapniapowodującego zmętnienie roztworu:
- Ca(OH)2 + CO2 → CaCO3↓ + H2O
- W procesach uzdatniania wody jako stabilizator i środek wiążący rozpuszczony CO2, mogący powodować korozję.
- Zmiękczanie wody metodą dekarbonizacji lub wapienno-sodową.
- W medycynie, zewnętrznie jako środek ściągający, przeciwzapalny i osuszający. Dawniej stosowana wewnętrznie, przy zatruciu kwasami.
- 2NH4NO3 + CaCO3 → Ca(NO3)2 + 2NH3↑ + CO2↑ + H2O
Wszystkie berylowce reagują łatwo z kwasami, dając odpowiednią sól i gazowy wodór. Tej reakcji nie ulega beryl z kwasem azotowym (pokrywa się tlenkiem, BeO), oraz magnez z kwasem fluorowodorowym (pokrywa się trudno rozpuszczalnym fluorkiem, MgF2). Jedynie beryl reaguje ze stężonymi zasadami (powstają jony kompleksowe[Be(OH)4]2−).
Otrzymywanie: Metale te otrzymuje się przez elektrolizę ich stopionych soli. Magnez można również otrzymać poprzez redukcję jego tlenku w temp. ok. 2600 °C w ochronnej atmosferzewodoru lub gazu ziemnego, np. w reakcji z węglem:
1) Beryl (Be, łac. beryllium) - jest to pierwiastek chemiczny o liczbie atomowej 4, metal należący do drugiej grupy głównej układu okresowego. Pierwiastek stosunkowo rzadko występujący we Wszechświecie, z reguły jako produkt spalacji większych jąder atomowych, które zderzyły się z promieniowaniem kosmicznym.
(...) Beryl jest pierwiastkiem dwuwartościowym, naturalnie występującym jedynie w połączeniu z innymi pierwiastkami w minerałach. Ważniejsze kamienie szlachetne zawierające ten pierwiastek to akwamaryn, szmaragd i chryzoberyl.
W postaci wolnej beryl jest twardym, lekkim i kruchym metalem o stalowoszarej barwie. Jego jedynym stabilnym izotopem jest 9Be. Został odkryty przez Louisa Vauquelina w 1798 r.
(...) Dodany jako pierwiastek stopowy do glinu, miedzi, żelaza i niklu, znacznie zmienia ich właściwości fizyczne. Beryl nie tworzy tlenków, chyba że zostanie podgrzany do bardzo wysokich temperatur. Narzędzia wykonane ze stopów berylu z miedzią są twarde, trwałe i nieiskrzące. W zastosowaniach konstrukcyjnych, połączenie wysokiej sztywności, stabilności termicznej, przewodności cieplnej oraz niskiej gęstości (1,85 gęstości wody) czyni beryl materiałem odpowiednim do produkcji podzespołów samolotów, rakiet, statków kosmicznych i satelitów. Ze względu na niską gęstość i masę atomową, pierwiastek ten przepuszcza promienie rentgenowskie oraz innego rodzaju promieniowanie jonizujące. Ze względu na tę właściwość, stanowi najpowszechniejszy materiał do produkcji okien w aparaturze rentgenowskiej oraz komponentów wykorzystywanych do eksperymentów fizyki cząstek elementarnych. Wysoka przewodność cieplna berylu i tlenku berylu doprowadziła ponadto do ich wykorzystania w systemach do zarządzania ciepłem.
Komercyjne wykorzystanie tego pierwiastka wymaga zastosowania odpowiedniego systemu odprowadzenia pyłu oraz sterowania przemysłowego ze względu na toksyczność pyłów zawierających beryl. Pyły te u niektórych ludzi mogą wywołać zagrażającą życiu chorobę alergiczną, zwaną berylozą. Uczulenie na beryl dotyczy około 16% populacji.
Występowanie
Zawartość berylu w górnych warstwach skorupy Ziemi wynosi 0,0002%, występuje w minerałach takich jak beryl (Be3Al2[Si6O18]), chryzoberyl (Al2BeO4) lub fenakit (Be2SiO4). Niektóre odmiany minerału berylu (szmaragd, akwamaryn, heliodor) znane są jako kamienie szlachetne.
Otrzymywanie
Metaliczny beryl można wydzielić elektrolitycznie ze stopionych soli – BeCl2 i BeF2.
WŁAŚCIWOŚCI:
-> Właściwości fizyczne: Beryl jest twardym, kruchym metalem o zwartej heksagonalnej strukturze krystalicznej. Charakteryzuje się wyjątkowo wysoką sztywnością (moduł Younga 287 GPa[7]) i wysoką temperaturą topnienia, wynoszącą 1287 °C.
-> Właściwości chemiczne: W związkach chemicznych występuje na +II stopniu utlenienia. Nie roztwarza się na zimno w kwasie azotowym (ulega pasywacji). Aby reakcja berylu z wodą zaszła efektywnie należy podgrzać ją niemal do wrzenia. Rozcieńczony kwas siarkowy i solny reaguje z berylem już w temperaturze pokojowej. Ze względu na swoje amfoteryczne właściwości, beryl rozpuszcza się w roztworach wodorotlenków metali alkalicznych:
Właściwości biologiczne: Beryl prawdopodobnie nie ma znaczenia biologicznego; dotychczas nie stwierdzono wykorzystywania tego pierwiastka przez organizmy żywe. Związki berylu są silnie trujące, wywołując berylozę, głównie przy kontakcie ze skórą lub poprzez wdychanie pyłu berylowego.
Zastosowanie
Technika jądrowa
Ze względu na mały przekrój czynny na wychwyt neutronów termicznych, metaliczny beryl stosowany jest jako moderator spowalniający neutrony w reaktorach jądrowych, oraz do wyrobu prętów sterujących i awaryjnych. W mieszaninie z pierwiastkami emitującymi cząstki alfa stosowany jest jako źródło neutronów. Jako dobry reflektor neutronów wykorzystywany jest także w broni jądrowej jako osłona (reflektor) ładunku jądrowego, co pozwala na zmniejszenie masy krytycznej.
Neutrony termiczne – neutrony o energii kinetycznej porównywalnej z energią ruchu cieplnego w temperaturze zbliżonej do pokojowej T = 295 K, jest to energia równa
gdzie
Temperaturę neutronu można powiązać z jego wektorem falowym, poprzez związek wektora falowego z pędem. Otrzyma się wówczas wzór
gdzie
Neutron termiczny w przybliżeniu ma energię 25 meV, prędkość 2,2 km/s, długość fali 1,8 A i temperaturę 20 °C.
Najważniejszym zastosowaniem neutronów termicznych jest udział w reakcji rozszczepiania jąder uranu. Przekrój czynny na rozszczepienie izotopu uranu 235U ma strukturę rezonansową, a jego maksimum występuje dla energii neutronu 0,025 eV, gdzie wartość przekroju wynosi 577 b.
Neutrony emitowane po rozszczepieniu jąder uranu mają zbyt duże energie, by powodować reakcje łańcuchowe. Aby je spowolnić do około 0,025 eV (2,2 km/s) stosuje się tzw. moderator, czyli ośrodek materialny, przez który przechodzą neutrony i ulegają moderacji. Moderacja polega na dostosowaniu temperatury (ustaleniu równowagi termodynamicznej poprzez zderzenia elastyczne neutronów z jądrami moderatora) neutronów do temperatury moderatora. Moderatorem neutronów termicznych jest najczęściej woda destylowana będąca w obiegu zamkniętym, która schładzana jest na zewnątrz reaktora poprzez chłodnie kominowe.
Neutronów termicznych używa się głównie do badań ciała stałego. Badania te polegają na wykorzystaniu zjawiska dyfrakcji neutronów na sieci krystalicznej badanej substancji.
Długość fali neutronu termicznego porównywalna jest z odległościami międzyatomowymi w substancji. Dzięki temu, neutrony bardzo dobrze nadają się do badania struktur krystalicznych i, z racji tego, że neutron posiada moment magnetyczny, struktur magnetycznych.
Energia kinetyczna neutronu termicznego porównywalna jest z energiami elementarnych wzbudzeń sieci krystalicznej (fononów) i sieci magnetycznej (magnonów). Dzięki rozpraszaniu nieelastycznemu neutronów, można badać kreację i anihilację fononów i magnonów, przez co zyskuje się wiedzę o własnościach badanego materiału.
Technika radiacyjna
Beryl bardzo słabo pochłania promieniowanie rentgenowskie, co pozwala na stosowanie go do wyrobu okienek w aparatach i mikroskopach rentgenowskich oraz w detektorach promieniowania rentgenowskiego.
Dzięki przezroczystości berylu dla wysokoenergetycznych cząstek naładowanych elektrycznie, wykorzystuje się go do budowy detektorów takiego promieniowania w akceleratorach cząstekelementarnych (np. Wielki Zderzacz Hadronów).
Technika głośnikowa
Duża sztywność (moduł Younga 287 GPa) i niska gęstość sprawiają, że stosuje się go do wytwarzania membran głośnikówwysokotonowych charakteryzujących się znacznie lepszymi parametrami od wykonanych typowo z tytanu lub glinu (pasmo przenoszenia 1000–40 000 Hz)[11]. Ze względu na toksyczność berylu i jego trudną obróbkę, ich cena jest znacznie wyższa i są produkowane przez niewiele firm.
Inne zastosowania: Beryl może służyć jako dodatek do stopów innych metali, gdzie zwiększa twardość i odporność na korozję. Stop miedzi i berylu jest wykorzystywany w produkcji narzędzi nieiskrzących, elementów sprężystych, podzespołów aparatury chemicznej oraz elementów żaroodpornych. Pył berylowy jest stosowany jako składnik stałego paliwa rakietowego o najwyższym impulsie właściwym oraz rakietowych silnikach o zastosowaniach militarnych.
(...) Ze względu na małą gęstość i dobre parametry mechaniczne, beryl wykorzystano do budowy zwierciadeł w Kosmicznym Teleskopie Jamesa Webba.
2) Magnez (Mg, łac. Magnesium) - jest to pierwiastek chemiczny, metal ziem alkalicznych (druga grupa główna układu okresowego). Ma trzy stabilne izotopy: 24Mg, 25Mg oraz 26Mg. Magnez po raz pierwszy został uznany za pierwiastek przez Josepha Blacka, zaś wyodrębniony w formie czystej w 1808 roku przez Humphry’ego Davy’ego. Polską nazwę „magnez” jako pierwszy zaproponował Filip Neriusz Walter.
Występowanie: Magnez jest jednym z najpospolitszych pierwiastków, występuje w skorupie ziemskiej w ilości 2,74% pod postacią minerałów: dolomitu, magnezytu, kizerytu, biszofitu, karnalitu, kainitu i szenitu. W wodzie morskiej występuje w ilości około 0,12%, w postaci roztworu soli Mg2+. Nie występuje w postaci pierwiastkowej.
Otrzymywanie: Magnez można otrzymać poprzez redukcję tlenku magnezu lub metodami elektrochemicznymi. Do elektrolizy stosuje się stopione sole: karnalit lub chlorek magnezu z topnikami, np. fluorytemlub mieszaniną NaCl i CaCl2. W metodach termicznych jako reduktory stosuje się węgiel lub karbid w temperaturze ok. 2000 °C:
lub krzem w reakcji z tlenkami magnezu i wapnia pochodzącymi z wyprażenia dolomitu (w metodzie tej uzyskuje się magnez o dużej czystości):
Zamiast czystego krzemu stosuje się także żelazokrzem. W celu ochrony przed ponownym utlenieniem metalu proces prowadzić można w próżni lub atmosferze wodoru lub gazu ziemnego.
Związki: Najważniejsze związki magnezu to tlenek magnezu, wodorotlenek magnezu oraz sole. Roztwory wodne, w których występuje duże stężenie jonów Mg2+ mają gorzki smak. Siarczan magnezu, tzw. sól gorzka, znajduje zastosowanie jako środek przeczyszczający, a w formie bezwodnej – jako środek suszący.
Zastosowanie magnezu:
Magnez metaliczny wykorzystuje się w chemii organicznej do otrzymywania związków Grignarda, oraz w postaci prętów do ochrony przed korozją pojemnościowych podgrzewaczy wody, wykonanych ze stali (anoda magnezowa, montowana wewnątrz zbiornika).
Stopy magnezu są wykorzystywane w przemyśle lotniczym i kosmicznym, tam gdzie stopy tytanu i glinu są za ciężkie. Stopy magnezu z litem są stopami o jednej z najniższych gęstości i lepszym niż dla innych stopów stosunku wytrzymałości mechanicznej do masy. W podobnych zastosowaniach wykorzystywane są także magnale (stopy glinu z magnezem) oraz elektrony (stopy magnezu, glinu, cynku, manganu i krzemu)[18].
Ze stopów magnezowych wykonuje się obudowy niektórych urządzeń elektronicznych i precyzyjnych, np. obudowy notebooków, kamer filmowych i video oraz aparatów fotograficznych.
-> Magnale to ogólna nazwa stopów metali zawierających głównie aluminium, któremu towarzyszy domieszka magnezu w ilości od 3 do 30%. Dodatkowo stopy te mogą zawierać niewielką domieszkę miedzi. Magnale są stopami o gęstości niższej od aluminium, za to o wyższej odporności na korozję, np. gęstość przy 10% magnezu wynosi 2,55 g/cm³, przy gęstości aluminium równej 2,7. Zastosowanie: części silników, konstrukcje lotnicze. Stopem glinu, podobnym do magnalu, jest duraluminium, posiadające nieco wyższą gęstość oraz znacznie większą wytrzymałość mechaniczną.
-> Elektron – stop magnezu z glinem, krzemem, manganem i cynkiem, wynaleziony w Niemczech podczas I wojny światowej jako substytut aluminium. Głównym składnikiem stopu jest magnez, który stanowi 85%-98% w zależności od rodzaju produkcji. Bardzo lekki (gęstość ok. 1,8 g/cm3), a przy tym wytrzymały. Używany do produkcji części maszyn szczególnie ważny jest w przemyśle lotniczym, samochodowym oraz zbrojeniowym. Nie jest odporny na korozję, przez dużą aktywność chemiczną magnezu. Ma zbliżone właściwości do żeliwa, podczas obróbki jest łatwo zapalny, przy czym powstaje tlenek magnezu.
Znaczenie biologiczne: Magnez wchodzi w skład chlorofilu, jony magnezu odgrywają też dużą rolę w utrzymywaniu ciśnienia osmotycznego krwi i innych tkanek, oraz utrzymywaniu właściwej struktury rybosomów. Jest składnikiem kości, obniża stopień uwodnienia koloidów komórkowych, uczestniczy w przekazywaniu sygnałów w układzie nerwowym.
Objawy niedoboru magnezu u roślin: więdnięcie, chloroza liści, zahamowanie fotosyntezy.
Rola magnezu w organizmie człowieka: Zapotrzebowanie na magnez u osób dorosłych wynosi 300–400 mg na dobę i chociaż w naturalnym środowisku bogato występuje w spożywanych przez człowieka pokarmach, jest go coraz mniej w wyniku nawożenia chemicznego gleby związkami zawierającymi potas oraz stosowania nadmiernej ilości konserwantów żywności. Inne przyczyny niedoboru magnezu to: nadużywanie alkoholu, picie kawy, stosowanie hormonalnych środków antykoncepcyjnych, stres, spożywanie nadmiernych ilości tłuszczów, niewydolność nerek.
Objawy niedoboru magnezu u człowieka
Magnez bierze udział w bardzo licznych procesach zachodzących w organizmie ludzkim, zakres objawów jego niedoboru jest więc bardzo szeroki.
Suplementacja magnezem może mieć wiele korzystnych skutków dla zdrowia w tych schorzeniach i objawach.
Magnez a depresja: Istnieją uzasadnione podejrzenia, iż niedobór magnezu w diecie może prowadzić do depresji. Poziom tego pierwiastka był istotnie mniejszy w płynie mózgowo-rdzeniowym osób z lekooporną depresją grożącą samobójstwem oraz pobranym od osób, które popełniły samobójstwo. Poziom magnezu w mózgu nie jest skorelowany bezpośrednio z jego poziomem w surowicy krwi. Jego nieinwazyjny pomiar w mózgu jest możliwy przy użyciu spektroskopii rezonansu magnetycznego 31P in vivo, gdyż przesunięcia chemiczne sygnałów atomu fosforu β nukleozydotrifosforanów można skorelować ze stężeniem wolnych jonów Mg2+. Zawartość magnezu w mózgu osób z lekooporną depresją była istotnie mniejsza niż u osób zdrowych. Metoda pomiaru poziomu magnezu w mózgu in vivo metodą MRI opublikowana została w roku 2008 i wymaga potwierdzenia w badaniach klinicznych.
Chlorek magnezu u osób z cukrzycą typu II i niedoborem magnezu już w niewielkich dawkach był tak skuteczny w leczeniu objawów depresyjnych, jak silny lek przeciwdepresyjny – imipramina. Opisywano przypadki, z których wynikało, że suplementacja rozpuszczalną formą magnezu (4 × 125–300 mg jonów Mg2+dziennie) może nawet w ciągu mniej niż 7 dni znieść objawy kliniczne depresji. Z niektórych badań wynika, iż skuteczna terapia farmakologicznymi środkami przeciwdepresyjnymi przebiega ze wzrostem poziomu magnezu w organizmie.
Przedawkowanie: Nadmiar magnezu z organizmu jest usuwany przez nerki. Istnieje pewna możliwość przedawkowania preparatów magnezu. Ryzyko to dotyczy więc szczególnie pacjentów starszych, ze znacznie upośledzoną funkcją nerek. Możliwe objawy obejmują: niedociśnienie, nadmierne spowolnienie akcji serca – bradykardia, niewydolność oddechowa, osłabienie odruchów – hiporefleksja, opisano śmierć osoby w podeszłym wieku po przyjęciu bardzo dużej ilości związków magnezu w celu ułatwienia wypróżnienia.
Magazynowanie: Ponad połowa magnezu znajduje się w kościach, jedna czwarta w mięśniach szkieletowych, jedna czwarta rozmieszczona jest w całym organizmie, przeważnie w układzie nerwowym i w narządach o dużej aktywności metabolicznej, jak: mięsień sercowy, wątroba, przewód pokarmowy, nerki, gruczoły wydzielania wewnętrznego i zewnętrznego, układ hemolimfatyczny.
| ||
| Właściwości chemiczne i fizyczne | ||
| Inne nazwy | Magnesiowustyt | |
| Skład chemiczny | (Mg,Fe)O | |
| Układ krystalograficzny | regularny | |
Ferroperyklaz – minerał z gromady tlenków. Jest to jeden z głównych minerałów wchodzących w skład dolnego płaszcza Ziemi.
Spis treści
Skład
Ferroperyklaz jest roztworem stałym tlenku magnezu i tlenku żelaza(II). Względna zawartość składników może być różna, tworząc serię od peryklazu (MgO) do wustytu (FeO). Ziarna ferroperyklazu zawierające ponad 50% FeO nazywa się magnesiowustytem[1], choć termin ten bywa też stosowany jako synonim ferroperyklazu[2][3]. Ferroperyklazy zawierają domieszki innych pierwiastków: NiII, CrIII, MnII i Na; zawartość każdego z nich wynosi maks. 1–2,5% wagowych[4].
Występowanie
Badania teoretyczne i eksperymentalne sugerują, że ferroperyklaz powinien stanowić od 16 do 20% masy dolnego płaszcza, najgrubszej z geosfer i być tam drugim pod względem rozpowszechnienia minerałem po bridgmanicie. Stanowi on 50–56% rozpoznanych inkluzji dolnopłaszczowych w diamentach[1].
Struktura
Peryklaz i wustyt mają tę samą strukturę halitu, tworzą sieć regularną ściennie centrowaną (grupa przestrzenna Fm3m). Pod wpływem wysokiego ciśnienia wustyt przechodzi różnorodne przemiany fazowe, zmieniając strukturę krystaliczną; struktura peryklazu jest stabilna w zakresie ciśnień spotykanych w płaszczu[5]. Ferroperyklaz nie przechodzi w dolnym płaszczu przemian strukturalnych, które mogłyby wywołać efekt rejestrowany w przebiegu fal sejsmicznych, za to jest wyraźnie anizotropowy: prędkość rozchodzenia się pionowo spolaryzowanych fal poprzecznych (w sejsmologii oznaczanych SV) jest niższa niż fal spolaryzowanych poziomo (SH). Efekt ten jest silniejszy niż przeciwny efekt w przypadku postperowskitu[6].
Hydronalium – stop aluminium zawierający 2–5% magnezu i 0,1–0,4% manganu do obróbki plastycznej. Charakteryzuje się dobrą odpornością na korozję powodowaną wodą morską, stąd jego zastosowanie w przemyśle okrętowym i chemicznym.
Magnox (Magnesium non-oxidising) - stop magnezu z niewielkimi ilościami aluminium.
Stop stosowany jest do produkcji koszulek i innych elementów paliwa jądrowego. Zaletą magnoxu jest mały przekrój czynny na pochłanianie neutronów termicznych.
Nazwą Magnox określa się również typ wczesnego reaktora jądrowego produkcji brytyjskiej, w którym wykorzystywano paliwo w koszulkach z tego stopu.
Związki magnezu:
a) Nieorganiczne sole magnezu:
3) Wapń (Ca, łac. Calcium - nazwa ta pochodzi od łacińskiego rzeczownika calx - wapno, co oznacza więc "metal z wapna") - jest to pierwiastek chemiczny z grupy berylowców (metali ziem alkalicznych) w układzie okresowym.
 Charakterystyka: Wapń to srebrzystobiały metal. Na powietrzu szybko pokrywa się warstwą tlenku CaO, musi więc być przechowywany bez jego dostępu, np. w nafcie, podobnie jak sód i potas. Metaliczny wapń ma twardość zbliżoną do ołowiu, można go kroić nożem, jednak dodany do innych miękkich metali znacznie zwiększa ich twardość. Potencjał standardowyukładu Ca2+/Ca wynosi −2.86 V. Wapń reaguje z wodą i z rozcieńczonymi kwasami nieorganicznymi (solnym, azotowym, trudniej w siarkowym – słabo rozpuszczalny CaSO4) oraz organicznymi (np. octowym), przy czym reakcje z kwasami są bardziej burzliwe. Najważniejsze związki wapnia to tlenek wapnia, nadtlenek wapnia, wodorotlenek wapnia oraz wiele soli, na przykład węglan wapnia, azotan wapnia czy węglik wapnia.
Charakterystyka: Wapń to srebrzystobiały metal. Na powietrzu szybko pokrywa się warstwą tlenku CaO, musi więc być przechowywany bez jego dostępu, np. w nafcie, podobnie jak sód i potas. Metaliczny wapń ma twardość zbliżoną do ołowiu, można go kroić nożem, jednak dodany do innych miękkich metali znacznie zwiększa ich twardość. Potencjał standardowyukładu Ca2+/Ca wynosi −2.86 V. Wapń reaguje z wodą i z rozcieńczonymi kwasami nieorganicznymi (solnym, azotowym, trudniej w siarkowym – słabo rozpuszczalny CaSO4) oraz organicznymi (np. octowym), przy czym reakcje z kwasami są bardziej burzliwe. Najważniejsze związki wapnia to tlenek wapnia, nadtlenek wapnia, wodorotlenek wapnia oraz wiele soli, na przykład węglan wapnia, azotan wapnia czy węglik wapnia.
Kationy Ca2+ należą do IV grupy kationów i barwią płomień na kolor ceglastoczerwony.
Występowanie: Wapń występuje w górnych warstwach Ziemi w ilości 3,54%. Główne minerały i skały to kalcyt, aragonit, marmury, kreda, wapienie, gips, anhydryt, dolomit, fluoryt, apatyt oraz wiele krzemianów. Izotopy stabilne wapnia to 40Ca, 42Ca, 43Ca, 44Ca, 46Ca i 48Ca.
Odkrycie: Wapń i jego związki znane były od starożytności. Antoine Lavoisier już w 1789 domyślał się, że w wapnie znajduje się jakiś pierwiastek metaliczny, ale za jego czasów nie znano metody jego wydzielenia. Dopiero Humphry Davy w 1808 r. wyizolował go w stanie czystym i udowodnił analitycznie, że jest pierwiastkiem. Davy zwilżył wapno, dodał do niego nieco tlenku rtęciowego i uformował w miseczkę, którą umieścił na blaszce platynowej, stanowiącej anodę. Miseczkę napełnił rtęcią, do której zanurzył drucik platynowy – katodę, na której wydzielił się metal. Po odparowaniu rtęci pozostał srebrzysty metal (wapń). Nową, prostszą metodę zastosował Michael Faraday. Poddawał mianowicie elektrolizie suchy stopiony chlorek wapnia CaCl2. Na katodzie wydzielał się wprawdzie metaliczny wapń, ale ponieważ jest on lżejszy od stopionego chlorku wapniowego, wypływał na powierzchnię cieczy i spalał się. Dopiero po usunięciu tej trudności, Robert Bunsen i Mathiessen w 1854–1855 otrzymali tą metodą pewne ilości metalicznego wapnia. Stosunkowo czysty wapń otrzymał Henri Moissan w 1898 przez elektrolizę stopionego jodku wapniowego.
 |
| Źródło: sciencehistory.org - Davy przy użyciu "voltaic battery" w eksperymentach z rozkładem alkaliów. |
"Czerwcowe powietrze dusiło. Ale w stromym amfiteatrze Królewskiego Towarzystwa Królewskiego modni mężczyźni i kobiety Londynu, naukowcy i ludzie świeccy, zatłoczeni ławkami i galerią oglądają Humphry'ego Davy'ego, chemika celebryta, przedstawiającego najnowsze odkrycia naukowe. W zeszłym roku na prestiżowym wykładzie nagrodzonym nagrodą Bakerian Royal Society, Davy wrzucił bryłkę metalicznego potasu do kolby z wodą, gdzie bryła skakała po powierzchni wody, zanim eksplodowała lawinowymi płomieniami. Oczekiwania na czerwcowy wykład były wysokie. Tłum pochylił się, przewidując inny kolorowy, jeśli nie wybuchowy występ. Dzięki jego żywej demonstracji elektrolizy za pomocą sporego stosu voltaic, Davy nie zawiódł.
Rok 1808 był ważny dla Humphry'ego Davy'ego. W tym roku przed dwoma wiekami Davy odkrył pięć pierwiastków: baru, wapnia, boru, strontu i magnezu. Dostarczył wieści o swoich odkryciach do porywającej publiczności w dwóch urzekających wykładach - pierwszy w czerwcu i kolejny w grudniu - który był znaczącym krokiem w jego wspinaczce do szczytu naukowego i społecznego statusu gwiazdy w Londynie. Ale podczas gdy Davy cieszył się z jego sławy, on także nosił plotki, spekulacje i krytykę jako outsider.
Odkrycia Davy'ego z 1808 roku zależały od jego wykorzystania i badań nad rozwijającym się polem elektrochemicznym, badaniem wpływu elektryczności na reakcje chemiczne. Jako młody naukowiec z Instytutu Pneumatycznego w Bristolu, Davy dostał gorączki podekscytowania w 1800 roku hrabiego Alessandro Volty opisującej coś, co zaczęto nazywać voltaic pile, czyli kanapkę z wilgotnego tekturowego dysku pomiędzy dwoma metalowymi dyskami, które generowały słaby, ale ciągłe ładowanie. Młody Davy natychmiast zaczął się uczyć i eksperymentować z palami elektrycznymi, wyciągając z nich akumulatory i wykorzystując ładunki elektryczne do oddzielania pierwiastków od ich związków. Davy przyczynił się do tego, odkrywając, że sama elektryczność była spowodowana chemią. Zanim przybył do Londynu w 1801 roku, Davy napisał sześć artykułów o swoich eksperymentach z elektrochemią. W 1807 roku za pomocą elektrochemii Davy wyizolował metale potasu (z potasu żrącego, obecnie znanego jako wodorotlenek potasu [KOH]) i sodu (z sody kaustycznej, znanej obecnie jako wodorotlenek sodu [NaOH]). W 1808 roku wyizolował cztery z metali ziem alkalicznych z kilku mieszanin mineralnych.
Aparatura elektrolityczna Davy'ego była prosta: baterię podłączono do metalowych elektrod zanurzonych w cieczy zawierającej związek, który Davy chciał rozłożyć na elementy. Początkowo Davy próbował rozpuszczać różne związki w wodzie, ale wodę poddano elektrolizie do wodoru i tlenu, pozostawiając badany związek w nienaruszonym stanie. Davy przetopił minerały, które badał, a następnie stopował je rtęcią, zanim przepuścił przez nie prąd elektryczny. Ciekłe związki barbotowały się, gdy przepływał prąd, wytwarzając małe grudki srebrzystych metali na jednej elektrodzie i uwalniając gazowy tlen z drugiej. Same elektrody były obojętne i nie reagowały chemicznie z elektrolitem. Davy wyjął czysty bar z substancji zwanej "barytem"4 ). Z "wapna" lub tlenku wapnia (CaO), znanego również jako wapno palone, przygotował wapń. Wyizolować stront użył „strontites”, który mógł być czysty tlenek strontu (SrO) lub rudy strontu z regionu Strontian Szkocji, składające się głównie z siarczanu strontu (SrSO 4 ). Magnez Davy'ego wyizolowano "tlenek magnezu" lub tlenek magnezu (MgO).(...)Eksperymenty elektrochemiczne Davy'ego, rozkład i kwantyfikacja minerałów i innych związków w ich podstawowych elementach, miały zasadnicze znaczenie dla rozwoju elektrochemii, w tym dzieła Michaela Faradaya z połowy XIX wieku i Walthera Nernsta, Paula Héroulta i Charlesa Halla w koniec XIX wieku. Jego wykłady z 1808 r. Ujawniające izolację baru, strontu, wapnia, magnezu i boru oznaczały moment wirowania teatralności, sławy i postępu naukowego, a także ważny kamień milowy w historii chemii"
Źródło: sciencehistory.org; więcej na
temat działalności Humphry'ego
Davy możesz przeczytać: tutaj.
Nomenklatura polska: Jędrzej Śniadecki w III wydaniu Początków chemii omawiany pierwiastek nazywał "wapnianem", tak samo Ignacy Fonberg. Inni chemicy proponowali inne nazwy. Krzyżanowski pisał „wapien” i „wapień”, Radwański „wapniak”, Filip Walter zaś „kalcyum” i dodatkowo (1844) „kalc”. Zdzitowiecki „calcium”. W Projekcie warszawskim pojawia się nazwa „wapen”. Ostatecznie Emilian Czyrniański nadał pierwiastkowi krótszą nazwę „wapń”.
Otrzymywanie wapnia: Obecnie metaliczny wapń jest otrzymywany przeważnie ulepszoną metodą Faradaya, czyli przez elektrolizę stopionego chlorku (także fluorku) wapnia lub poprzez prażenie tlenku wapnia z glinem bez dostępu powietrza:
Zastosowanie: Metaliczny wapń ma ograniczone zastosowanie jako środek zabezpieczający przed utlenieniem, np. przy produkcji miedzi, stali i niklu, z których usuwa jednocześnie siarkę. Służy też do oczyszczania i osuszania ropy, benzyny, alkoholi, gazów szlachetnychi in. Używany jest także do redukcji tlenków uranu, toru, metali ziem rzadkich i in. do postaci metalicznej.
Zastosowanie związków wapnia:
Znaczenie biologiczne: Wapń wchodzi w skład kości oraz niektórych rodzajów ścian komórkowych. Całkowita zawartość wapnia w organizmie człowieka wynosi 1,4–1,66% masy ciała, z czego 99% występuje w postaci związanej w kościach (hydroksyapatyty), natomiast pozostała część występuje w postaci zjonizowanej w płynie śródkomórkowym oraz pozakomórkowym i pełni szereg ważnych funkcji:
Poziom wapnia w surowicy krwi zależy od:
Poniższy schemat ukazuje główne gruczoły odpowiedzialne za homeostazę wapnia:

Źródło: Wikipedia.
Główne hormony wpływające na homeostazę wapnia to: parathormon, kalcytonina i i 1α,25(OH)2-witamina D.
Zalecane dzienne spożycie wapnia wynosi:
lub
Objawy niedoboru wapnia (hipokalcemia)
Zmniejszenie stężenia wapnia w surowicy krwi nazywa się hipokalcemią. Skutkiem hipokalcemii jest:
Objawy nadmiaru wapnia (hiperkalcemia)
Może to prowadzić do powstawania kamieni nerkowych oraz obniżyć wchłanianie cynku i żelaza.
Mechanizmy homeostatyczne starają się przywrócić prawidłowy poziom wapnia w surowicy krwi przesuwając go z puli rezerwowej, a jeśli to nie wystarcza lub magazyny ulegają wyczerpaniu – z kośćca.
Wapń jest także niezbędnym składnikiem komórek roślin. Jego niedobór powodować może suchą wierzchołkową zgniliznę owoców pomidora. Inne objawy niedoboru u roślin:
Pol: Przedstaw za pomocą diagramu zależność pomiędzy działającym ciśnieniem i temperaturą (warunki otoczenia), a strukturą morfologiczną i składem siarczanu (VI) wapnia - CaSO4.
Charakterystyka:
- Właściwości: Tworzy kryształy sześcioboczne, o pokroju słupkowym, igiełkowym lub tabliczkowym. Często występuje w formie skupień zbitych, ziarnistych, nerkowatych. Jest kruchy, przezroczysty, wykazuje fluorescencję o bardzo różnych barwach. Jest izostrukturalny z mimetezytem, piromorfitem, wanadynitem. Stosunkowo twardy, daje się zarysować szkłem, stalą zwykłą oraz stalą narzędziową.
- Występowanie: Krystaliczny apatyt występuje prawie we wszystkich skałach magmowych. Duże koncentracje apatytu znajdują się w pewnych partiach rud magnetytowych. Apatyt jest częstym składnikiem pegmatytów. Najładniejsze okazy spotykane są w druzach jako szczotki krystaliczne oraz w pustkach skał wulkanicznych. Szczególnie duże okazy występują w Kanadzie (do 70 cm długości) i USA (do 25 cm). Największy oszlifowany apatyt ma masę 147 kg (pochodzi z Kenii, jest żółtozielony).
Miejsca występowania:
Zastosowanie:
*Hiperkalcemia – stan podwyższonego poziomu wapniawe krwi, umowną granicę stanowi wartość 2,75 mmol/l (11 mg/dl).
Objawy
Łagodna hiperkalcemia może przebiegać bezobjawowo. W umiarkowanej lub ciężkiej występują objawy zespołu hiperkalcemicznego:
Przyczyny
Pierwotna nadczynność przytarczyc wraz z chorobami nowotworowymi jest odpowiedzialna za około 90% przypadków hiperkalcemii[1]
Przyczyny związane z funkcją przytarczyc[edytuj | edytuj kod]
Przyczyny nowotworowe
Przyczyny związane z witaminą D
Nadmierna mobilizacja z kości
Niewydolność nerek
Pozostałe
Leczenie hiperkalcemii
Hiperkalciuria to stan chorobowy, polegający na zwiększonym wydalaniu wapnia z moczem (powyżej 300 mg/dobę u mężczyzn i powyżej 250 mg u kobiet[1]).
Przewlekła hiperkalciuria może prowadzić do kamicy moczowej (występuje w 30-60% przypadków[2]), nefrokalcynozy i zaburzenia wydalniczej funkcji nerek.
Etiopatogeneza
Wydalanie wapnia z moczem zależy od rodzaju stosowanej diety - nadmiar sodu jest istotnym czynnikiem zwiększającym kalciurię .
Czynniki mające wpływ na kalciurię:
Rodzaje
Diagnostyka
Leczenie
Leczenie hiperkalciurii jest leczeniem przyczynowym. W leczeniu objawowym hiperkalciurii nerkowej stosuje się najczęściej hydrochlorotiazydz suplementacją potasu.
Etiopatogeneza
Wydalanie wapnia z moczem zależy od rodzaju stosowanej diety - nadmiar sodu jest istotnym czynnikiem zwiększającym kalciurię .
Czynniki mające wpływ na kalciurię:
Rodzaje
Diagnostyka
Leczenie
Leczenie hiperkalciurii jest leczeniem przyczynowym. W leczeniu objawowym hiperkalciurii nerkowej stosuje się najczęściej hydrochlorotiazydz suplementacją potasu.
Kanał wapniowy – kanał dla jonów wapnia obecny na błonie komórkowej.
Wyróżnia się co najmniej cztery rodzaje kanałów wapniowych:
Mleko wapienne – zawiesina koloidalna wodorotlenku wapnia w wodzie[1]. Z wyglądu przypomina mlekokrowie, stąd nazwa substancji. Zawiera w sobie słabo zdysocjowany, jednak silnie alkaliczny roztwór wodorotlenku wapnia, oraz jego bezpośredni i łatwo dostępny nadmiar, co jest przydatne przy przeprowadzaniu szeregu reakcji chemicznych w środowisku wodnym, szczególnie wymagających dużej wydajności.
Mleko wapienne otrzymuje się poprzez gaszenie wapna w nadmiarze wody lub mieszanie z wodą wapna gaszonego.
Zastosowanie
Charakterystyka
Właściwości
Wykształcony w formie skupień pręcikowych, igiełkowych lub włóknistych. Zazwyczaj tworzy promieniste skupienia krystaliczne na powierzchni dolomitu, limonitu lub galeny. Często występują zbliźniaczenia (czasami wielokrotne). Jest kruchy, przezroczysty. Reaguje z kwasem solnym. Jest izomorficzny z witerytem, stroncjanitem, cerusytem. W warunkach panujących na powierzchni Ziemi przekrystalizowuje się w kalcyt i tworzy z nim paramorfozy.
Występowanie
Jest produktem niskotemperaturowych procesów hydrotermalnych, występuje w pęcherzach pogazowych.
Miejsca występowania:
Zastosowanie
Przypisy
Bibliografia
 |
| Źródło: muzmin.ing.uni.wroc.pl. |
Martin Websky (ur. 17 lipca 1824 w Nieder Wüstegiersdorf, obecnie Głuszyca, zm. 27 listopada 1886 w Berlinie) - niemiecki mineralog.
Życiorys
Naukę na szczeblu gimnazjum rozpoczętą w szkołach w Wałbrzychu i Miedziance ukończył w Berlinie, gdzie w 1843 uzyskał świadectwo dojrzałości w Gimnazjum Fryderyka Wilhelma.
Powrócił na trzy lata na Dolny Śląsk, by uczyć się praktycznie zawodu górnika.
W 1846 podjął studia w berlińskiej Akademii Górniczej, będąc uczniem m. in. Christiana Samuela Weissa.
Praktyki zawodowe odbywał w Złotym Stoku, a po zdaniu egzaminu na referendariusza uzyskał posadę okręgowego urzędnika górniczego w Wałbrzychu i Miedziance.
W 1853 został górmistrzem w Tarnowskich Górach, gdzie był też nauczycielem w Szkole Górniczej. W Tarnowskich Górach odkrył i opisał minerał, odmianę aragonitu, któremu nadał nazwę tarnowicyt, przez co zdobył sobie pewien rozgłos w świecie nauki.
W 1861 przeniósł się do Wrocławia, gdzie został nadradcą górniczym.
W 1865, gdy zaproponowano mu pracę w Dortmundzie, zdecydował się porzucić górnictwo i poświęcił się pracy naukowej.
Uzyskał tytuł profesora honoris causa Uniwersytetu Wrocławskiego, habilitował się i rozpoczął wykładanie mineralogii jako docent prywatny. Dokonał także przeglądu kolekcji minerałów Uniwersytetu Wrocławskiego, ofiarował brakujące okazy z własnej kolekcji i został współzałożycielem uniwersyteckiego Muzeum Mineralogicznego.
W 1868 uzyskał stopień profesora nadzwyczajnego, a w 1874 objął Katedrę Mineralogii i został kierownikiem zbiorów mineralogicznych Uniwersytetu Berlińskiego.
W 1884 stwierdził występowanie w minerałach wanadowych pochodzących z Argentyny obecność nieznanego dotąd pierwiastka i zaproponował dla niego nazwę "Idunium", jednakże nie ukończywszy badań nad tym zagadnieniem zmarł.
W dorobku naukowym pozostawił ponad 100 artykułów i doniesień publikowanych głównie na łamach specjalistycznych wydawnictw, jak „Zeitschrift der Deutschen Geologischen Gesellschaft”, „Sitzungsberichten der Gesellschaft naturforschender Freunde in Berlin” czy „Sitzungsberichten der Akademie der Wissenschaften zu Berlin”.
Wapno – spoiwo mineralne powietrzne (suchowiążące).
W budownictwie używane jest pod różnymi postaciami, choć postacią końcową jest mleko wapienne.
Obecnie sprzedawane jest głównie w postaci wapna hydratyzowanego, dawniej w postaci wapna palonego.
Występuje pod następującymi postaciami:
Wodorotlenek wapnia w wapnie gaszonym występuje w postaci drobnych płytek, o jakości wapna jako spoiwa decyduje wielkość płytek, im są mniejsze tym wapno jest tłustsze, powierzchnia płytek poprawnie zagaszonego wapna wynosi około 30 m²/g.
Proces wiązania i twardnienia wapna zachodzi w wyniku następujących procesów:
Odpowiednie proporcje między wysychaniem a karbonizacją są ważne przy wykonywaniu powłok malarskich farbami wapiennymi. Jeżeli proces schnięcia farby następuje zbyt szybko, to proces twardnienia nie zajdzie (tzw. spalenie farby) i farba będzie ścierać się ze ściany. Jeżeli proces schnięcia będzie przebiegał zbyt wolno proces twardnienia obejmie zbyt dużą część wapna, powstała powłoka straci biały kolor, będzie szklista, nałożone następne warstwy będą odpadały.
*Wapnowanie paszy - moczenie słomy, plew i innych pasz suchych dla bydła, owiec, kóz i koni mlekiem wapiennym w celu zwiększenia strawności suchej masy. Słoma poddana wapnowaniu ma wyższą strawność, a przez to wartość pokarmową.
*Wapń całkowity – w diagnostyce laboratoryjnej gospodarki wapniowej organizmu oznacza całkowitą ilość wapnia jaka znajduje się w surowicy krwi rozdzieloną na poszczególne frakcje:
DYSTRYBUCJA WAPNIA W ORGANIZMIE CZŁOWIEKA:
 |
| Źródło: Pinterest. Dystrybucja wapnia w organizmie człowieka. ZMIANY POZIOMU WAPNIA CAŁKOWITEGO W ORGANIZMIE CZŁOWIEKA: |
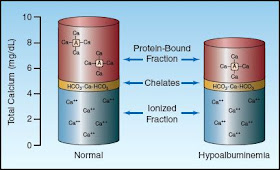 |
| Źródło: aneskey.com - Ubytek frakcji wapnia wiązanego z białkami w hipoalbuminemii. |

Źródło: Slideshare. Alkanemia i acidemia - różnice.
*Woda wapienna, łac. aqua calcis – nazwa zwyczajowa nasyconego, wodnego roztworu wodorotlenku wapnia. Rozpuszczalność Ca(OH)2 w wodzie w temp. 25 °C wynosi ok. 0,159 g na 100 g H2O to znaczy, że roztwór ten ma stężenie ok. 0,16%.[1] Woda wapienna to opalizujący płyn o odczynie alkalicznym (pH = 13). Przechowuje się ją z osadem nierozpuszczalnego wodorotlenku wapnia.
Otrzymywanie wody wapiennej
Wodę wapienną przygotowuje się w dwóch etapach. Najpierw sproszkowany tlenek wapnia zalewa się wodą w stosunku masowym 1:1 i dokładnie miesza. Tlenek wapnia reaguje gwałtownie z wodą z wydzieleniem ciepła (reakcja egzotermiczna).
CaO + H2O → Ca(OH)2↓ + ciepło
Powstałą zawiesinę odstawia się na 24 h do czasu całkowitej sedymentacji (opadnięcia) nierozpuszczonego związku, po czym roztwór dekantuje się znad osadu, a osad zalewa kolejną porcją wody. Przygotowywanie pierwszego roztworu ma na celu usunięcie łatwo rozpuszczalnego w wodzie KOH, który występuje jako zanieczyszczenie tlenku wapnia. Po zalaniu drugą porcją wody zawiesinę znów odstawia się do odstania i w takiej formie przechowuje. Wodę wapienną zlewa się znad osadu i sączy dopiero krótko przed użyciem.
Zastosowanie
Zwapnienie, kalcyfikacja – odkładanie się soli wapnia w tkankach miękkich organizmu.
Może być zjawiskiem naturalnym np. w czasie kostnienia szkieletu, czy powstawania pancerzy u bezkręgowców. Towarzyszy również pewnym procesom chorobowym, prowadząc do utraty elastyczności tkanek (np. zwapnienie ścięgna Achillesa spowodowane nawracającymi urazami i zapaleniem ścięgien) lub wapnienia patologicznych struktur (np. blaszki miażdżycowej).
Pośród bezpośrednich przyczyn wymienia się niedobór witaminy K oraz nieprawidłowe proporcje wapnia do witaminy D prowadzące do zaburzeń przyswajania wapnia oraz nieprawidłowej gospodarki minerałów w organizmie. Przyjmowanie nadmiernej ilości witaminy D może prowadzić do jej hiperwitaminozy i nadmiernego wchłaniania wapnia, gdy towarzyszy temu niedobór witaminy K. Proces ten jest również wywoływany przez warfarynę, działającą antagonistycznie wobec witaminy K.
*Biała Julianna – szlachetna odmiana marmuru kalcytowego o białym kolorze[2].
Odmiana charakteryzuje się wysokim stopniem przekrystalizowania oraz wysoką zawartością czystego węglanu wapnia oraz niską zawartością tlenku magnezu. Odmianę tworzą średnio i grubokrystaliczne białe marmury kalcytowe, które w kierunku spągu złoża przechodzą w szare i laminowane. Złoże marmuru Biała Julianna znajdują się w Masywie Śnieżnika w okolicach Stronia Śląskiego oraz w Sławniowicach[3]. Obecnie odmiana marmuru Biała Julianna nie jest eksploatowana. Biała Julianna jest szlachetną odmianą marmuru odporną na wietrzenie o wysokich wartościach dekoracyjnych i wysokiej jakości.
Zastosowanie
W przeszłości z Białej Julianny wyrabiano drobną galanterię: świeczniki, płyty stołowe, garnitury na biurka itp. oraz stosowano do dekoracji kościołów i pałaców.
Zielona Marianna – szlachetna odmiana marmuru o ciemnym szaro-zielonkawo-różowym zabarwieniu i intensywnej turbulentnej wzorzystości. Odmiana charakteryzuje się wysokim stopniem przekrystalizowania oraz wysoką, sięgającą 90%, zawartością czystego węglanu wapnia oraz niską, poniżej 1% zawartością tlenku magnezu. Złoża marmuru Zielona Marianna występują na północno wschodnim stoku wzniesienia Krzyżnik w Masywie Śnieżnika i znane są od 1839. Nazwa marmuru pochodzi od imienia byłej właścicielki dużej części Masywu Śnieżnika i Gór Bialskich księżnej Marianny Orańskiej.
Zastosowanie
Zielona Marianna jest odmianą twardą i trudną w obróbce, bardzo odporną na wietrzenie. W przeszłości odmianę tę stosowano do dekoracji wielu kościołów i pałaców m.in. wykorzystywano do dekoracji wnętrz pałacu w Kamieńcu Ząbkowickim. Płytami Zielonej Marianny wyłożono przejścia podziemne przy Dworcu Centralnym w Warszawie. Posłużyły one również do wykonania wystroju wnętrz w hotelu Cracovia w Krakowie.
ZWIĄZKI WAPNIA:
a) Nieorganiczne sole wapnia:
Azotan amonowo-wapniowy (CAN, z ang. calcium ammonium nitrate) – nieorganiczny związek chemiczny z grupy azotanów, sól mieszana kwasu azotowego i wapnia oraz amonu.
W zależności od warunków krystalizuje jako Ca(NO3)2·NH4NO3·3H2O lub 5Ca(NO3)2·NH4NO3·10H2O
Przemysłowo otrzymywany jest przez zmieszanie stężonego roztworu azotanu amonu i drobno sproszkowanego węglanu wapnia. Proces mieszania należy prowadzić szybko, aby uniknąć konkurencyjnej reakcji prowadzącej do utraty amonu:
Pod nazwą saletra amonowo-wapniowa lub CAN stosowany jest jako nawóz mineralny. Zawartość NH4NO3 w nawozie wynosiła dawniej (w latach 60. XX w.) ok. 60%, do lat 90. wzrosła ona do ok. 75%. Nawóz może zawierać węglan magnezu i inne dodatki, np. związki miedzi i cynku. Dzięki zawartości węglanów nie powoduje zakwaszania gleby[3]. W przeciwieństwie do czystej saletry amonowej (NH4NO3) CAN nie jest klasyfikowany jako substancja wybuchowa.




































































































































































































Brak komentarzy:
Prześlij komentarz