Fluorowce, chlorowce, halogeny - są to pierwiastki chemiczne 17 (dawniej VIIA lub VII głównej) grupy układu okresowego. Są to fluor, chlor, brom, jod, astat oraz (zsyntetyzowany w drugiej połowie 2009) tennessine. Nazwa „halogeny” pochodzi od greckich słów „sól” i „tworzyć”.
 |
| Źródło: Wikipedia. Probówki zawierające kolejno od lewej: fluor, chlor, brom i jod. |
Fluorowce są pierwiastkami o wysokiej elektroujemności i dużej aktywności chemicznej. W stanie pierwiastkowym występują w formie dwuatomowych cząsteczek. W związkach chemicznych występują na stopniach utlenienia od -1 do +7. Do pełnego zapełnienia swojej powłoki walencyjnej potrzebują jednego elektronu, dlatego najczęściej tworzą jednoujemny anion. Ze związkami organicznymi wchodzą w reakcje addycji oraz podstawienia. Związki nieorganicznefluorowców (w tym sole metali zawierające anion halogenkowy) oraz różne związki organiczne zawierające fluorowce noszą nazwę halogenków.
(...) Temperatury topnienia i [wrzenia fluorowców wzrastają wraz ze wzrostem ich liczby atomowej, czyli w dół układu okresowego. W warunkach normalnych fluor i chlor są gazami, brom jest cieczą, a jod i astat ciałami stałymi.
Z wodorem fluorowce tworzą w obecności światła halogenowodory, przy czym:
- fluor z wodorem reaguje w ciemności, dając fluorowodór
- potrzebna jest duża ilość światła, aby zaszła reakcja tworzenia chlorowodoru albo bromowodoru
- jodowodór powstanie poprzez dodatkowe ogrzanie substratów.
Roztwory wodne są mocnymi kwasami (z wyjątkiem HF, którego roztwór wodny jest słabym kwasem z powodu bardzo silnego wiązania między małymi atomami wodoru i fluoru). Między sobą fluorowce łączą się, tworząc związki międzyfluorowcowe (międzyhalogenowe), w których występują na różnych stopniach utlenienia (np. BrF3, IF5). Związki tego rodzaju są bardzo silnymi kwasami Lewisa i posiadają silne własności utleniające.
Wraz ze wzrostem liczby atomowej fluorowców maleje ich reaktywność i elektroujemność, a także moc oraz właściwości utleniające ich kwasów tlenowych:
- HClO > HBrO > HIO,
Rosną natomiast właściwości redukujące oraz moc ich kwasów beztlenowych:
- HF < HCl < HBr < HI
Otrzymywanie: Zarówno w skali przemysłowej, jak i laboratoryjnej, fluor otrzymuje się praktycznie wyłącznie poprzez elektrolizę ciekłej mieszaniny fluorowodoru i fluorku potasu. Pierwotnie stosowano mieszaninę bogatą w HF i temperaturę niższą od pokojowej, później opracowano proces wysokotemperaturowy, w którym elektrolit miał skład KF·HF i temperaturę topnienia 239 °C. Metoda ta dominowała w pierwszej połowie XX w. Obecnie przeważa proces średniotemperaturowy, prowadzony w 80–110 °C, z elektrolitem o składzie KF·2HF (ttopn. = 71,7 °C).
Zastosowanie: Gazowego fluoru używa się przy produkcji monomerów, fluorowanych alkenów, z których otrzymuje się teflon i jego pochodne. Oprócz tego jest stosowany do produkcji halonów, które są stosowane jako ciecze chłodzące i hydrauliczne (np. freon). Inne zastosowania:
- kwas fluorowodorowy (HF) oraz fluorki litowców i amonu są używane do trawienia szkła, m.in. w żarówkach;
- jednoatomowy fluor jest używany w produkcji półprzewodników;
- sześciofluorku uranu (UF6) używa się do wzbogacania uranu;
- heksafluoroglinian sodu (występujący naturalnie jako minerał kriolit) jest używany w elektrolitycznym otrzymywaniu glinu;
- fluorek sodu był kiedyś używany jako insektycyd, głównie przeciwko karaluchom;
- niektóre inne fluorki są często dodawane do past do zębów i (co budzi czasem kontrowersje) do wody pitnej, aby zapobiegać próchnicy zębów;
- sześciofluorek siarki (SF6) jest stosowany zamiast powietrza w rozdzielniach i transformatorach, gdyż ma 3 razy lepsze właściwości izolacyjne, niż powietrze, co zmniejsza ilość potrzebnego miejsca;
- fluorodeoksyglukoza znakowana izotopem 18F (18F-FDG) jest wykorzystywana w pozytonowej emisyjnej tomografii komputerowej.
Historia: Fluoryt (tj. fluorek wapnia, CaF2) został opisany w 1529 roku przez Georgiusa Agricolę jako topnik obniżający temperaturę topnienia innych minerałów (od właściwości tej pochodzi nazwa minerału: łac. fluere = płynąć). W 1670 roku Heinrich Schwanhard odkrył, że w wyniku działania kwasów na fluoryt powstaje gaz trawiący szkło (był to fluorowodór, HF). Właściwości kwasowe HF odkrył w roku 1780 Carl Scheele. Humphry Davy po otrzymaniu pierwiastkowego chloru przez utlenienie chlorowodoru (1810) usiłował – bez powodzenia – wraz z André Ampèrem w podobny sposób wyizolować fluor z flourowodoru. Badacze ci nadali nowemu pierwiastkowi nazwę fluorum od minerału fluorytu, CaF2. Polską nazwę – fluor – wprowadził Filip Walter.
Wolnego fluoru przez wiele lat nie udawało się go wyodrębnić z powodu jego ogromnej aktywności chemicznej – po wytworzeniu poprzez elektrolizę stopionego fluorytu, w wysokiej temperaturze procesu (temperatura topnienia CaF2 wynosi ok. 1400 °C) natychmiast reagował z substancjami i materiałami obecnymi w naczyniach reakcyjnych. Próby otrzymania fluoru doprowadziły przy tym do śmierci kilku badaczy. W roku 1885 Edmond Frémy rozpoczął badania nad elektrolizą fluorowodoru, jednak okazało się, że suchy związek nie przewodzi prądu, a związek wilgotny prąd wprawdzie przewodził, ale na elektrodzie wydzielał się tlen z obecnej wody, a nie fluor. Badania te kontynuował jego uczeń, Henri Moissan, który ostatecznie w 1886 roku otrzymał fluor przez elektrolizę fluorowodoru zawierającego dodatek KHF2 (było to przypadkowe zanieczyszczenie materiału do elektrolizy). Moissanowi otrzymanie nowego pierwiastka przyniosło Nagrodę Nobla w dziedzinie chemii w 1906 roku.
(...) Pierwsza produkcja fluoru na skalę przemysłową została uruchomiona na potrzeby projektu Manhattan. Gazowy fluorek uranu(VI) (UF6) był wtedy używany do rozdzielenia izotopów 235U i 238U podczas wzbogacania uranu.
Na 100-lecie odkrycia fluoru Karl Christe otrzymał ten pierwiastek poprzez reakcję heksafluoromanganianu(IV) potasu z fluorkiem antymonu(V) w temp. 150 °C:
- Etap 1 – synteza substratów:
- 2KMnO4 + 2KF + 10HF + 3H2O2 → 2K2MnF6↓ + 8H2O + 3O2
- SbCl5 + 5HF → SbF5 + 5HCl
- Etap 2 – reakcja właściwa:
- 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2↑
Była to pierwsza chemiczna (nie elektrochemiczna) metoda pozwalająca na otrzymanie fluoru pierwiastkowego ze znaczącą wydajnością (ok. 40%).
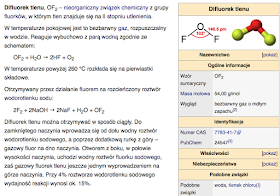
Związki fluoru: Fluor może zastępować wodór w związkach organicznych, dlatego liczba związków fluoru może być bardzo duża. Związki fluoru z gazami szlachetnymi po raz pierwszy otrzymali Howard Claassen, Henry Selig i John Malm w 1962 roku. Pierwszym z tych związków był tetrafluorek ksenonu. Otrzymano również fluorki kryptonu i radonu.
Fluor otrzymuje się z fluorytu, kriolitu lub fluoroapatytu.
(...)
Szkodliwość fluoru: Pierwiastkowy fluor, jak i jony fluorkowe, są silnie toksyczne. Zaburza procesy enzymatyczne w komórkach, hamując oddychanie tkankowe, przemianę węglowodanów, lipidów oraz syntezę hormonów. Sam fluor i niektóre jego związki działają żrąco, powodując głębokie martwice. Wolny fluor ma charakterystyczny drażniący zapach i jest wyczuwalny nawet w stężeniu 20 ppm.
Gazowy fluor łatwo wchłania się przez drogi oddechowe i pokarmowe. Związki fluoru obecne np. w żywności dobrze wchłaniają się z dróg pokarmowych.
Po podaniu doustnym w dużych stężeniach związki fluoru powodują zatrucia ostre, na skutek żrącego działania wydzielającego się fluorowodoru. Dalsze objawy to płytki oddech, kurcz dłoni, drgawki, ślinotok i nudności. Bezpośrednią przyczyną zgonu w wyniku zatrucia fluorem jest porażenie ośrodka oddechowego.
Zatrucia przewlekłe małymi dawkami fluoru, czyli fluoroza, objawiają się zaburzeniami w uwapnieniu kości, brunatnym cętkowaniem zębów, zmniejszeniem ruchliwości.
Dozwolone maksymalne stężenie przy założeniu 8-godzinnej ekspozycji na działanie fluoru to 0,05 mg/m3 (czyli mniej niż w przypadku cyjanowodoru).
Znaczenie biologiczne: Pomimo znacznej toksyczności, fluor w odpowiednich ilościach jest pierwiastkiem niezbędnym dla prawidłowego rozwoju kości i zębów. Może on modyfikować hydroksyapatyty budujące szkliwo zębów i poprzez substytucję grup wodorotlenowych tworzyć fluoroapatyty. Szkliwo zawierające taką modyfikację ulega wzmocnieniu oraz wykazuje większą oporność na działanie kwasów produkowanych przez bakterie próchnicotwórcze obecne w płytce nazębnej. Te specyficzne właściwości wynikają z faktu, iż fluoroapatyty wykazują lepszą krystaliczność, twardość oraz mniejszą rozpuszczalność w kwasach niż naturalnie występujące hydroksyapatyty.
Środki ostrożności: Zarówno fluor jak i fluorowodór muszą być przechowywane z zachowaniem szczególnych środków ostrożności. Powinno się unikać wszelkiego kontaktu ze skórą lub oczami. Fluoru nie przechowuje się w szkle.
--> Fluorki:
--> Fluorofosforany:
--> Organiczne związki fluoru:
a) Związki fluoroorganiczne:
b) Fluorofosfoniany:






























































































































































































































































































































































































































































































































Brak komentarzy:
Prześlij komentarz