Tlenowce (Siarkowce, chalkogeny) - są to nazwy pierwiastków należących do 16 (daw. VIA lub VI głównej) grupy układu okresowego. Są to tlen, siarka, selen, tellur, polon i liwermor.
 | ||||||||||||||||||||||||
| Źródło: Wikipedia. Próbki tlenowców.
Wszystkie tlenowce mają 6 elektronów walencyjnych i w związkach chemicznych występują na stopniach utlenienia od −2 do +6. Tlen z powodu dużej liczby elektronów przy małej liczbie powłok ma bardzo mały promień atomowy i posiada właściwości nieco odmienne niż reszta pierwiastków tej grupy, a jego stopnień utlenienia w związkach wynosi zazwyczaj −2 lub −1 (dodatnie stopnie utlenienia +1 i +2 osiąga jedynie w związkach z fluorem). Polon i liwermor są pierwiastkami promieniotwórczymi. Polon występuje na Ziemi w śladowych ilościach, ze względu na to, że jego izotopy są tworzone w naturalnych szeregach promieniotwórczych, a liwermor został wytworzony sztucznie w reakcjach syntezy jądrowej.
Tlenowce tworzą dwuujemne aniony:
Ponadto znane są aniony wielopierwiastkowe, np. nadtlenki O22−, wielosiarczki Sn2−, wieloselenki Sen2− i wielotellurki Ten2−. Charakter pierwiastków zmienia się w dół grupy od niemetalicznego (tlen, siarka) do metalicznego (polon). Aktywność chemiczna maleje od tlenu do polonu wraz z elektroujemnością. Tlen jest gazem, pozostałe pierwiastki są ciałami stałymi. Tlenowce są pierwiastkami bardziej aktywnymi jako utleniacze od azotowcówz powodu większej elektroujemności. Szybko utleniają litowce, nieco wolniej berylowce, reagują także z innymi metalami, wolno także z niektórymi metalami półszlachetnymi i szlachetnymi, takimi jak miedź, srebroi rtęć, tworząc tlenki lub sole (siarczki, selenki, tellurki, polonki). Siarka, selen, tellur i polon łączą się bezpośrednio z tlenem dając tlenki o właściwościach kwasowych, rosnących wraz ze stopniem utlenienia tlenowca (SO2 bezwodnik słabego kwasu H2SO3, SO3 bezwodnik mocnego kwasu H2SO4).
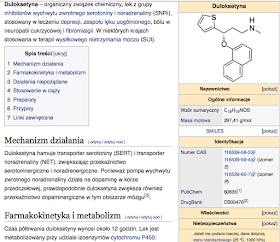
1) Tlen (O, łac. Oxygenium) - jest to pierwiastek chemiczny o liczbie atomowej 8, niemetal z grupy tlenowców w układzie okresowym. Stabilnymi izotopami tlenu są 16O (stanowi ponad 99% tlenu naturalnego), 17O oraz 18O. Tlen w stanie wolnym występuje w postaci cząsteczek dwuatomowych O2 oraz trójatomowych – ozonu O3 (głównie w ozonosferze). Szczególną jego odmianą jest odkryty w latach 90. XX w. „czerwony tlen” o wzorze O4.
Tlen jest paramagnetykiem. Ciekły tlen ma barwę niebieską. Stały tlen znany jest w sześciu odmianach alotropowych.
Tlen jest paramagnetykiem. Ciekły tlen ma barwę niebieską. Stały tlen znany jest w sześciu odmianach alotropowych.
Występowanie: Tlen jest najbardziej rozpowszechnionym pierwiastkiem na Ziemi – zawartość tlenu w jej skorupie wynosi 46,4%. Stanowi też 20,95% objętości atmosfery ziemskiej (23,25% wagowych). W postaci związków z innymi pierwiastkami wchodzi w skład hydrosfery(gdzie jego zawartość wynosi około 89% – woda) i litosfery jako tlenki (np. krzemionka (piasek) zawiera ok. 53% tlenu). W przyrodzie obieg tlenu odbywa się w cyklu zamkniętym. Rozpuszczalność tlenu w wodzie słodkiej wynosi 8,3 mg/l, a w wodzie słonej (3,5% soli) 6,6 mg/l (25 °C, 1 atm.). Tlen jest około dwa razy lepiej rozpuszczalny w wodzie niż azot. Rozpuszczalność powietrza w wodzie wynosi 23 mg/l (25 °C, 1 atm.); powietrze rozpuszczone w wodzie zawiera 35,6% tlenu.
Historia: Uznaje się, że tlen został odkryty przez Carla Sheelego przed 1773, ale odkrycie nie zostało opublikowane do 1777. W tym czasie za odkrywcę tlenu od dwóch lat uznawany był Joseph Priestley, który otrzymał tlen ogrzewając tlenek rtęci(II) i zbierając wydzielający się gaz.
(...) Historyk alchemii Roman Bugaj wskazał, że tlen został odkryty już XVII wieku przez Michała Sędziwoja, który nazywał go, między innymi, „pokarmem żywota” (łac. cibus vitae) i „duchem świata” (łac. spiritus mundi)[10]. Sędziwój wiedział, że „pokarm żywota, ukryty w powietrzu” jest niezbędny do życia i że przedostaje się z powietrza do krwi. Otrzymał go w drodze rozkładu saletry potasowej, który zachodził podczas jej prażenia; swoje doświadczenie opisał w dziele Dwanaście traktatów o kamieniu filozofów (1604). Stwierdził, że saletra jest ciałem złożonym, zawierającym „duch świata” (tak nazwał tlen, uznając go za kamień filozoficzny), umożliwiającym życie ludzi i zwierząt.
Głównym powodem ogromnego zainteresowania jego pracą był nowy kierunek filozofii alchemicznej, jaki nadał Sędziwój. Novum Lumen Chymicum napisane było w jasny jak na owe czasy sposób, oparte na doświadczeniach praktycznych, i nadając nowy kierunek badaniom alchemicznym. Tym kierunkiem było powietrze i jego rola w procesach oddychania i spalania. Jak wynika z pracy Sędziwoja, w powietrzu znajduje się ukryty pokarm życia, który zestalony jest w saletrze potasowej – przez Sędziwoja nazwaną solą filozoficzną lub magnesem. Dzisiaj nazywamy ten składnik tlenem. W czasach, w których żył Sędziwój, pojęcia pierwiastka chemicznego i gazu jeszcze nie istniały. W związku z tym teksty Sędziwoja są trudne do rozszyfrowania. Niemniej jednak opracował rewolucyjną teorię opartą na właściwościach chemicznych saletryi ta teoria przyczyniła się do olbrzymiego rozwoju (przez eksperymenty laboratoryjne) zrozumienia procesów spalania i oddychania. Program eksperymentalny przeprowadzany był w różnych ośrodkach (pracowniach alchemicznych przy dworach i uniwersytetach) w całej Europie, a w szczególności w Anglii na uniwersytecie w Oxford. Ogłaszając drukiem swą pracę Novum Lumen Chymicum, Sędziwój w zasadniczy sposób zmienił kierunek badań alchemicznych – badania te w ostateczności doprowadziły do odkrycia tlenu i do ogłoszenia nowoczesnej teorii spalania przez Antoine Lavoisiera w 1774 r.

Źródło: Wikipedia. Michał Sędziwój 1556-1636.
(...) Ciekły tlen po raz pierwszy otrzymali profesorowie Uniwersytetu Jagiellońskiego, Zygmunt Wróblewski i Karol Olszewski, 5 kwietnia 1883. Wcześniej, w 1877, mgłę skroplonego tlenu zaobserwowali niezależnie Szwed Raoul Pictet i Francuz Louis-Paul Cailletet.
Łacińska nazwa tlenu oxygenium (z greckiego oksy, kwaśny, i gennao, rodzę), wprowadzona została przez Antoine'a Lavoisiera.
Polską nazwą „tlen” (od słowa „tlić”) zaproponował Jan Oczapowski przed rokiem 1851 i została ona zaakceptowana przez większość polskiego środowiska chemicznego w ciągu ok. 10 lat. Wcześniejsza polska nazwa „kwasoród” była dosłownym tłumaczeniem łacińskiej, a wprowadził ją Jędrzej Śniadecki.
Rola tlenu w przyrodzie: Tlen jest pierwiastkiem biogennym. Jest niezbędny organizmom tlenowym do przeprowadzenia fosforylacji oksydacyjnej będącej najważniejszym etapem oddychania. Niektóre organizmy beztlenowe giną w obecności niewielkich ilości wolnego tlenu. Organizm przeciętnego dorosłego człowieka zużywa w ciągu minuty około 200 ml (0,3 g) tlenu. Oddychanie czystym tlenem jest dość niebezpieczne, ponieważ podnosi on ciśnienie krwi i wywołuje kwasicę. Niedobór tlenu staje się niebezpieczny dla życia, gdy jego zawartość w powietrzu spada poniżej 10–12%.
Zwierzęta wykorzystują go w procesie oddychania tlenowego w celu otrzymania energii:
Otrzymywanie w warunkach laboratoryjnych
ZASTOSOWANIE TLENU: Tlen jest stosowany w medycynie, do sporządzania mieszanek oddechowych do nurkowania, w przemyśle jako utleniacz (na przykład w palnikach acetylenowo-tlenowych).
ZWIĄZKI TLENU: Tlen wchodzi w skład wielu związków chemicznych o dużym znaczeniu przemysłowym: tlenków (w szczególności wody oraz dwutlenku węgla), nadtlenków (w szczególności nadtlenku wodoru), kwasów tlenowych, zasad. Jest też składnikiem większości związków organicznych o znaczeniu biologicznym, przykładowo białek i tłuszczy.
Oprócz anionów tlenkowych, ozonkowych, podtlenkowych, ponadtlenkowych i nadtlenkowych znane są związki, w których tlen występuje w podsieci kationowej. Jest to kation oksygenylowy O
+2
w związku O2PtF6(heksafluoroplatynian oksygenylowy). Kation ten może być stabilizowany przeciwjonem anionowym o silniejszych właściwościach ox-bas od tlenu lub red-ac od kationu oksygenylowego.
"Uwagi o tlenie (Oxygenium)" - Jan Oczapowski - 1853 r., źródło: "Chemik Polski":
Im dalej nauki ścisłe postępuj w odkrywaniu nowych tajemnic przy
rodzenia, tem większa czu si daje potrzeba ścisłych i zrozumiałych wy
razów do tłomaczenia ich przyczyn służących. Tajemnice natury, s to
prawdy ukryte a ich wyrazy s narzędzia do wyrabiania obrazu myśli po
trzebne; gdy za naukowe obrazy myśli maj by wystawione na widok
publiczny, musiemy je malowa narzędziami i kolorytem do mowy pospo
litej zbliżonym. „Język chemii, mówi Jan ŚniadecH (T. III, s. 195), tak jak
każdej innej nauki, zbliża si powinien ile można do języka pospolitego.
To prawidło zawiera w sobie ważn dla nas przestrogę, a mianowicie wów
czas gdy chemja nietylko ju dla nauk stała si ważnym przedmiotem, ale
dla przemysłu, rolnictwa i medycyny. Z wyżej rozwiniętego rozbioru sło
wnictwa
2) najważniejszym wypadkiem jest wprowadzenie do nauki tlenu
w miejsce kwasorodu. Ale to wprowadzenie nieznanego dotąd wyrazu do świątyni nauk,
bez pewnego usprawiedliwienia i dowodu osta si nie może: bo pewno nie
jeden z pomiędzy nas wyrzeknie, że tlen ani si zaszczyca związkiem
z mow pospolitą, ani lepiój przedstawi może nadane sobie znaczenie.
By godnie odpowiedzie na podobny zarzut, życzyłbym zwróci uwa
g uczonych mężów, na rozwiązanie dwóch następujących twierdzeń: 1) że
kwasoród używany do tłomaczenia praw chemicznych, często prowadzi
uczniów do fałszywego pojęcia rzeczy; 2) że jego zastępca tlen, jaśniej
i zrozumiałej tłomaczy może wszystkie własności i związki chemiczne.
Nie będzie tu zbyteczn rzecz powtórzy słuszne, gruntowne, z roz
bioru niniejszego słownictwa wynikające zdanie, że dawny Jędrz. Sniadec
kiego kwasoród, w obecnym stanie chemji, jako wyraz niedokładny i nie
właściwy, musi mie swego zastępcę. Dowodem tego jest, że nawet nie
którzy nasi chemicy mianowicie Zdzitowriecki, Bełza i RogojsJci, w miejsce
kwasorodu rozmaite proponuj wyrazy. Który z tych kandydatów tak
ważn w nauce zajmie posadę, to nam pokaże czas i powszechne zezwo
lenie. Wówczas gdy doświadczenie i postęd nauki niszczył zasady dawnej
szkoły flogistonu, Lavoisier, Ouyton-Moweau i Bertolet wprowadzili do no
menklatury nowe wyrazy ozygdne, hydrogene, nitrog&ne, które najpierwszy
chemik polski Jędrzój ŚniadecU, według praw analogji, przełożył na kwa
soród, wodoród i saletroród, a następnie użył je do rozwinięcia i wydosko
nalenia swoich początków chemji. Odtąd te nazwy weszły w powszechne
użycie i zamieniły si w nałóg naszej mowy. Ale ważnoś jasnego wy
kładu nauki częstokro wymaga ścisłej analizy technicznych wyrazów przed
stawiających natur rzeczy bez względu na ich niewłaściwe użycie i nałóg
naszej mowy Proste ciało oxygene, dla tego u nas nazwano kwasorodem, że ma
rzeczywist własnoś łączy si w danych stosunkach z innemi ciałami
i rodzi kwasy; stąd te powstały inne złożone słowa: niedokwasek, nie
dokwas różnych numerów, kwasorodek, kwasorodnik, dalej kwas, podkwas,
dokwas i przekwas, bez oznaczenia czem te ciała złożone s i czem by
powinny. Wielka niedokładnoś tych zjawisk ztąd pochodzi: 1) że w nich
nie masz kwasu, który si przez wyraz przypomina; 2) że nie sam tylko
kwasoród przez połączenia rodzi kwasy, ale to samo robi siarka, wodór,
chlor, jod, brom, selen i wiele innych. Trzymając si zatem ściśle analo
gji, te wszystkie ciała musz by kwasorodami, co rzeczywiście do prawdy
nie jest podobne. W ostatnich latach wykładu chemji sam Jędrzśj ŚniadecU
czuł dobrze niedokładnoś takich wyraże dowodząc publicznie, „że
nie sam tylko kwasoród ma własnoś kwaszenia, ale s inne ciała rodzące
kwasy". Dla tych samych powodów dzisiejsi nasi chemicy wyrzucaj z na
uki kwasoród. wodoród, saletroród, wyrazy niewłaściwe i niemogące obok
innych ciał w naukowśm znaczeniu utrzyma swój gatunkowej rodowości.
Każda rzecz ma swój początek, wzrost i koniec: póki w chemji nie znano
innych kwasów, bezwątpienia kwasoród dobrze przedstawiał ciało rodzące
kwasy, ale odtąd jak niezaprzeczone doświadczenia okazały, że inne proste
ciała, bez pomocy kwasorodu, wchodząc w chemiczne związki, tworz kwa
sy, wyłączne prawo kwasorodu upadło. Odtąd ju samowładny kwasoród
fałszywie tłomaczący - natur rzeczy, stał si dla nauki ciężarem; bo nie
właściwoś zawarta w jego treści, odbijała si wszędzie i we wszystkich
tego rodzaju nazwiskach. Jednakże tak ważna w dzisiejszym czasie nauka
chemji, wielk przynosząca korzyś w różnych gałęziach przemysłu krajo
wego, w naukach, w potrzebach życia i w medycynie, musi by jasna, do
kładna, ścisła i zrozumiała; zatem jej język powinien by prosty, jedno
znaczny i każdemu przystępny. Aby więc jaknajprędzej uwolni si z la
biryntu w którym dotąd przewodniczył kwasoród, aby w świątyni tak
znakomitej nauki rozjaśni i utrzyma światło prawdy, koniecznie wypada
przystąpi do wyrugowania z niej nietylko kwasorodu ale i wszystkich
innych wyrazów na ród zakończonych.
Nim przystąpi do wytłomaczenia, dla czego przyjmujemy tlen w miej
sce Tcwasorodu, nieodrzeczy tu będzie przytoczy uwagi znakomitego pisa
rza Jana Śniadeekiego, o tworzeniu nowych wyrazów.
^Jak dawniej matematyka, mówi on, tak dzi chemja, w liczbach
i znakach ogólnych ma język symboliczny prawie powszechnie dający si
czyta i rozumieć, byleby od swśj zwyczajnej i wszystkim znanej postaci
nie odśtępywały. Ten szacowny przymiot powszechnej zrozumiałości wiel
k jest pobudk do odrzucenia wszystkich przemian i nowości, jakie, nie
któr y nawet znakomici chemicy chc do słownictwa wprowadzać, mnożąc
niepotrzebnie liczb wyrazów niezrozumiałych, naszej mowie przeciwnych
i z analogj rzeczy niezgodnych. Mnogoś słów nie jest bogactwem języ
ka, a-le w naukach ścisłych prowadzi raczej do zamieszania ni do postępu
i Jasnego myśli wyłożenia".
„Klecenie nowych słów tam gdzie ich niepotrzeba, jest znakiem lek
komyślności i nieuszanowania narodu; bo nieprzystoi prywatnemu wedle
przywidzenia wprowadza odmian do drogiej wszystkim własności powsze
chnej; niegodzi si myśleć, że język jest dziełem dziwactwa i samowolno
ści, nie za owocem rozsądku, długiej rozwagi i powszechnego zezwolenia.
Ale, że nowe rzeczy i nowe myśli, krajowi dawniej nieznane, wymagaj
częstokro nowego nazwiska; przyciśniony tak potrzeb w tworzeniu no
wy cl wyrazów, zachowa powinien następujące przepisy: 1) wyraz nowy
powinien mie skład, zakończenie i cał fizjonomję narodową; 2) nie może
by&dla nauki twardy; 3) powinien mie precyzję czyli dosadność, dobitnoś
i
;
dobrże ustalone znaczenie, bo pierwsz mowy doskonałej własnością, jest
jasnoś i zrozumiałość; 4) starać" si należy aby wyraz nowy nie był zbyt
rożwlelfiy-i ź wielu słów sklejany; 5) najważniejszym warunkiem do tego
je#Yaenowańie analogji'V(T.I str. 196 i-197). Aby bez błędu pójś drog szacownych przepisów tak znakomitego
autora, aby dogodzi potrzebie naszego słownictwa w chemji, zachowa
żądana jasnoś i zrozumiałoś mowy, wyprowadzamy wyraz tlen z analogji
rzeczy, nie tłomacząc na polskie oxygene, ale mając na uwadze główny
tego ciała charakter, tojest: że za pomoc tlenu wszystkie ciała tleć, pali
si i w proch obraca s zdolne, bo wszystko co jest palne, łączy si z tle
nem. Taka własnoś oxygenu łączenia si z innemi ciałami, odmiany ich
pierwotnej iormy i własności bez charakterów kwasu, jest większa, wy
raźniejsza i więcej do przekonania mówiąca od niedokwasu, dokisu, i tym
podobnych kisłości zależących od pewnych stosunków ciał wchodzących
między sob w związek. A nadto gdy za przystępem kwasorodu zatli si
siarka, zaraz tworzy si kwas siarczany i siarkowy, a zatem w tćj czyn
ności tlenie siarki poprzedza ukwaszenie. Słowem tlenie i ukwaszenie ciał
s dwa wyrazy oznaczające własnoś jednego ciała oxygenium. Gdy za
kwasoród nierzetelnie przedstawiający natur rzeczy stał si ju dla nauki
nieużytecznym, musimy przyją drug nazw wynikając z jej natury.
A nawet nowo przyjęty i do chemji wprowadzony wyraz tlen, nie dla
tego może by lepszym od kwasorodu, że si w nim różne ciała tl i palą,
ale także przez to: 1) że istnieje w pobratymczych językach; 2) że w na
szym języku nie ma dotąd żadnego znaczenia; 3) że w związkach z innemi
ciałami nieprzypomina ani swego rodu ani kwasu; 4) że będąc pierworo
dnym nie ma żadnego pochodzenia; 5) że mając flzjonomję narodow jest
dobitny, któtki, jakny i zrozumiały. Taki więc wyraz możeby wygodniej
szym do tłomaczenia różnych chemicznych zjawisk, od wielu innych, fał
szywy charakter rzeczy przedstawiających wyrazów. Wielk w nim upa
trujemy wartoś z tego względu, że w naszej mowie nie ma żadnego zna
czenia: bo gdy mu nadamy żądan wartoś i ścisłe w nauce znaczenie, gdy
wprowadzimy w użycie języka chemicznego według zasad naszego słowni
ctwa, przekonamy się, że ten wyraz łatwiej i zrozumiałej nam przedstawi
to wszystko, co dotąd ćmił i mącił kwasoród.
Ze za ten wyraz nie jest polski i z mow pospolit nie ma żadnego
związku, to nie przeszkadza do używania go w języku chemicznym. „Je
żeli język słowiański (mówi Śniadecki), lub jakikolwiek pobratymczy, ma
wyraz, służy nam mogący w przekładzie wyrazów technicznych, uży go
i do naszego języka przyswoi można, bo wszystkie djalekta tego samego
języka, w takim przypadku posiłkowa si powinny".
Idąc za przepisem zasłużonego u nas męża, znaleźliśmy w dykcyona
rzu akademji Petersburskiej i w lexykonach rossyjskich wyraz starosło
wiański tlen!
) oznaczający zepsucie jakiego ciała przez tlenie, zgnicie, spróchnienie, gangrenę, czyli różne odmiany organiczne pośmiertne i nie
organiczne ciał, które bez przystępu i działania kwasorodu, miejsca mie
nie mog 2 ). Takie odmiany tlenowych ciał z objawieniem albo bez obja
wienia światła i ciepła s fenomenami działającego kwasorodu bez rodze
nia! kwasu, czyli s to skutki wynikające ze związku tego pierwiastku
z innemi ciałami. W słowiańskim więc języku tlen jest skutkiem działa
nia kwasorodu, ale w naszym języku biorąc skutek za przyczynę, niepo
pełniamy żadnego przeciw analogji błędu dla tego, że a dotąd ten wyraz
nie miał u nas żadnego znaczenia. Ściśle mówiąc, my bierzemy tlen na
oznaczenie Ciała prostego w stanie gazu oxygenium, bez względu na jego
gatunkowe własności i wprowadzamy do języka chemicznego
3
;; ztąd: tlenność_
ciał będzie ich zdolnoś do łączenia si z tlenem; utlenić, będzie na
syci jakie ciało tlenem; tlenolcwasy, będ połączenia z tlenem objawiające
własności kwasu, i tym podobne. Takim tedy sposobem wszędzie ten wy
raz: będzie si odznacza gdzie tylko tlen gra chemiczn rol bez przypo
mnienia kwasu i rodu, który w chemji nie ma żadnej wartości. Proste
zatśm ciało przez nas nazwane tlenem, wchodzi z innemi ciałami w zwią
zki i rozmaicie zmieniając swe chemiczne własności, nigdzie nie zmieni
, noJiBepiKeHt TjrfeHiio, mogący si zetlić, w proch si obrócić.
TjirbHHÓcrhb, CBOHCTBO TJiiHHaro, tlennoś ciał czyli zdolnoś do utlenia.
TAtottib, noflBepraeTca Tn.i.nj, tlić, ulega działaniu tlenu.
3amjiPbBanibCJl, zatlewa się, rozpoczą tlenie.
•SairuiTbBaHie, zatlewanie.
nepenuinmb, przetlewa się.
fJepemArdHHblu, przetlony, obrócony w proch.
PocmJlumbCJl, roztli się, rozpali się.
UemjinHHOcmb, niepodloganie tleniu.
i
) Ża pierwiastek tlenu uważałbym dawny słowiański wyraz rtlAA, cór
ruption, pourriture, ztąd w Biblji: „Skarbeie skarby na niebie", Tpfc HH lepBT*
HII TBJia TBHHTB, „gdzie ani robak ani rdza nie gryzie" (z ewangelji Ostro
mira z r. 1056, tym wyrazem przetłomaczono greckie ppwoic, 1'action de ron
ger). Pochodne prócz wymienionych TjteTBopHBiH, qui cause la corruption,
pestifere; TJIHTB, faire pourrir, putrefler; TJiHTeJiBHbiH, putrefactif; TJTŁHHBIH,
znaczy znikomy, a HeTnisHHBifl mówi si o relikwjach świętych niepodległych
zepsuciu; pocTJiHTBca w znaczeniu powyżej podanem rozpali się, jest nie uży
wane, chyba w znaczeniu zniszczenia i to nie koniecznie przez ogień.
J. Paptońshi *).
. ' ') Dowiedzieliśmy się, i równocześnie z nami, chemicy w Kopenhadze,
oczyszczając słownictwo chemiczne duńskie z obcych wyrazów, wyrzucili suurStof,
przerobiony z niemieckiego Sauerstoff, i zgodzili si na wprowadzenie
natomiast wyrazu lit, pochodnego od skandynawskiego Ud, a znaczącego codo
słownie tleć, zatem ich lit, to jest nasz tlen.
TERMINY ZWIĄZANE Z TLENEM:
*Desaturacja – stan, w którym obniżona jest saturacja krwi tlenem. Oceniana jest za pomocą wskaźnika desaturacji tlenem, ODI (z ang. oxygen desaturation index). Jako „zdarzenie desaturacyjne” określa się obniżenie saturacji o 4% w stosunku do linii bazowej. Występuje np. podczas zespołu bezdechu śródsennego.
*Dyzoksja - niewłaściwe (zwykle obniżone) zużycie tlenu pomimo odpowiedniej dostępności i ciśnienia parcjalnego pO2.
*Oksydowanie – proces pokrywania powierzchni metali cienką warstwą ich tlenków (przeciw korozji i dla ozdoby). Oksydowanie można przeprowadzać metodą chemiczną (np. zanurzanie przedmiotów stalowych we wrzącym stężonym roztworze wodorotlenku sodu i azotanu srebra) lub metodą elektrolityczną (w procesie anodowego utleniania).
Pol: Przedstaw za pomocą diagramów energetycznych orbitali molekularnych układy trzech konfiguracji elektronowych tlenu cząsteczkowego: a) trypletowy stan podstawowy 3Σg−; tlen singletowy w stanie wzbudzonym 1Δg; tlen singletowy w stanie wzbudzonym 1Σg+ + Opisz różnice występujące pomiędzy owymi stanami.
2) Siarka (S, łac. Sulphur) - jest to pierwiastek chemiczny, niemetal z bloku p w układzie okresowym.
Izotopy stabilne siarki to 32S, 33S, 34S i 36S.
Siarka ma kilka odmian alotropowych, z których trzy najważniejsze to siarka rombowa, jednoskośna i amorficzna.
Jest rozpuszczalna w dwusiarczku węgla, słabo rozpuszcza się w etanolu, benzeniei eterze dietylowym. Jej rozpuszczalność w wodzie jest minimalna – 5 μg/kg (25 °C).
W zwykłej temperaturze jest mało aktywna. Bardzo łatwo łączy się tylko z fluorem, trudniej z chlorem. Z innymi pierwiastkami, jak np. z wodorem, łączy się dopiero w podwyższonej temperaturze. Z metalami tworzy po ogrzaniu siarczki, przy czym reakcje te są silnie egzotermiczne, w konsekwencji zapoczątkowana reakcja syntezyprzebiega dalej samorzutnie nieraz z rozżarzeniem mieszaniny. Na powietrzu, po inicjacji zapłonu, spala się samorzutnie niebieskim płomieniem do dwutlenku siarki(SO2). Dalsze utlenienie, do trójtlenku siarki, zachodzi wydajnie dopiero wobec katalizatora, np. pięciotlenku wanadu.
Ważniejsze związki siarki to kwas siarkowy, kwas siarkawy, siarkowodór oraz ich sole (odpowiednio siarczany i siarczyny, siarczki), dwutlenek siarki i tritlenek siarki. Znane są również: tlenek siarki(I)S2O, tlenek siarki(II) SO i nadtlenek siarki SO4.
Występowanie siarki: Siarka występuje m.in. w Polsce, na Sycylii, w Luizjanie i w Teksasie (USA), na Ukrainie, w Japonii, w Turkmenistanie i Uzbekistanie. Siarka występuje w osadach z neogenu (miocen - torton) w postaci wypełnień drobnych przestrzeni. Powstała w wyniku biologicznej redukcji siarczanu wapnia przez mikroorganizmy. Zawartość siarki w skale maksymalnie chodzić może do 70%, a średnio wynosi 25-30%.
Siarka występuje zarówno w stanie rodzimym, jak i w postaci wielu minerałów. Są to zarówno siarczki, jak i siarczany:
(...) Ponieważ jest ważnym składnikiem białek roślinnych i zwierzęcych, występuje w paliwach kopalnych będących pokładami obumarłych tkanek (szczególnie węgiel kamienny i ropa naftowa). Siarka pod względem rozpowszechnienia w skorupie ziemskiej zajmuje 16 miejsce. Jej całkowita zawartość w skorupie ziemskiej wynosi 0,026% wagowych.

Źródło: Wikipedia. Płonąca siarka.

Źródło: Wikipedia. Siarka w postaci granulowanej.

Źródło: Wikipedia. Kryształy siarki w toluenie.
(...)
Wydobycie i produkcja przemysłowa: Produkcja siarki na świecie szacowana jest na około 60 mln ton rocznie. Siarka otrzymywana jest poprzez odsiarczanie spalin i paliw kopalnych, eksploatację złóż siarki rodzimej oraz poprzez wyprażanie rud siarczkowych (np. pirytu).
Wydobycie siarki rodzimej spadło znacząco ze względu na znaczący wzrost produkcji siarki z odzysku z zasiarczonych złóż gazu ziemnego i ropy naftowej. Obecnie ponad 90% siarki uzyskuje się z odsiarczania spalin i paliw.
Odzysk siarki z ropy naftowej jest prowadzony metodą znaną jako proces Clausa. Polega na działaniu na H2Sz ropy powietrzem lub tlenem:
*Proces Clausa – proces odsiarczania gazu poprzez odzyskiwanie elementarnej siarki z siarkowodoru (H2S). Został opracowany przez chemika Carla Friedricha Clausa. Zmodyfikowany proces Clausa stał się standardowym procesem stosowanym w instalacjach przemysłowych.
Historia: Proces wynalazł Carl Friedrich Claus, któremu pod koniec 1883 roku został przyznany patent. Metoda została znacząco zmodyfikowana przez niemiecką firmę IG Farben. Zarówno w Stanach Zjednoczonych, jak i na całym świecie przetwarza się większość otrzymywanego kwaśnego gazu. Szacuje się, że na świecie około 90 do 95% odzyskanej siarki pochodzi z instalacji wykorzystujących proces Clausa.
Opis metody: Proces opiera się na utlenieniu siarkowodoru do wolnej siarki. Wyróżnia się w nim dwa etapy – termiczny oraz katalityczny. Etap termiczny przebiega w tzw. kotle Clausa w wysokiej temperaturze (1000 – 1400 °C). Do palników kotła wprowadzona zostaje mieszanina gazu kwaśnego z powietrzem. Około jednej trzeciej siarkowodoru spala się według reakcji:
3H2S + 1.5O2 → 2H2S + SO2 + H2O
Nieprzereagowany siarkowodór przechodzi do etapu katalitycznego i reaguje z wytworzonym w etapie termicznym dwutlenkiem siarki w niższej temperaturze (200-350 °C)[3] tworząc siarkę. Proces przebiega zgodnie z równaniem (nazywanym często w literaturze reakcją Clausa):
2H2S + SO2 ↔ 3S + 2H2O
Zasadniczo reakcja z dwutlenkiem siarki zachodzi w etapie katalitycznym, jednak jej początek może obejmować etap termiczny. Do uzyskania konwersji na poziomie 94-98% potrzebne są od 2 do 4 etapów katalitycznych.
Instalacje Superclaus: Z uwagi na odwracalność reakcji Clausa istniała potrzeba modyfikacji procesu bazowego. W celu zwiększenia stopnia przereagowania H2S i SO2 opracowano udoskonaloną wersję procesu Clausa o nazwie Superclaus. Istotą modyfikacji było opracowanie selektywnego katalizatora tej reakcji. Jako katalizator został zastosowany aktywny tlenek metalu na nośniku. zapewniający całkowite przereagowanie siarkowodoru do siarki i minimalizację powstawania dwutlenku siarki. Instalacje, w których wykorzystano tę zmianę, to Superclaus-99 i Superclaus-99,5.
-> Superclaus-99: Istotą technologii zastosowanej w instalacji Superclaus-99 jest wprowadzenie dodatkowego rekatora, w którym odbywa się selektywne katalityczne utlenianie H2S do siarki. Zmienia się również wymagany stosunek H2S do SO2 w pracy instalacji. Dla klasycznego układu opartego na procesie Clausa wynosi on 2:1, natomiast instalacja Superclaus-99 przystosowana jest do pracy z nadmiarem siarkowodoru.
-> Superclaus-99,5: W instalacji Superclaus-99,5 wprowadza się dwa dodatkowe reaktory. W pierwszym z nich odbywa się katalityczne uwodornienie do siarkowodoru tlenku siarki, siarczku karbonylu oraz innych związków siarki, a w drugim selektywne katalityczne utlenianie siarkowodoru do siarki. Dopuszcza się pracę przy stosunku H2S do SO2 charakterystycznego dla instalacji opartej na klasycznym procesie Clausa, jednak nie jest wymagane dokładne utrzymywanie takiej wartości.
-> Stopień odzysku siarki: W klasycznym procesie Clausa uzyskuje się stopień odzysku siarki na poziomie 98-98,5%, natomiast w instalacjach Superclaus-99 i Superclaus-99,5 wzrasta on odpowiednio do 99,1% i 99,5-99,7%.
Udoskonalenia w przyszłości: W 2009 roku holenderski producent katalizatorów i sorbentów Hermes Catalysts opublikował dokument wskazujący potencjalne ulepszenia, które mogą być wykorzystane w instalacjach Claus projektowanych w przyszłości. Wyróżniono w nim elementy instalacji zapewniające zniszczenie CS2. Dwusiarczek węglapowstaje jako produkt uboczny reakcji w piecu. W wyniku badań laboratoryjnych wykazano, że pewne katalizatory mogą zniszczyć CS2 zanim dostanie się on do reaktorów katalitycznych. Nie wykluczono również stworzenia modyfikacji dotyczących optymalizacji temperatur w końcowych reaktorach. Stopień konwersji H2S rośnie wraz ze wzrostem temperatury, jednak nie wykazano, czy podnoszenie bądź obniżanie temperatury, jest rzeczywiście potrzebne.
Carl Friedrich Claus (ur. 9 listopada 1827 w Kassel , zm. 29 sierpnia 1900 r. W Londynie) był niemieckimchemikiem i wynalazcą.Opatentował proces Clausa . Claus studiował chemię na Uniwersytecie w Marburgu w Niemczech. Wyemigrował do Anglii, gdzie pracował jako chemik. Brytyjski patent na proces Clausa został mu wydany w 1883 roku. Proces Clausa jest najważniejszym procesem odsiarczania gazu , odzyskującym elementarną siarkę z gazowego siarkowodoru . Proces ten został później znacznie zmodyfikowany przez niemiecką firmę IG Farben. Jego pierwszą żoną była Mary Claus (ur. Brown). Zmarła w WiesbadenW Niemczech, 25 kwietnia 1880 roku, w wieku prawie 55 lat. Mieszkała w Wiesbaden co najmniej od 1878 roku, a jej córki, Elizabeth i Pauline, były z nią co najmniej od 1880/81 roku, wszystkie trzy w Paulinenstraße Nr. 6. 14 czerwca 1900 roku wdowiec Claus, lat 72, poślubił w Hammersmith w hrabstwie Londynu swoją drugą żonę, pannę Caroline Barry. Claus zmarł jako bogacz w Londynie w 1900 roku.
Źródło: alchetron.com - Carl Friedrich Wilhelm Claus.
(...)
Polska: W Polsce złoża siarki w stanie rodzimym występują w okolicach Tarnobrzega (Piaseczno, Machów, Jeziórko oraz Osiek), na południe od Szydłowa, w rejonie Staszowa (Grzybów) oraz koło Lubaczowa(Horyniec-Zdrój, Basznia). Polskie złoża siarki rodzimej są związane z występowaniem gipsów i wapieni, z których powstały i zalegają na głębokości od 70 do 370 metrów, tworząc pokłady o miąższości dochodzącej do 13 metrów.
(...) Obecnie w Polsce, w pobliżu Staszowa w województwie świętokrzyskim, działa należąca do Grupy Azoty jedyna na świecie kopalnia siarki (Kopalnia Siarki Osiek) stosująca metodę Frascha (metoda podziemnego wytopu).
Do złoża wtłaczana jest przegrzana woda o temperaturze powyżej 150 stopni Celsjusza, a stopiona pod jej wpływem siarka wyprowadzana jest na powierzchnię za pomocą sprężonego powietrza. Szacuje się, że do wydobycia 1 tony siarki potrzebne jest 7,5-19 ton wody.
(...) W Grzybowie (w woj. świętokrzyskim) wydobyciem siarki zajmuje się spółka należąca do Grupy Azoty, Grupa Azoty SIARKOPOL. Zakłady istnieją od 1966 r. i są jedynym przedsiębiorstwem w kraju i na świecie prowadzącym kopalniane wydobycie siarki. W zakładach wytwarzane są produkty pochodzenia siarkowego: siarka płynna, siarka granulowana, siarka mielona, siarka pastylkowana, dwusiarczek węgla oraz siarka nierozpuszczalna w disiarczku węgla.
W roku 2013 wydobyto w Polsce 0,551 mln ton siarki.
W Polsce znajduję się cztery potwierdzone złoża zasiarczonej ropy naftowej i gazu ziemnego (łącznie 822 tys. ton siarki). Produkcja siarki z tych źródeł prowadzona jest w złożach Zielin, BMB, Cychry i Górzyca (okresowo). Siarkę (w postaci kwasu siarkowego) otrzymuje się przy przeróbce rud miedzi oraz cynku i ołowiu. Proces ten ma jednak niewielki udział w przemyśle siarki i jest stosowany głównie ze względu na ochronę środowiska.
Znaczenie biologiczne: Siarka jest niezbędna do życia. Wchodzi w skład dwóch aminokwasów kodowanych - metioniny i cysteiny oraz wielu innych biologicznie ważnych związków np. witamin. Siarka pierwiastkowa w postaci pyłu działa drażniąco na błony śluzowe oczu i górnych dróg oddechowych. Nie powoduje ona silnych zatruć. Wiele związków siarki jest toksycznych.
Więcej informacji na temat metabolizmu siarki w roślinach i jego regulacji znajdziesz: tutaj.
*Mydło siarkowe – rodzaj mydła o działaniu antybakteryjnym, przeciwłojotokowym i przeciwtrądzikowym. Zawiera ok. 3–5% siarki. Zalecane jest dla osób o skórze tłustej. Może być też stosowane do mycia przetłuszczających się włosów ze skłonnościami do łupieżu. Stosując je należy uważać na usuwanie naturalnej flory skóry - przedłużające się stosowanie może doprowadzić do osłabienia barier ochronnych skóry i zaatakowania jej przez np. grzyby.
a) Heterocykliczne związki siarki o pierścieniu nasyconym:
- Ditiolany:
- Dihydrotiazepiny:
- Tiadiazole:
-> Bonobaktamy:
- Tiofeny:
--> Tioksanteny:
c) Heterocykliczne związki siarki według wielkości pierścienia:
--> Rodanki:
a) Siarczki - minerały:
a) Amidotiofosforany:
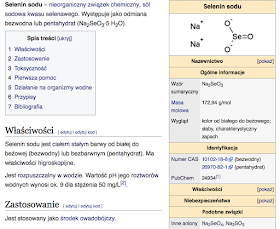
3) Selen (Se, łac. Selenium) - jest to pierwiastek chemiczny z grupy niemetali w układzie okresowym. Znanych jest kilkanaście jego izotopów z przedziału mas 65-91, z których trwałych jest 6. Pierwiastek ten został odkryty w roku 1817 przez J. J. Berzeliusa. Nazwa pochodzi od Selene (z języka starogreckiego), greckiej nazwy Księżyca i bogini która go uosabiała. Nazwano go tak, ponieważ zawsze występuje razem z tellurem, którego nazwa wywodzi się od tellus, czyli po łacinie "Ziemia".
(...) Występowanie i otrzymywanie: Występuje w skorupie ziemskiej w ilości 0,05 ppm jako zanieczyszczenie niektórych rud siarczkowych. Przemysłowo pozyskuje się go jako produkt uboczny rafinacji rud miedzi i siarki. Doprowadzony do postaci tlenku (SeO2) selen rozpuszcza się w kwasie azotowym. Następnie przepuszcza się przez tak otrzymany roztwór dwutlenek siarki. Wolny selen wytrąca się jako czerwony osad (odmiana alotropowa beta). Laboratoryjnie selen otrzymuje się redukując hydrazyną kwas selenowy (H2SeO4).
Zastosowania: Dzięki zależności przewodnictwa elektrycznego od naświetlenia selen znalazł zastosowanie w fotokomórkach i kserokopiarkach, a jego związki są stosowane w ogniwach fotowoltaicznych; jako półprzewodnik wykorzystywany był przez kilkadziesiąt lat w prostownikach selenowych(zanim nie wyparły go prostowniki funkcjonujące w oparciu o inne materiały – najpierw german, a obecnie najczęściej krzem). Ponadto używany jest jako dodatek do szkła i stali. Siarczek selenu (SeS2) stosowany jest w szamponach przeciwłupieżowych i w lekach przeciwgrzybiczych, a selenian sodu (Na2SeO3) jest silnym insektycydem.
Właściwości chemiczne: Z racji położenia w układzie okresowym selen właściwościami nieco przypomina siarkę. Kwas selenowy(VI) (H2SeO4), podobnie jak kwas siarkowy, jest kwasem mocnym o silnych właściwościach utleniających (jednak znacznie silniejszych niż kwas siarkowy). Ani spalanie selenu, ani odwadnianie kwasu selenowego nie prowadzi do uzyskania trójtlenku selenu(SeO3). Selenki (Se2−) w środowisku zasadowym łatwo przechodzą na wyższe stopnie utlenienia.
W wyniku reakcji selenu z chlorem powstaje brązowa ciecz Se2Cl2, która po ogrzaniu dysproporcjonuje do czystego selenu i bezbarwnego czterochlorku selenu (SeCl4).
*Dysproporcjonowanie (dysmutacja) – rodzaj przemiany chemicznej, w której jedno indywiduum chemiczne (pierwiastek, jon lub związek chemiczny) ulega jednoczesnej przemianie chemicznej do dwóch różnych produktów.
Odmiany alotropowe: Selen ma trzy odmiany alotropowe. Odmiana α to tzw. selen szary lub metaliczny, o kolorze srebrzystoszarym, kruchy. Utlenia się on na powietrzu powoli, nie reaguje z wodą, lecz reaguje zarówno z kwasami, jak i zasadami. Odmiana β (selen czerwony) to czerwone ciało amorficzne. Jest bardzo reaktywny, pali się na powietrzu i gwałtownie reaguje z wodą. Odmiana γ to szkliste szaroróżowe ciało stałe. Jest to odmiana pośrednia między odmianami alfa i beta – uzyskuje się ją, gwałtownie schładzając ciekły selen. Handlowo dostępny jest także bezpostaciowy selen czarny.
Związki: Selen tworzy związki analogiczne do związków siarki, np.
- selenek dimetylowy,
- tlenochlorek selenu,
- dwutlenek selenu,
- selenowodór
Związki: Selen tworzy związki analogiczne do związków siarki, np.
- selenek dimetylowy,
- tlenochlorek selenu,
- dwutlenek selenu,
- selenowodór.
Znaczenie biologiczne: Selen jest jednym z niezbędnych mikroelementów i musi być dostarczany w pożywieniu. Zawartość selenu w produktach spożywczych różni się znacznie, co związane jest z dużymi różnicami w zawartości selenu w glebie i wodzie w różnych częściach świata. Gleby na terenie Polski są uważane za ubogie w selen.
Źródła selenu w pożywieniu: zboża, mięso, jaja, nabiał, ryby i skorupiaki. Nie wszystkie pokarmy są dobrym źródłem selenu, bowiem pierwiastek ten nie w każdej postaci jest dobrze wchłaniany w przewodzie pokarmowym. Podstawową rolę w biodostępności odgrywa forma chemiczna selenu. Najwyższą bioprzyswajalnością charakteryzuje się selen pozyskiwany z drożdży. Wchłanianie selenu wzmagają białka małomolekularne oraz witaminy (głównie A, E, C). Synergiczne działanie selenu z witaminą E przyczynia się do opóźniania procesów starzenia oraz przyspieszenia regeneracji komórek.
Jest on konieczny do prawidłowego funkcjonowania układów enzymatycznych. Najważniejszą jego funkcją jest tworzenie silnego antyutleniacza, enzymu zwanego peroksydazą glutationową. Chroni on czerwone krwinki i błony komórkowe przed szkodliwym wpływem wolnych rodników. Zachowanie odpowiedniego poziomu selenu jest istotne w zespole bezdechu sennego, gdzie może dochodzić do wystąpienia stresu oksydacyjnego.
(...)
Ważny jest także dla funkcjonowania układu odpornościowego oraz tarczycy. Wraz z innymi przeciwutleniaczami chroni serce przed działaniem wolnych rodników, pomaga w walce z depresją, przemęczeniem i nadmierną nerwowością. Redukuje ilość szkodliwych związków przyczyniających się do powstawania reumatoidalnego zapalenia stawów – podawanie selenu łagodzi objawy choroby aż u 40% chorych.
U mężczyzn połowa selenu akumulowanego w organizmie znajduje się w jądrach i gruczołach płciowych, a także w produkowanej przez nich spermie, wpływając w ten sposób na podtrzymywanie sprawności seksualnej mężczyzn.
Selen zapobiega powstawaniu zmian nowotworowych w różnych narządach i tkankach. Liczne badania potwierdzają, że selen zmniejsza ryzyko występowania wszystkich nowotworów, a w szczególności raka wątroby, prostaty, jelita grubego oraz raka płuc. Bardzo ważne znaczenie odgrywa suplementacja selenem przez palaczy, którzy szczególnie są narażeni na raka płuc, bowiem selen zmniejsza ryzyko zachorowania na raka płuc przez palaczy. W celu potwierdzenia roli selenu w zapobieganiu powstawania zmian nowotworowych, międzynarodowa grupa naukowców z Danii, Szwecji oraz Wielkiej Brytanii prowadzi szeroko zakrojone randomizowane badanie „Prevention of Cancer by Intervention with Selenium” (PRECISE).
W Stanach Zjednoczonych Agencja Żywności i Leków zezwoliła producentom selenowanych suplementów na podanie wskazań zdrowotnych, że „suplementacja selenem może zmniejszyć ryzyko pewnych rodzajów raka”. Zalecane przez nią dobowe spożycie selenu wynosi dla osób dorosłych 55 mikrogramów.
a) Seleniany:
4) Tellur (Te, łac. tellurium) - jest to pierwiastek chemiczny, z grupy półmetali w układzie okresowym. Nazwa pochodzi od łacińskiej nazwy Ziemi - tellus.
Charakterystyka: Tellur w postaci krystalicznej jest srebrzystobiały, miękki i kruchy )handlowo dostępny jest w postaci szarego proszku). Jest półprzewodnikiem. Reaguje ze stężonym kwasem azotowym tworząc kwas tellurawy (H2TeO3), w reakcji telluru z wodą królewską powstaje kwas tellurowy(H2TeO4). Ze stężonym gorącym kwasem siarkowym tellur reaguje tworząc roztwór o barwie czerwonej, zawierający kationy tetratellurowe Te2+4. Zabarwienie wynika z obecności 6 zdelokalizowanych elektronów π w płaskiej, kwadratowej strukturze kationów tetratellurowych. Kationy te pod wpływem wody hydrolizują z wydzieleniem czarnego osadu telluru.
|
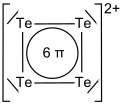 |
| Kation tetratellurowy |

Występowanie: W skorupie ziemskiej występuje on w ilości 0,005 ppm. Minerałem tego pierwiastka jest np. telluryt (TeO 2).
Odkrycie: Pierwiastek ten został odkryty w 1782 roku przez Franza-Josepha Mullera von Reichensteina.
Zastosowanie: Tellur używany jest przede wszystkim jako składnik stopów z żelazem, miedzią i ołowiem. Dodatek telluru powoduje, że stop jest łatwiejszy do obróbki. Tellur jest również używany do produkcji półprzewodników.
ZWIĄZKI TELLURU:
--> Tellurki (Minerały):
 5) Polon (Po, łac. polonium) - jest to pierwiastek chemiczny o liczbie atomowej 84, radioaktywny metal. W układzie okresowym leży w bloku p (grupa 16, okres 6). Polon bywa błędnie klasyfikowany jako półmetal, mimo że wykazuje typowe właściwości metalu.
5) Polon (Po, łac. polonium) - jest to pierwiastek chemiczny o liczbie atomowej 84, radioaktywny metal. W układzie okresowym leży w bloku p (grupa 16, okres 6). Polon bywa błędnie klasyfikowany jako półmetal, mimo że wykazuje typowe właściwości metalu.
Historia odkrycia: Pierwiastek ten został odkryty w 1898 r. przez Marię Skłodowską-Curie i Piotra Curie – w tym samym roku co rad. Curie nadała mu nazwę na cześć Polski (od łacińskiego słowa Polonia), która była wówczas pod zaborami, licząc, że odkrycie nagłośni sprawę polską na arenie międzynarodowej. Został w ten sposób prawdopodobnie pierwszym pierwiastkiem, którego nazwa odnosi się do wątku politycznego.
Właściwości radioaktywne: Polon jest silnie radioaktywnym, srebrzystoszarym metalem. Jego właściwości fizyczne i chemiczne są zbliżone do selenu. Polon jest silnie radioaktywnym, srebrzystoszarym metalem. Jego właściwości fizyczne i chemiczne są zbliżone do selenu. Jest silnym emiterem promieniowania alfa – miligram 210Po emituje tyle samo cząstek alfa co 4,5 grama 226Ra. Próbka polonu emanuje niebieską poświatą – jest to efekt wzbudzenia otaczającego ją powietrza. Jeden gram polonu wydziela 140 watów mocy, ogrzewając się przy tym do ponad 500 °C. Z tego względu był niegdyś używany jako lekkie źródło ciepła w satelitach i pojazdach kosmicznych, na przykład w radzieckich Łunochodach do ogrzewania podzespołów podczas zimnych nocy księżycowych. Obecnie jest wciąż czasem stosowany jako wygodne, wysokowydajne źródło cząstek alfa.
(...)
Izotopy: Polon ma 33 izotopy z przedziału mas 188–220. Nie ma stabilnych izotopów. Najtrwalszy izotop 209, o okresie połowicznego rozpadu wynoszącym 103 lata, nie występuje naturalnie. Jego nukleosynteza, podobnie jak izotopu 208 (t½ = 2,9 lat), wymaga bombardowania ołowiu lub bizmutu naładowanymi cząstkami (protonami, deuteronami lub cząstkami α) w synchrotronie. Najtrwalszym naturalnie występującym izotopem jest 210Po o t½ = 138,3 dnia. Produktem jego rozpadu jest stabilny izotop ołowiu 206Pb. Praktycznie wszystkie badania polonu prowadzone są z użyciem izotopu 210.
Występowanie: Polon występuje w skorupie ziemskiej w śladowych ilościach w rudach uranu oraz jako tlenek. Jego stężenie w tych rudach jest jednak tak małe (7,4×10−11 g 210Po / g 238U), że przemysłowo opłaca się go otrzymywać na drodze bombardowania bizmutu neutronami:
Powstały 210Po jest oczyszczany przez destylację próżniową. Roczne naświetlanie kilograma bizmutu strumieniem 1024 n/(cm²·s) daje ok. 25 mg 210Po, co jest ilością niemożliwą do wyizolowania ze źródeł naturalnych. Światowa produkcja tego izotopu wynosi ok. 100 gramów rocznie. Ilość polonu w skorupie ziemskiej jest na tyle mała, że nie podaje się żadnych, nawet szacunkowych danych na ten temat. Jego zawartość w wodzie morskiej oceniana jest na 2×10−11 ppb.
Związki chemiczne: Znanych jest kilkanaście związków chemicznych polonu: tlenki PoO2 i PoO3, wodorek PoH2, wodorotlenek Po(OH)2, halogenki, np. PoCl2, PoBr4, siarczek PoS i związki metaloorganiczne. Związki te nie mają jednak praktycznego zastosowania ze względu na gigantyczny koszt produkcji samego polonu. PoF6 był używany w latach sześćdziesiątych XX wieku w ZSRR jako aktywator lakierów luminescencyjnych stosowanych w świetlówkach, obecnie został jednak zastąpiony tańszymi zamiennikami.
Oddziaływanie na organizmy żywe: Polon jest silnie toksyczny. LD50 dla polonu wynosi ok. 1 mikrograma, co czyni go około 50 000 razy bardziej trującym niż cyjanowodór. Emitowane cząstki alfa z łatwością niszczą strukturę tkanek, jeśli tylko dostanie się on tam poprzez inhalację, połknięcie lub absorpcję. Polon nie przenika przez skórę, toteż znajdując się na zewnątrz ciała nie stanowi tak wielkiego zagrożenia. Izotopy polonu 212Po, 214Poi 218Po, jako produkty rozpadu radonu, w śladowych ilościach znajdują się w powietrzu wewnątrz pomieszczeń. Dodatkowe zagrożenie stwarza palenie tytoniu, do którego liści przenika polon obecny w nawozach fosforowych. Duże stężenie 210Po stwierdzono w organizmie Aleksandra Litwinienki, otrutego w listopadzie 2006 roku w Londynie. Sól polonu, prawdopodobnie azotan, pochodziła z jednego z rosyjskich reaktorów jądrowych i została mu podana w herbacie. Litwinienko zmarł po 23 dniach. Istnieją podejrzenia, że także polonem został otruty Jasir Arafat.
6) Liwermor (Lv) - pierwiastek chemiczny z bloku p, leżący w układzie okresowym pod polonem. 19 czerwca 2000 roku naukowcy z Dubnej zaobserwowali pojedynczy rozpad atomu pierwiastka 116. W 2001 roku udało się im otrzymać dwa kolejne atomy. Wyniki te zostały potwierdzone w 2003 roku w kolejnych eksperymentach. Otrzymany atom został pierwotnie zidentyfikowany jako 292Lv, co później skorygowano na 293Lv.
4820Ca + 24896Cm → 296116Lv* → 293116Lv + 3n
Odkrycie tego pierwiastka zostało uznane przez IUPAC 1 czerwca 2011 roku.
Rzekome odkrycie: W 1999 roku badacze z Lawrence Berkeley National Laboratoryogłosili odkrycie pierwiastków 116 i 118 w publikacji w czasopiśmie Physical Review Letters. Rok później ukazała się publikacja, w której autorzy opisywali niemożność powtórzenia otrzymania tych pierwiastków. Po przeprowadzonym dochodzeniu w lipcu 2002 roku dyrektor Lawrence Berkeley National Laboratory przyznał, że rzekome odkrycie zostało sfabrykowane przez Wiktora Ninowa, głównego autora publikacji z 1999 roku.

































































































































































































































































































































































































































































































































































































































Brak komentarzy:
Prześlij komentarz