Węglowodory aromatyczne (WA) - są to cykliczne węglowodory spełniające warunki aromatyczności. Zazwyczaj występują w nich sprzężone wiązania wielokrotne, czyli zamknięty układ naprzemiennie położonych wiązań podwójnych i pojedynczych między atomami węgla. We wszystkich atomach pierścienia aromatycznego zachodzi hybrydyzacja sp2, dzięki czemu cząsteczki są płaskie (o ile dodatkowe czynniki stereochemiczne nie wymuszają odchyłek, jak np. dla fullerenu C60).
Układ ten powoduje, że wiązania "rozmywają" się tak, że nie można dokładnie ustalić, które z nich są podwójne, a która pojedyncze. Jedna z metod formalnego opisu tego zjawiska opiera się na założeniu występowania rezonansu chemicznego.
Mechanika kwantowa pozwala wyznaczyć funkcje falowe elektronów. Elektrony tworzące wiązania π zajmują kolejne orbitale cząsteczkowe, zgodnie z zasadami stosowanymi do orbitali atomowych. Obsadzanie kolejnych orbitali π przez pary elektronowe rozpoczyna się od tych, które mają najmniejszą energię. Obliczona łączna gęstość elektronowana trzech orbitalach wiążących wskazuje, że w stanie podstawowym "rozchodzą" się po równo po wszystkich atomach w pierścieniu. Energia całej cząsteczki jest wówczas mniejsza od energii obliczonej dla struktury Kekulégo (3 wiązania C-C i 3 wiązania C=C). Tę różnicę nazywa się „energią stabilizacji aromatycznej”, „energią stabilizacji przez sprzężenie” albo „energią rezonansu”.
O zjawisku aromatyczności: Aromatyczność związków – niebenzoidowe związki aromatyczne. Benzen oraz jego pochodne posiadają własności chemiczne nieodpowiadające wprost pojmowanemu wzorowi strukturalnemu (układ cykloheksa-1,3,5-trienu). Układ sprzężonych orbitali π obejmujący cały pierścień modyfikuje w sposób znaczący własności chemiczne, powodując, iż związki aromatyczne praktycznie nie ulegają najbardziej charakterystycznej dla układów nienasyconych reakcji addycji za to z powodzeniem można wykonać na nich reakcje substytucji elektrofilowej. Istotnym problemem jest określenie czy związki pierścieniowe posiadające większą lub mniejszą od benzenu liczbę atomów budujących pierścień oraz sprzężony układ wiązań podwójnych również będą wykazywać wszystkie cechy związków aromatycznych. Najbliższe w budowie do benzenu związki pierścieniowe, zawierające sprzężony układ wiązań podwójnych to cyklobutadien i cyklookta-1,3,5,7-tetraen:

Pomimo dużych trudności w syntezie oba te związki udało się otrzymać i przebadać ich własności chemiczne. Okazuje się, że związki te nie wykazują żadnych cech stabilizacji mezomerycznej oraz nie posiadają w ogóle własności aromatycznych. Cyklobutadien udało się uzyskać jedynie w postaci kompleksów z metalami, natomiast nie jest zdolny do istnienia w postaci wolnej (ulega natychmiastowej reakcji cykloaddycji, w której jedna cząsteczka jest dienem a druga dienofilem). Cyklooktatetraen można otrzymać w stanie wolnym jednak zachowuje się jak typowy węglowodór nienasycony.
Z tego względu należy określić, jakie kryteria spełnić musi pierścieniowy układ zawierający sprzężone wiązania podwójne, aby związek posiadał własności aromatyczne. Zastosowanie teorii orbitali molekularnych oraz reguły Hunda określającej kolejność obsadzania orbitali przez elektrony wskazuje, iż układy trwałe otrzymuje się, kiedy liczba elektronów π w pierścieniu da się wyrazić wzorem 4n+2, gdzie n to dowolna liczba naturalna lub 0. Jest to tzw. reguła aromatyczności Hückela. Benzen posiada 6 elektronów π (każdy atom węgla wnosi po jednym elektronie obsadzającym niezhybrydyzowany orbital typu p), zatem spełnia regułę Hückela dla n=1, natomiast cyklobutadien posiada 4 a cyklooktatetraen 8 elektronów π, więc oba te związki reguły tej nie spełniają. Najmniejsza liczba elektronów π, dla której reguła aromatyczności jest spełniona to 2 (n=0). Nie można jednak zrealizować układu pierścieniowego zbudowanego jedynie z dwóch atomów – najmniejszy taki układ jest trójatomowy. W cyklopropenie obecne są dwa elektrony π, jednakże wiązanie podwójne jest zlokalizowane, bowiem trzeci atom posiada hybrydyzację sp3 i nie ma możliwości powstania układu zdelokalizowanego. Przekształcenie cyklopropenu w kation powoduje zmianę hybrydyzacji trzeciego atomu (karbokationy posiadają hybrydyzację sp2). Orbital niezhybrydyzowany typu p karbokationu jest pusty i może nakładać się z orbitalami typu p sąsiadujących atomów węgla, tworząc układ zdelokalizowany o dwóch elektronach π:

Przedstawione powyżej struktury mezomeryczne wskazują, iż ładunek jest równomiernie rozproszony na wszystkie atomy węgla. Kation cyklopropenylowy jak i liczne jego pochodne udało się otrzymać w postaci soli i potwierdzić jego aromatyczny charakter. Podobnie zrealizować można układ aromatyczny w pierścieniu 7-członowym (cykloheptatrien – tropyliden). Tropyliden przekształcony w kation tropyliowy (zob. spektroskopia MS) posiada pierścień siedmioczłonowy z układem zdelokalizowanym obejmującym cały pierścień, posiadającym (podobnie jak benzen) 6 elektronów π:

6-elektronowy układ aromatyczny zrealizować również można przekształcając odpowiedni węglowodór w anion. Cyklopentadien posiada dwa, sprzężone wiązania podwójne (4 elektrony π) natomiast piąty atom węgla w pierścieniu posiada hybrydyzację sp3. Przekształcenie tego atomu w karboanion powoduje, iż przyjmuje on hybrydyzację sp2(karboaniony mogą przyjmować dowolny, charakterystyczny dla atomu węgla typ hybrydyzacji – najczęściej hybrydyzacja karboanionów jest identyczna z hybrydyzacją wyjściowej, niezjonizowanej cząsteczki, jednakże, jeżeli istnieje możliwość delokalizacji elektronów, karboaniony przyjmują hybrydyzację sp2), dostarczając dwa dodatkowe elektrony π (niezhybrydyzowany orbital typu p jest obsadzony wolną parą elektronową karboanionu):

Reguła Hückela nie ogranicza wielkości pierścienia, podjęto zatem próby otrzymania związków aromatycznych o większych pierścieniach (związki takie noszą nazwę annulenów). Okazało się, iż pierścieniowe układy ze sprzężonymi wiązaniami podwójnymi o 10 (n=2) i 14 (n=3) atomach węgla są nietrwałe i pozbawione własności aromatycznych pomimo spełniania reguły Hückela. Przyczyną braku aromatyczności w tych związkach okazały się zawady przestrzenne wynikające z naprężeń kątowych bądź braku miejsca wewnątrz pierścienia dla koniecznych atomów wodoru i barkiem możliwości przyjęcia przez te układy konformacji płaskiej. Udało się uzyskać odpowiednie pochodne tych układów pierścieniowych, pozbawione zawad sterycznych poprzez wprowadzenie odpowiednich mostków węglowodorowych i zaobserwowano dla tych pochodnych własności aromatyczne. Układ 18-węglowy (n=4) jest już na tyle dużym pierścieniem, iż zawady przestrzenne w nim nie występują – po otrzymaniu tego węglowodoru okazał się być, zgodnie z regułą Hückela, układem aromatycznym. Dla większych pierścieni własności aromatyczne, pomimo spełniania reguły Hückela ulegają zanikowi.
Układy aromatyczne nie muszą być zbudowane wyłącznie z atomów węgla. Znanych jest wiele układów heterocyklicznych posiadających własności aromatyczne. Jednymi z prostszych przedstawicieli są układy 6-elektronowe furanu, pirolu czy pirydyny:

Biorąc pod uwagę wszystkie podane wyżej informacje można zdefiniować układ aromatyczny jako:
a) związek pierścieniowy,
b) posiadający sprzężony układ wiązań podwójnych,
c) sprzężenie elektronów π obejmuje cały pierścień,
d) układ musi przyjmować konformację płaską,
e) liczba elektronów π w pierścieniu musi spełniać regułę Hückela.
Kolejne, ważne kryterium aromatyczności jest dostarczone przez spektroskopię 1H NMR. W związkach aromatycznych pojawia się zjawisko prądu pierścieniowego (w polu magnetycznym zdelokalizowane elektrony π poruszają się w pierścieniu w sposób uporządkowany, generując lokalne pole magnetyczne):

Wynikiem tego zjawiska jest duża wartość przesunięcia chemicznego protonów pierścienia aromatycznego stojących na zewnątrz tego pierścienia (δ 6,5-8 ppm) natomiast ewentualne protony znajdujące się wewnątrz pierścienia aromatycznego (protony takie są obecne w dużych pierścieniach aromatycznych, o których była mowa wyżej) dają sygnał przy ujemnych wartościach przesunięcia chemicznego. W układach niearomatycznych zjawiska tego się nie obserwuje, a protony związane z takimi pierścieniami dają sygnał rezonansowy przy przesunięciu chemicznym charakterystycznym dla alkenów, czyli w zakresie 4,5-6 ppm.
Źródło: e-biotechnologia.pl
Przykłady węglowodorów aromatycznych:
1) Benzen - jest to organiczny związek chemiczny z grupy arenów. Jest to najprostszy karbocykliczny, obojętny węglowodór aromatyczny. Jego nieorganicznym analogiem jest borazyna.
 2) Bifenyl - jest to organiczny związek chemiczny z grupy aromatycznych związków policyklicznych, dimer benzenu. Pierścienie fenylowe bifenylu nie są położone w jednej płaszczyźnie, najniższą energię ma konformacja, w której skręcone są one względem siebie o ok. 45°. Bariera energetyczna rotacji jest stosunkowo niska i wynosi ok. 6–8 kcal/mol.
2) Bifenyl - jest to organiczny związek chemiczny z grupy aromatycznych związków policyklicznych, dimer benzenu. Pierścienie fenylowe bifenylu nie są położone w jednej płaszczyźnie, najniższą energię ma konformacja, w której skręcone są one względem siebie o ok. 45°. Bariera energetyczna rotacji jest stosunkowo niska i wynosi ok. 6–8 kcal/mol.
Z powodu zahamowania rotacji pierścieni, pochodne bifenylu podstawione różnymi grupami w pozycjach orto są chiralne i występują w postaci dwóch atropoizomerów.
3) Cyklofany - jest to rodzaj organicznych związków chemicznych z grupy pochodnych węglowodorów aromatycznych, w których co najmniej dwa atomy węgla pochodzące z co najmniej jednego pierścienia aromatycznego są ze sobą połączone układem wiązań kowalencyjnych. Wśród cyklofanów znaleźć można związki o nietypowej stereochemii, np. [2.2]paracyklofan, superfan i właściwościach spektroskopowych, np. [2.2]metacyklofan, cyklofany typu "iron maiden", [6]paracyklofan. Cyklofany o dłuższych mostkach węglowych są stosowane w modelowaniu biologicznie aktywnych układów ligand-receptor.
(...) Poza niezwykłą geometrią, cyklofany typu "iron maiden" charakteryzują się ciekawymi właściwościami NMR: proton in (pokazany w strukturze na rysunku) ma jedno z najniższych znanych przesunięć chemicznych zanotowanych dla węglowodorów, δ = −4,03 ppm. Znane są cyklofany typu "iron maiden", w których "kolcem" żelaznej dziewicy jest atom wodoru oraz grupa metylowa. Do tej rodziny cyklofanów zaliczane są również fosfafany typu "iron maiden", w których atomem zwornikowym jest atom fosforu leżący niezwykle blisko pierścienia benzenowego, silafany typu "iron maiden" z atomem krzemu jako zwornikiem i wodorowym lub fluorowym "kolcem".
 4) Cykloparafenyleny - są to organiczne związki chemiczne z grupy związków makrocyklicznych, węglowodory aromatyczne zbudowane z pierścieni benzenowych połączonych w pozycjach para (tj. grup parafenylenowych lub 1,4-fenylenowych) z wytworzeniem polifenylowanej struktury makrocyklicznej. Cykloparafenyleny mogą być uważane za najkrótsze nanorurki. W latach 2008-2011 opublikowano metody otrzymania makropierścieni zbudowanych z 8-16 i 18 reszt parafenylenowych.
4) Cykloparafenyleny - są to organiczne związki chemiczne z grupy związków makrocyklicznych, węglowodory aromatyczne zbudowane z pierścieni benzenowych połączonych w pozycjach para (tj. grup parafenylenowych lub 1,4-fenylenowych) z wytworzeniem polifenylowanej struktury makrocyklicznej. Cykloparafenyleny mogą być uważane za najkrótsze nanorurki. W latach 2008-2011 opublikowano metody otrzymania makropierścieni zbudowanych z 8-16 i 18 reszt parafenylenowych.  Budowa: Cykloparafenyleny zbudowane są z zamkniętych, nierozgałęzionych łańcuchów węglowodorowych, których monomerami są reszty parafenylenowe. Z obliczeń DFT wynika, że najniższą energię mają struktury, w których pierścienie benzenowe nachylone są naprzemiennie pod kątem 33–34° dla [12] i [18]cykloparafenylenów i 18–33° dla [9]cykloparafenylenu. Alternatywna geometria wstęgi Möbiusa ma energię wyższą o 2 kcal/mol/resztę parafenylenową.
Budowa: Cykloparafenyleny zbudowane są z zamkniętych, nierozgałęzionych łańcuchów węglowodorowych, których monomerami są reszty parafenylenowe. Z obliczeń DFT wynika, że najniższą energię mają struktury, w których pierścienie benzenowe nachylone są naprzemiennie pod kątem 33–34° dla [12] i [18]cykloparafenylenów i 18–33° dla [9]cykloparafenylenu. Alternatywna geometria wstęgi Möbiusa ma energię wyższą o 2 kcal/mol/resztę parafenylenową.
5) p-Cymen - jest to organiczny związek chemiczny z grupy węglowodorów aromatycznych, pochodna benzenu. Występuje w olejkach eterycznych.
6) Difenyloacetylen: organiczny związek chemiczny z grupy węglowodorów nienasyconych, bezbarwne ciało stałe, o charakterystycznym zapachu.
 7) Duren (1, 2, 4, 5 - tetrametylobenzen) - jest to węglowodór aromatyczny używany jako rozpuszczalnik. Stosowany jest przy produkcji tworzyw sztucznych i jako czynnik sieciujący w żywicach alkidowych.
7) Duren (1, 2, 4, 5 - tetrametylobenzen) - jest to węglowodór aromatyczny używany jako rozpuszczalnik. Stosowany jest przy produkcji tworzyw sztucznych i jako czynnik sieciujący w żywicach alkidowych.
8) Etylobenzen - organiczny związek chemiczny z grupy węglowodorów aromatycznych, pochodnabenzenu. Otrzymywany w procesie alkilacji benzenu etenem w obecności katalizatora (np. chlorku glinu). Jest stosowany jest jako półprodukt do syntezy styrenu, polistyrenu, kauczuków syntetycznych oraz jako rozpuszczalnik.
9) Fenyloacetylen - związek organiczny z grupy węglowodorów nienasyconych. Jest to najprostszy aromatycznywęglowodór z wiązaniem potrójnym. W warunkach normalnych jest bezbarwną cieczą. Z fenyloacetylenu w procesie polimeryzacjiuzyskuje się polifenyloacetylen – żółty polimer przewodzący.
10) Indan - organiczny związek chemiczny zbudowany z pierścienia benzenowego i połączonego z nim pierścienia cyklopentanowego.
 11) m-Ksylen - organiczny związek chemiczny, węglowodór aromatyczny, jeden z trzech izomerycznych ksylenów. Jest to pochodna benzenu zawierająca dwie grupy metylowe przyłączone do pierścienia w położeniu meta (1,3). Inne izomery ksylenu to o-ksylen i p-ksylen. m-Ksylen rozpuszcza się w niepolarnych rozpuszczalnikach jak np. w węglowodorach aromatycznych, podobnie jak wszystkie ksyleny. m-Ksylen jest związkiem stosowanym do produkcji kwasu izoftalowego, który jest używany jako kopolimer w produkcji poli(tereftalanu etylenu), nadający mu właściwości bardziej odpowiednie do produkcji plastikowych butelek na napoje.
11) m-Ksylen - organiczny związek chemiczny, węglowodór aromatyczny, jeden z trzech izomerycznych ksylenów. Jest to pochodna benzenu zawierająca dwie grupy metylowe przyłączone do pierścienia w położeniu meta (1,3). Inne izomery ksylenu to o-ksylen i p-ksylen. m-Ksylen rozpuszcza się w niepolarnych rozpuszczalnikach jak np. w węglowodorach aromatycznych, podobnie jak wszystkie ksyleny. m-Ksylen jest związkiem stosowanym do produkcji kwasu izoftalowego, który jest używany jako kopolimer w produkcji poli(tereftalanu etylenu), nadający mu właściwości bardziej odpowiednie do produkcji plastikowych butelek na napoje. 12) p-Ksylen - organiczny związek chemiczny, węglowodór aromatyczny, jeden z trzech izomerycznych ksylenów. Jest to pochodna benzenu zawierająca dwie grupy metylowe przyłączone do pierścienia w położeniu para (1,4). Rozpuszcza się w rozpuszczalnikach niepolarnych, np. w węglowodorach aromatycznych, podobnie jak wszystkie ksyleny. Jest stosowany do wytwarzania kwasu tereftalowego, przekształcanego następnie w poli(tereftalan etylenu) (PET), który jest wykorzystywany m.in. do produkcji opakowań do żywności, np. butelek.
12) p-Ksylen - organiczny związek chemiczny, węglowodór aromatyczny, jeden z trzech izomerycznych ksylenów. Jest to pochodna benzenu zawierająca dwie grupy metylowe przyłączone do pierścienia w położeniu para (1,4). Rozpuszcza się w rozpuszczalnikach niepolarnych, np. w węglowodorach aromatycznych, podobnie jak wszystkie ksyleny. Jest stosowany do wytwarzania kwasu tereftalowego, przekształcanego następnie w poli(tereftalan etylenu) (PET), który jest wykorzystywany m.in. do produkcji opakowań do żywności, np. butelek. 13) o-Ksylen - organiczny związek chemiczny, węglowodór aromatyczny, jeden z trzech izomerycznych ksylenów. Jest to pochodna benzenu zawierająca dwie grupy metylowe przyłączone do pierścienia w położeniu orto (1,2). Jest otrzymywany poprzez destylację mieszaniny izomerów ksylenu (o-ksylenu, m-ksylenu i p-ksylenu).
13) o-Ksylen - organiczny związek chemiczny, węglowodór aromatyczny, jeden z trzech izomerycznych ksylenów. Jest to pochodna benzenu zawierająca dwie grupy metylowe przyłączone do pierścienia w położeniu orto (1,2). Jest otrzymywany poprzez destylację mieszaniny izomerów ksylenu (o-ksylenu, m-ksylenu i p-ksylenu).
Rozpuszcza się w rozpuszczalnikach niepolarnych, np. w węglowodorach aromatycznych. Jest stosowany do produkcji bezwodnika ftalowego:
Utlenianie katalityczne o-ksylenu prowadzone w fazie gazowej w temp. 300–400 daje bezwodnik ftalowy praktycznie ilościowo.
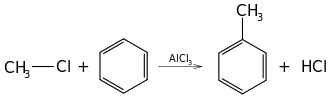
 14) Kumen (2-fenylopropan, izopropylobenzen) - organiczny związek chemiczny z grupy węglowodorów aromatycznych zbudowany z pierścienia benzenowego połączonego z węglem 2 propanu. Jest cieczą otrzymywaną z benzenu przez alkilowaniepropenem w obecności katalizatora (np. chlorku glinu AlCl3) lub ze smoły węglowej i ropy naftowej w procesie reformingu. Po raz pierwszy został otrzymany w 1841 roku przez Charles'a Gerhardta i Auguste'a Cahours'a w wyniku destylacji kwasu kuminowego ((CH3)2CHC6H4COOH) z wapnem palonym. Izomerami kumenu są m.in. pseudokumen (1,2,4-trimetylobenzen) i mezytylen (1,3,5-trimetylobenzen).
14) Kumen (2-fenylopropan, izopropylobenzen) - organiczny związek chemiczny z grupy węglowodorów aromatycznych zbudowany z pierścienia benzenowego połączonego z węglem 2 propanu. Jest cieczą otrzymywaną z benzenu przez alkilowaniepropenem w obecności katalizatora (np. chlorku glinu AlCl3) lub ze smoły węglowej i ropy naftowej w procesie reformingu. Po raz pierwszy został otrzymany w 1841 roku przez Charles'a Gerhardta i Auguste'a Cahours'a w wyniku destylacji kwasu kuminowego ((CH3)2CHC6H4COOH) z wapnem palonym. Izomerami kumenu są m.in. pseudokumen (1,2,4-trimetylobenzen) i mezytylen (1,3,5-trimetylobenzen).- Zastosowanie
- w syntezie organicznej do jednoczesnej produkcji fenolu i acetonu
- rozpuszczalnik farb, lakierów
- dodatek do paliw lotniczych (zwiększa liczbę oktanową)
 15) Mezytylen (1, 3, 5 - trimetylobenzen), C6H3(CH3)3 – jest to organiczny związek chemiczny z grupy węglowodorów aromatycznych. Jest trujący. Jego izomerami są m.in. kumen (izopropylobenzen, Ph-Pr) i pseudokumen (1,2,4 - trimetylobenzen). Otrzymuje się go ze smoły węglowej lub syntetycznie przez polikondensację acetonu lub polimeryzację propynu. Jest wykorzystywany w syntezie organicznej oraz jako rozpuszczalnik.
15) Mezytylen (1, 3, 5 - trimetylobenzen), C6H3(CH3)3 – jest to organiczny związek chemiczny z grupy węglowodorów aromatycznych. Jest trujący. Jego izomerami są m.in. kumen (izopropylobenzen, Ph-Pr) i pseudokumen (1,2,4 - trimetylobenzen). Otrzymuje się go ze smoły węglowej lub syntetycznie przez polikondensację acetonu lub polimeryzację propynu. Jest wykorzystywany w syntezie organicznej oraz jako rozpuszczalnik. 16) Stylben (Stilben) - jest to organiczny związek chemiczny z grupy wielopierścieniowych węglowodorów aromatycznych i nienasyconych. Występuje w dwóch odmianach izomerycznych trans i cis (izostilben). Tworzy bezbarwne lub żółtawe kryształy. Łatwo polimeryzuje tworząc polimer – polistilben. Szkielet stilbenu obecny jest w resweratrolu, przeciwutleniaczu występującym w owocach.
16) Stylben (Stilben) - jest to organiczny związek chemiczny z grupy wielopierścieniowych węglowodorów aromatycznych i nienasyconych. Występuje w dwóch odmianach izomerycznych trans i cis (izostilben). Tworzy bezbarwne lub żółtawe kryształy. Łatwo polimeryzuje tworząc polimer – polistilben. Szkielet stilbenu obecny jest w resweratrolu, przeciwutleniaczu występującym w owocach.
Stosowany jako krystaliczny scyntylator (szczególnie w pomiarach koincydencyjnych), o wydajności ok. 60% antracenu i krótkim czasie zaniku scyntylacji (7×10−9 s; przy wzbudzeniu cząstką alfa lub kwantem gamma). Wpływ energii i typu cząstek na wydajność jest podobny jak w antracenie. Maksimum widma emisyjnego przypada na 410 nm.
17) Styren (Winylobenzen) - organiczny związek chemiczny, węglowodór aromatyczny z alkenowym łańcuchem bocznym. Jest związkiem wyjściowym do produkcji polistyrenu.
Historia: W Polsce przed wybuchem II wojny światowej proces technologiczny otrzymywania styrenu opracował polski chemik Kazimierz Smoleński.
 18) Tetralina (1, 2, 3, 4 - tetrahydronaftalen, C10H12) - jest to węglowodór aromatyczny powstały w wyniku katalitycznej redukcji naftalenu.
18) Tetralina (1, 2, 3, 4 - tetrahydronaftalen, C10H12) - jest to węglowodór aromatyczny powstały w wyniku katalitycznej redukcji naftalenu. 
Tetralina używana jest jako rozpuszczalnik, półprodukt w przemyśle chemicznym oraz jako dodatek do paliw.
 19) Toluen (Metylobenzen) - jest to organiczny związek chemiczny z grupy węglowodorów aromatycznych, stosowany często jako rozpuszczalnik organiczny. Odkrywcą toluenu jest polski chemik Filip Walter.
19) Toluen (Metylobenzen) - jest to organiczny związek chemiczny z grupy węglowodorów aromatycznych, stosowany często jako rozpuszczalnik organiczny. Odkrywcą toluenu jest polski chemik Filip Walter.
Właściwości: Toluen jest bezbarwną cieczą o przyjemnym, intensywnym zapachu. Nie miesza się z wodą, jest natomiast mieszalny z większością rozpuszczalników organicznych. Toluen jest substancją łatwopalną, w postaci płynnej spala się żółtym, silnie kopcącym płomieniem.
Toksyczność: Pomimo znacznie mniejszej toksyczności od benzenu, toluen jest szkodliwy dla układu oddechowego, krwionośnego, rozrodczego, nerwowego i immunologicznego, nerek i wątroby. Obniża zdolność uczenia się. Może wywoływać podrażnienia oczu i skóry, a także uszkodzenia mózgu. Toksyczny dla organizmów wodnych.
Otrzymywanie: Otrzymywany jest w wyniku katalitycznego reformowania ropy naftowej lub frakcyjnej destylacji smoły pogazowej albo na drodze destylacji balsamu peruwiańskiego z południowoamerykańskiego drzewa woniawca balsamowego (Myroxylon balsamum).
(...) Zastosowanie toluenu: Znajduje zastosowanie jako surowiec i rozpuszczalnik w wielu dziedzinach przemysłu organicznego, farmaceutycznego, tworzyw sztucznych do produkcji materiałów wybuchowych (trotyl), barwników, detergentów i perfum oraz jako składnik wysokooktanowych paliw lotniczych. Ze względu na niską temperaturę krzepnięcia wykorzystuje się go również w cieczowych termometrach minimalnych (mierzących najniższą temperaturę powietrza jaka wystąpiła w ciągu doby na wysokości 2 m i 5 cm n.p.g) umieszczonych na terenie stacji i posterunków meteorologicznych. Stosowany także do produkcji żelów, sprayów i farb do włosów oraz lakierów do paznokci. Znajduje się w wykazie prekursorów środków odurzających.
 20) Trifenylometan (Trytan, TrH) - jest to węglowodór aromatyczny, pochodna metanu, w której trzy atomy wodoru zastąpione zostały trzema pierścieniami benzenowymi. Jest podstawowym składnikiem wielu barwników syntetycznych (barwniki triarylometanowe - niektóre z nich używane jako wskaźniki pH). Rozpuszczalny w niepolarnych rozpuszczalnikach organicznych i nierozpuszczalny w wodzie. Stosowany jako stabilizator polimerów i paliw. Grupa trifenylometanowa nosi nazwę grupy trytylowej, np. chlorek trifenylometylu to chlorek trytylu.
20) Trifenylometan (Trytan, TrH) - jest to węglowodór aromatyczny, pochodna metanu, w której trzy atomy wodoru zastąpione zostały trzema pierścieniami benzenowymi. Jest podstawowym składnikiem wielu barwników syntetycznych (barwniki triarylometanowe - niektóre z nich używane jako wskaźniki pH). Rozpuszczalny w niepolarnych rozpuszczalnikach organicznych i nierozpuszczalny w wodzie. Stosowany jako stabilizator polimerów i paliw. Grupa trifenylometanowa nosi nazwę grupy trytylowej, np. chlorek trifenylometylu to chlorek trytylu.
Policykliczne węglowodory aromatyczne:
 1) Acenaften - jest to organiczny związek chemiczny, policykliczny węglowodór aromatyczny, składnik smoły węglowej. Jest to bezbarwny, krystaliczny trójpierścieniowy węglowodór aromatyczny. Pochodne acenaftenu są stosowane do syntez organicznych m.in. leków, barwników, tworzyw sztucznych, środków grzybobójczych i owadobójczych.
1) Acenaften - jest to organiczny związek chemiczny, policykliczny węglowodór aromatyczny, składnik smoły węglowej. Jest to bezbarwny, krystaliczny trójpierścieniowy węglowodór aromatyczny. Pochodne acenaftenu są stosowane do syntez organicznych m.in. leków, barwników, tworzyw sztucznych, środków grzybobójczych i owadobójczych.
2) Aceny (Poliaceny) - grupa wielopierścieniowych węglowodorów aromatycznych zbudowanych ze skondensowanych pierścieni aromatycznych w układzie liniowym.
3) Azuleny - należą one do naturalnych substancji chemicznych z grupy nienasyconych węglowodorów dwupierścieniowych, których pochodne znajdują się w olejkach eterycznych.
4) Benzopireny (C20H12) - są to dwa organiczne związki chemiczne z grupy wielopierścieniowych węglowodorów aromatycznych. Są związkami silnie rakotwórczymi. Zbudowane są z pięciu skondensowanych pierścieni benzenowych. Zawierają czteropierścieniowy szkielet pirenu z dołączonym dodatkowym pierścieniem benzenowym. Tworzą dwa izomery strukturalne różniące się miejscem przyłączenia pierścienia benzenowego do pirenu:
 5) Chryzen - jest to organiczny związek chemiczny, policykliczny węglowodór aromatyczny zbudowany z czterech sprzężonych pierścieni benzenowych skondensowanych kątowo. Węglowodór mniej reaktywny od izomerycznego naftacenu. Chryzen jest w temperaturze pokojowej bezbarwną substancją krystaliczną. Otrzymywany przez pirolizę indenu, lub przez wyodrębnianie z smoły pogazowej. Chryzen jest słabo rozpuszczalny w alkoholu, eterze. Roztwory chryzenu wykazują czerwono-fioletową fluorescencję.
5) Chryzen - jest to organiczny związek chemiczny, policykliczny węglowodór aromatyczny zbudowany z czterech sprzężonych pierścieni benzenowych skondensowanych kątowo. Węglowodór mniej reaktywny od izomerycznego naftacenu. Chryzen jest w temperaturze pokojowej bezbarwną substancją krystaliczną. Otrzymywany przez pirolizę indenu, lub przez wyodrębnianie z smoły pogazowej. Chryzen jest słabo rozpuszczalny w alkoholu, eterze. Roztwory chryzenu wykazują czerwono-fioletową fluorescencję. Otrzymywanie
Fluoren powstaje podczas ogrzewania i spalania materiału organicznego przy niedoborze tlenu. Wydobywa się go z smoły pogazowej. Fluoren powstaje tak jak i wiele innych aromatycznych policykli podczas spalania benzyny oraz olejów napędowych.
Zastosowanie
Fluoren stosuje się do produkcji farb, tworzyw sztucznych oraz pestycydów. Polifluoren jest szeroko rozpowszechniony jako luminofor w polimerowych wyświetlaczach OLED. Fluoren i kilka jego pochodnych działają jako mitogeny, tzn. stymulują podział komórek. Ta właściwość tłumaczy zastosowanie fluorenu i kwasów fluorenokarboksylowych jako środków stymulujących wzrost roślin. W medycynie stosuje się nietoksyczne pochodne fluorenu (np. fluorenon) jako leki wzmagające wzrost tkanek po transplantacji.
7) Heksacen (C26H16) - jest to organiczny związek chemiczny, skondensowany, policykliczny węglowodór aromatyczny zbudowany z sześciu pierścieni benzenowych. Jest półprzewodnikiem organicznym. Krystalizuje w postaci prawie czarnych płytek. Sublimuje się w temperaturze 380 °C.
8) Owalen - jest to organiczny związek chemiczny, policykliczny węglowodór aromatyczny, zbudowany z dziesięciu skondensowanych pierścieni benzenowych. Wykazuje podobieństwo do koronenu. Owalen jest czerwonopomarańczowym związkiem, bardzo słabo rozpuszczalnym w rozpuszczalnikach takich jak benzen, tolueni dichlorometan. Jego roztwory wykazują zjawisko zielonej fluorescencji po wpływem światła UV. Owalen wykryto w pobliżu kominów hydrotermalnych oraz wśród produktów hydrokrakingu ropy naftowej.

9) Perylen - jest to organiczny związek chemiczny, policykliczny węglowodór aromatycznyzbudowany z 5 pierścieni skondensowanych. Wykazuje niebieską fluorescencję pod wpływem światła UV(λem 447 nm dla roztworu w THF - Tetrahydrofuranu).
 |
| Źródło: Wikipedia. Fluorescencja roztworu perylenu w DCM pod wpływem światła UV. |
10) Picen - jest to organiczny związek chemiczny z grupy policyklicznych węglowodorów aromatycznych. Można go wyizolować z karbolineum uzyskanego z węgla brunatnego. W temperaturze poniżej 18 K wykazuje nadprzewodnictwo.
 11) Piren - jest to organiczny związek chemiczny, policykliczny węglowodór aromatyczny zbudowany z czterech sprzężonych pierścieni benzenowych. Piren jest w temperaturze pokojowej bezbarwną substancją krystaliczną. Powstaje w warunkach niezupełnego spalania węgla kamiennego. Otrzymuje się go zwykle przez wyodrębnianie z sadzy. Piren jest słabo toksyczny ale bardzo mocno rakotwórczy. Atakuje nerki i wątrobę. Komercyjnie jest wykorzystywany jako składnik pigmentów, pestycydów i środek plastyfikujący tworzywa sztuczne. W laboratoriach służy często jako wygodny wzorzec do spektroskopii fluorescencyjnej. W krysztale i niektórych roztworach piren tworzy silnie z sobą związane dimery sandwichowe.
11) Piren - jest to organiczny związek chemiczny, policykliczny węglowodór aromatyczny zbudowany z czterech sprzężonych pierścieni benzenowych. Piren jest w temperaturze pokojowej bezbarwną substancją krystaliczną. Powstaje w warunkach niezupełnego spalania węgla kamiennego. Otrzymuje się go zwykle przez wyodrębnianie z sadzy. Piren jest słabo toksyczny ale bardzo mocno rakotwórczy. Atakuje nerki i wątrobę. Komercyjnie jest wykorzystywany jako składnik pigmentów, pestycydów i środek plastyfikujący tworzywa sztuczne. W laboratoriach służy często jako wygodny wzorzec do spektroskopii fluorescencyjnej. W krysztale i niektórych roztworach piren tworzy silnie z sobą związane dimery sandwichowe.
12) Prawastatyna (łac. Pravastatinum) - jest to wielofunkcyjny organiczny związek chemiczny z grupy statyn, pochodzenia naturalnego, produkt metabolizmu mewastatyny przez bakterie Pseudonocardia autotrophica. Stosowana jest jako lek zmniejszający stężenie lipidów, ma także dodatkowe działanie plejotropowe na układ krążenia poprzez wpływ na czynność śródbłonka, stabilizację blaszek miażdżycowych, hamowanie układu krzepnięcia, stymulację układu fibrynolizy, hamowanie reakcji zapalnych oraz działanie immunomodulacyjne.
Historia: W 1959 w Instytucie Molekularnej Biologii Komórki i Genetyki Maxa Plancka odkryto enzymreduktazę HMG-CoA, pełniący kluczową rolę w szlaku metabolicznym syntezy cholesterolu. W latach 60. XX wieku ustalono, iż wątroba nawet przy diecie bezcholesterolowej jest w stanie zwiększyć swoją zdolność do syntezy cholesterolu w stopniu wystarczającym na pokrycie potrzeb całego organizmu. W 1973 roku zespół Akiry Endō po przebadaniu ponad 6000 mikroorganizmów, głównie grzybów strzępkowych, wykazał, że substancja ML-236B (mewastatyna) wydzielana przez Penicillium citrinum ma właściwości obniżania poziomu cholesterolu oraz lipoproteiny niskiej gęstości (LDL) w surowicy zwierząt laboratoryjnych i ludzi, jednakże badania na zwierzętach wykazały jej potencjalną toksyczność. 4 listopada 1980 odkryta równocześnie przez zespół Akira Endō w Japonii i zespół Alfreda Albertsa w USA – lowastatyna (mewinolina, monakolina K) jako pierwsza statyna została opatentowana w Stanach Zjednoczonych i jako pierwsza została wprowadzona na rynek farmaceutyczny w 1987 pod nazwą Mevacor.
 13) Rubren (Tetrafenyloteracen) - jest to organiczny związek chemiczny z grupy sprzężonych węglowodorów aromatycznych. W temperaturze pokojowej występuje w postaci intensywnie czerwonych kryształów. Znaczne jego ilości są stosowane jako uczulacz chemoluminoscencyjny, jest m.in. jednym ze składników świecących na żółto farb i lampek luminescencyjnych, przedłużających okres ich działania.
13) Rubren (Tetrafenyloteracen) - jest to organiczny związek chemiczny z grupy sprzężonych węglowodorów aromatycznych. W temperaturze pokojowej występuje w postaci intensywnie czerwonych kryształów. Znaczne jego ilości są stosowane jako uczulacz chemoluminoscencyjny, jest m.in. jednym ze składników świecących na żółto farb i lampek luminescencyjnych, przedłużających okres ich działania.
 14) Trifenylen (1,2,3,4-dibenzonaftalen lub izochryzen) - jest to organiczny związek chemiczny, skondensowany, policykliczny węglowodór aromatyczny o wzorze sumarycznym C18H12, zbudowany z 4 pierścieni benzenowych występujący w smole pogazowej.
14) Trifenylen (1,2,3,4-dibenzonaftalen lub izochryzen) - jest to organiczny związek chemiczny, skondensowany, policykliczny węglowodór aromatyczny o wzorze sumarycznym C18H12, zbudowany z 4 pierścieni benzenowych występujący w smole pogazowej.
 1) Asfalt - jest to materiał (lepka ciecz lub skała) pochodzenia naturalnego (asfalt naturalny) lub otrzymywany jako jedna z frakcji przerobu ropy naftowej (asfalt ponaftowy), o konsystencji stałej lub półstałej o barwie od ciemnobrązowej do czarnej. Jest on układem koloidalnym o dużej trwałości, składającym się z dwóch faz: rozproszonej (asfalteny) i rozpraszającej (oleje). Jest stosowany do budowy nawierzchni dróg, do produkcji papy oraz jako materiał izolacyjny (lepik asfaltowy). Jest to mieszanina wielkocząsteczkowych węglowodorów łańcuchowych cyklicznych oraz związków heterocyklicznych. O jakości asfaltu decyduje jego temperatura mięknienia, ciągliwość, stopień penetracji, łamliwość. Należy do tak zwanych bitumów.
1) Asfalt - jest to materiał (lepka ciecz lub skała) pochodzenia naturalnego (asfalt naturalny) lub otrzymywany jako jedna z frakcji przerobu ropy naftowej (asfalt ponaftowy), o konsystencji stałej lub półstałej o barwie od ciemnobrązowej do czarnej. Jest on układem koloidalnym o dużej trwałości, składającym się z dwóch faz: rozproszonej (asfalteny) i rozpraszającej (oleje). Jest stosowany do budowy nawierzchni dróg, do produkcji papy oraz jako materiał izolacyjny (lepik asfaltowy). Jest to mieszanina wielkocząsteczkowych węglowodorów łańcuchowych cyklicznych oraz związków heterocyklicznych. O jakości asfaltu decyduje jego temperatura mięknienia, ciągliwość, stopień penetracji, łamliwość. Należy do tak zwanych bitumów.

 11) Piren - jest to organiczny związek chemiczny, policykliczny węglowodór aromatyczny zbudowany z czterech sprzężonych pierścieni benzenowych. Piren jest w temperaturze pokojowej bezbarwną substancją krystaliczną. Powstaje w warunkach niezupełnego spalania węgla kamiennego. Otrzymuje się go zwykle przez wyodrębnianie z sadzy. Piren jest słabo toksyczny ale bardzo mocno rakotwórczy. Atakuje nerki i wątrobę. Komercyjnie jest wykorzystywany jako składnik pigmentów, pestycydów i środek plastyfikujący tworzywa sztuczne. W laboratoriach służy często jako wygodny wzorzec do spektroskopii fluorescencyjnej. W krysztale i niektórych roztworach piren tworzy silnie z sobą związane dimery sandwichowe.
11) Piren - jest to organiczny związek chemiczny, policykliczny węglowodór aromatyczny zbudowany z czterech sprzężonych pierścieni benzenowych. Piren jest w temperaturze pokojowej bezbarwną substancją krystaliczną. Powstaje w warunkach niezupełnego spalania węgla kamiennego. Otrzymuje się go zwykle przez wyodrębnianie z sadzy. Piren jest słabo toksyczny ale bardzo mocno rakotwórczy. Atakuje nerki i wątrobę. Komercyjnie jest wykorzystywany jako składnik pigmentów, pestycydów i środek plastyfikujący tworzywa sztuczne. W laboratoriach służy często jako wygodny wzorzec do spektroskopii fluorescencyjnej. W krysztale i niektórych roztworach piren tworzy silnie z sobą związane dimery sandwichowe. - Temperatura topnienia: 145–148 °C (Beilstein).
- Temperatura wrzenia : 404 °C
Piren jest rozpuszczalny w alkoholu, eterze. Roztwory pirenu wykazują niebieską fluorescensję.
12) Prawastatyna (łac. Pravastatinum) - jest to wielofunkcyjny organiczny związek chemiczny z grupy statyn, pochodzenia naturalnego, produkt metabolizmu mewastatyny przez bakterie Pseudonocardia autotrophica. Stosowana jest jako lek zmniejszający stężenie lipidów, ma także dodatkowe działanie plejotropowe na układ krążenia poprzez wpływ na czynność śródbłonka, stabilizację blaszek miażdżycowych, hamowanie układu krzepnięcia, stymulację układu fibrynolizy, hamowanie reakcji zapalnych oraz działanie immunomodulacyjne.
Historia: W 1959 w Instytucie Molekularnej Biologii Komórki i Genetyki Maxa Plancka odkryto enzymreduktazę HMG-CoA, pełniący kluczową rolę w szlaku metabolicznym syntezy cholesterolu. W latach 60. XX wieku ustalono, iż wątroba nawet przy diecie bezcholesterolowej jest w stanie zwiększyć swoją zdolność do syntezy cholesterolu w stopniu wystarczającym na pokrycie potrzeb całego organizmu. W 1973 roku zespół Akiry Endō po przebadaniu ponad 6000 mikroorganizmów, głównie grzybów strzępkowych, wykazał, że substancja ML-236B (mewastatyna) wydzielana przez Penicillium citrinum ma właściwości obniżania poziomu cholesterolu oraz lipoproteiny niskiej gęstości (LDL) w surowicy zwierząt laboratoryjnych i ludzi, jednakże badania na zwierzętach wykazały jej potencjalną toksyczność. 4 listopada 1980 odkryta równocześnie przez zespół Akira Endō w Japonii i zespół Alfreda Albertsa w USA – lowastatyna (mewinolina, monakolina K) jako pierwsza statyna została opatentowana w Stanach Zjednoczonych i jako pierwsza została wprowadzona na rynek farmaceutyczny w 1987 pod nazwą Mevacor.
 13) Rubren (Tetrafenyloteracen) - jest to organiczny związek chemiczny z grupy sprzężonych węglowodorów aromatycznych. W temperaturze pokojowej występuje w postaci intensywnie czerwonych kryształów. Znaczne jego ilości są stosowane jako uczulacz chemoluminoscencyjny, jest m.in. jednym ze składników świecących na żółto farb i lampek luminescencyjnych, przedłużających okres ich działania.
13) Rubren (Tetrafenyloteracen) - jest to organiczny związek chemiczny z grupy sprzężonych węglowodorów aromatycznych. W temperaturze pokojowej występuje w postaci intensywnie czerwonych kryształów. Znaczne jego ilości są stosowane jako uczulacz chemoluminoscencyjny, jest m.in. jednym ze składników świecących na żółto farb i lampek luminescencyjnych, przedłużających okres ich działania.
Krysztaliczny rubren i stężone roztwory rubrenu posiadają własności półprzewodnikowe, dzięki czemu związek ten jest stosowany w diodach elektroluminescencyjnych i wyświetlaczach opartych na tych diodach.
Monokrystaliczny rubren posiada bardzo wysoką jak na organiczne półprzewodniki mobilność transportu ładunku elektrycznego (~30), co wskazuje na fakt, że mechanizm jego przewodnictwa jest zbliżony do tradycyjnych materiałów półprzewodnikowych. Zademonstrowano również dowody na występowania w kryształach rubrenu efektu Halla, co jest pośrednim dowodem na pasmowy charakter przewodnictwa w tym materiale.
 14) Trifenylen (1,2,3,4-dibenzonaftalen lub izochryzen) - jest to organiczny związek chemiczny, skondensowany, policykliczny węglowodór aromatyczny o wzorze sumarycznym C18H12, zbudowany z 4 pierścieni benzenowych występujący w smole pogazowej.
14) Trifenylen (1,2,3,4-dibenzonaftalen lub izochryzen) - jest to organiczny związek chemiczny, skondensowany, policykliczny węglowodór aromatyczny o wzorze sumarycznym C18H12, zbudowany z 4 pierścieni benzenowych występujący w smole pogazowej.
15) Kekulen - organiczny związek chemiczny, policykliczny węglowodór aromatyczny (dwunastocykliczny). Jest zbudowany z dwunastu pierścieni benzenu, skondensowanych w kształcie pierścienia. Zsyntetyzowany w 1978 i nazwany na cześć Friedricha Augusta Kekulégo – odkrywcy struktury benzenu.
*MIESZANINY WĘGLOWODORÓW:
 1) Asfalt - jest to materiał (lepka ciecz lub skała) pochodzenia naturalnego (asfalt naturalny) lub otrzymywany jako jedna z frakcji przerobu ropy naftowej (asfalt ponaftowy), o konsystencji stałej lub półstałej o barwie od ciemnobrązowej do czarnej. Jest on układem koloidalnym o dużej trwałości, składającym się z dwóch faz: rozproszonej (asfalteny) i rozpraszającej (oleje). Jest stosowany do budowy nawierzchni dróg, do produkcji papy oraz jako materiał izolacyjny (lepik asfaltowy). Jest to mieszanina wielkocząsteczkowych węglowodorów łańcuchowych cyklicznych oraz związków heterocyklicznych. O jakości asfaltu decyduje jego temperatura mięknienia, ciągliwość, stopień penetracji, łamliwość. Należy do tak zwanych bitumów.
1) Asfalt - jest to materiał (lepka ciecz lub skała) pochodzenia naturalnego (asfalt naturalny) lub otrzymywany jako jedna z frakcji przerobu ropy naftowej (asfalt ponaftowy), o konsystencji stałej lub półstałej o barwie od ciemnobrązowej do czarnej. Jest on układem koloidalnym o dużej trwałości, składającym się z dwóch faz: rozproszonej (asfalteny) i rozpraszającej (oleje). Jest stosowany do budowy nawierzchni dróg, do produkcji papy oraz jako materiał izolacyjny (lepik asfaltowy). Jest to mieszanina wielkocząsteczkowych węglowodorów łańcuchowych cyklicznych oraz związków heterocyklicznych. O jakości asfaltu decyduje jego temperatura mięknienia, ciągliwość, stopień penetracji, łamliwość. Należy do tak zwanych bitumów.
Nazewnictwo: Potocznie asfaltem nazywa się asfaltobeton, czyli mieszankę mineralno-asfaltową używaną do budowy nawierzchni dróg, w której asfalt używany jest jako lepiszcze wiążące kruszywa. Masa ta w polszczyźnie okresu międzywojennego nosiła nazwę smołowiec. Asfaltu nie należy mylić ze smołą (która jest produktem odgazowania węgla lub drewna, a nie frakcją ropy naftowej). Definicja określająca asfalt jako lepiszcze naturalne lub otrzymywane z ropy naftowej funkcjonuje w Polsce i Stanach Zjednoczonych. W krajach Europy Zachodniej i w Rosji termin ten oznacza mieszaninę lepiszcza z kruszywem, a samo lepiszcze nazywane jest bitumem.
 |
| Źródło: Wikipedia. Jezioro naturalnego asfaltu na Trynidadzie. |
2) Asfalt naturalny - są to złoża asfaltu występujące w przyrodzie na ogół w pobliżu złóż ropy naftowej w postaci:
- złóż bitumicznych - o zawartości 55-98% czystego asfaltu,
- skał bitumicznych - najczęściej są to wapienie, dolomity, czasem piaskowce, skały o porowatej strukturze nasycone asfaltem, w których zawartość asfaltu wynosi ok. 10-15% objętości skały.
Asfalt naturalny jest zbyt twardy, by mógł być stosowany jako samodzielne lepiszcze. Stosuje się go jako dodatek do asfaltów ponaftowychw ilości 5–15% w, w celu poprawienia ich właściwości. Największe złoża asfaltu naturalnego występują w Wenezueli, Albanii i na Trynidadzie.
3) Asfalt syryjski - substancja bitumiczna występująca w złożach naturalnych, stosuje się w grafice warsztatowej jako substancję kwasoodporną. Jest jednym ze składników werniksów graficznych. Jako proszek napylana jest w akwatincie, heliograwiurze i odprysku. Asfalt syryjski wykorzystany był także jako substancja światłoczuła w pierwszej fotografii wykonanej przez Josepha-Nicéphore'a Niépce.
- Substancja bitumiczna - występuje w skałach osadowych w postaci rozproszonych drobnych, czarnych ziaren, nierozpuszczalnych w rozpuszczalnikach organicznych. Substancja pochodzenia roślinnego i zwierzęcego powstała w wyniku biochemicznego i geochemicznego przeobrażenia.
4) Benzyna (łac. Benzoe -> nazwa żywicy jednego z drzew egzotycznych, ang. gasoline lub petrol) - jest to mieszanina ciekłych węglowodorów, jeden z głównych rodzajów paliwa stosowanego do napędu samochodów, samolotów i niektórych innych urządzeń posiadających silnik spalinowy. Stosowana także jako rozpuszczalnik. Z chemicznego punktu widzenia, głównymi składnikami benzyn są węglowodory alifatyczne o liczbie atomów węgla od 5 do 12. Występują również śladowe ilości węglowodorów nienasyconych oraz aromatycznych. Benzyna dostarcza energii silnikowi poprzez spalanie się, czyli reakcję chemiczną z tlenem pochodzącym z atmosfery. Ze względu na to, że benzyna jest w silnikach spalana w bardzo krótkich cyklach, proces ten musi przebiegać maksymalnie szybko i równomiernie w całej objętości cylindrów silnika. Osiąga się to poprzez mieszanie benzyny z powietrzem przed dostarczeniem jej do cylindrów, tworząc tzw. mieszaninę paliwowo-powietrzną, czyli zawiesinę (mgłę) bardzo drobnych kropelek benzyny w powietrzu. Bardzo istotny wpływ na przebieg tego spalania ma też skład chemiczny benzyny. Głównymi parametrami określającymi właściwości benzyny jako paliwa jest liczba oktanowa oraz wartośc opałowa. Benzynę syntetyczną produkuje się m.in. poprzez rektyfikację ropy naftowej. Jej skład jest zależny od wyjściowego składu ropy i warunków rektyfikacji. W celu poprawy własności benzyny jako paliwa do silników dodaje się niewielkie ilości (poniżej 1%) wybranych związków chemicznych, nazywanych środkami przeciwstukowymi. Od lat 30. XX w. do połowy lat 80. najczęściej dodawanym w tym celu związkiem był tetraetyloołów, a utworzone w ten sposób paliwo nazywa się etyliną. Jego spalanie powodowało jednak emisję do środowiska silnie toksycznych i rakotwórczych związków ołowiu. W związku z tym, w połowie lat 80. opracowano nowe rodzaje benzyn – tzw. benzyny bezołowiowe. Dodaje się do nich węglowodory aromatyczne, eterów z grupami aromatycznymi oraz MMT. Poprawia to skutecznie liczbę oktanową, ale związki te nie spalają się całkowicie w komorze silnika i dlatego muszą być „dopalane” na katalizatorach platynowych umieszczanych w układzie wydechowym samochodów.

Benzyna jest też stosowana jako rozpuszczalnik. W handlu jako rozpuszczalnik występuje ona w dwóch rodzajach:
- Benzyna ekstrakcyjna – jest to benzyna lekka (zawierająca węglowodory o liczbie atomów węgla od 5 do 7), którą odrzuca się w procesie otrzymywania benzyny paliwowej, ze względu na zbyt niską temperaturę wrzenia. Oczyszcza się ją przez płukanie (ekstrakcję) z wodą i stąd pochodzi jej nazwa.
- Benzyna lakowa – jest to benzyna ciężka (zawierająca węglowodory o liczbie atomów węgla od 10 do 15–16), którą odrzuca się w procesie otrzymywania benzyny paliwowej ze względu na zbyt wysoką temperaturę wrzenia. Nazwa ta pochodzi od tego, że jest stosowana jako rozcieńczalnik do lakierów (także farb i innych wyrobów ftalowych i olejnych, bitumicznych oraz pokostów); nie ma nic wspólnego natomiast z produkcją laku do pieczęci, który jest mieszaniną naturalnych pochodnych przemysłu drzewnego (m.in. terpentyny, kalafonii), dodatków mineralnych (kreda itp.) i barwników.
Właściwości:
Właściwości benzyny różnią się w zależności od składu i zawierają się w przedziałach[2][3]:
- temperatura wrzenia: 35–230 °C
- ciepło parowania: 315–350 kJ/kg
- ciepło spalania: ok. 42 MJ/kg (10 kcal/g)
- gęstość: 0,67–0,8 g/cm³ (ok. 0,67 g/cm³ – benzyna lekka, ok. 0,78 g/cm³ – benzyna ciężka)
- wartość opałowa: 42,6-44 MJ/kg w stanie ciekłym, 3,70 MJ/m³ w przypadku mieszanki stechiometrycznej
- stała stechiometryczna paliwa: 14,9 kgpowietrza/kgpaliwa
- zawartość ołowiu: maksymalnie 5 mg/l
- zawartość siarki: maksymalnie 50 mg/kg
- indeks lotności (VLI): maksymalnie 1150
5) Eter naftowy (nazywany też lekką benzyną lub benzyną ekstrakcyjną) – mieszanina węglowodorów (głównie alkanów) pochodząca z procesu rektyfikacji ropy naftowej o średniej temperaturze wrzenia 70-90 °C. Eter naftowy zawiera zwykle mieszaninę izomerów pentanu, heksanu i heptanu w różnych proporcjach, zależnie od temperatury wrzenia.
6) Gacz parafinowy:
7) Gazolina - mieszanina ciekłych alkanów zawierających maksymalnie 9 atomów węgla w cząsteczce, głównie pentanu i heksanu. Jest łatwopalna, jej gęstość wynosi ok. 0,67 g/cm3, a liczba oktanowa oscyluje w zakresie 70–75. Otrzymuje się ją z tzw. mokrego gazu ziemnego lub w wyniku przeróbki ropy naftowej. Stosowana jest jako dodatek do benzyn lub półprodukt do ich produkcji oraz jako rozpuszczalnik.
8) Nafta:
9) Olej bazowy:
10) Parafina:
11) Spirytus mineralny:
12) Wazelina:






























































































































































































































































Brak komentarzy:
Prześlij komentarz